新しく作られたタンパク質の長さや大きさで、合成の不安定性を制御する
2021-11-17 東京工業大学
要点
- 負電荷アミノ酸が連続する配列をもつタンパク質は、合成が途中で中断するリスクがある。
- リボソームの内部の「トンネル」では、新しく作られたタンパク質の長さや大きさによって、タンパク質合成の不安定性を制御していることを発見。
- 負電荷アミノ酸に先行して合成された新生タンパク質とリボソーム内部の相互作用が、合成中断リスクを抑制することを見出した。
概要
東京工業大学 科学技術創成研究院の茶谷悠平特任助教、田口英樹教授、理化学研究所の岩崎信太郎主任研究員らのグループ※は、翻訳の連続性を破綻させる「リボソーム[用語1]の不安定化」現象について解析し、リボソーム内部の新生タンパク質(新生鎖と呼ぶ)の通り道(「トンネル」)と新生鎖間との相互作用が、翻訳破綻のリスクを抑制していることを見出した。
細胞内装置であるリボソームは、DNAからメッセンジャーRNA(mRNA)に転写された遺伝情報をもとにあらゆるタンパク質を合成する(生命のセントラルドグマ[用語2]における「翻訳」過程)。その際、いわば、タンパク質の設計図であるmRNAは、最初から最後まで連続的に読み取られる必要があり、読み取りが途中で止まってしまうと、タンパク質の「不良品」が生み出されてしまう。こうしたタンパク質の「不良品」を生み出さないためには、mRNAの開始コドンから終止コドンまでの領域を途切れることなく連続的に翻訳できるよう保証することが、生命にとって必須となる。
これまで、細胞内で、タンパク質合成の場となるリボソーム自身が翻訳の連続性に寄与すると経験的に理解されていたものの、具体的にどのようなメカニズムで「翻訳」の連続性が保証されているのかは不明だった。
本研究により、リボソーム内部の「トンネル」において作られた新しいタンパク質(新生ポリペプチド鎖)の長さと大きさによって、「リボソームの不安定化」が免れることがわかった。このメカニズムにより、リボソームは多種多様なアミノ酸配列のタンパク質を途切れることなく合成できる万能性を獲得し、今日に至るまでのタンパク質進化が可能になったものと考えられる。
この成果は、欧州分子生物学機構が発行する専門誌The EMBO Journalのオンライン速報版で10月20日に公開された。
背景
タンパク質は、生命活動を担う必須の物質である。タンパク質は、DNAからmRNAへと写しとられた遺伝情報をもとに、細胞内装置であるリボソームがアミノ酸配列へと変換(「翻訳」と呼ぶ)することで合成される。合成途上にある新生タンパク質(新生ポリペプチド鎖、これを新生鎖と呼ぶ)は、リボソームの大サブユニットを貫通する「トンネル」を通過しながら伸長していく。近年、この「トンネル」を通過して新たに生み出される新生鎖は、そのアミノ酸配列の並びなどによって多様にリボソームの機能を制御し得ることがわかってきている。例えば、本研究グループは過去に、負電荷アミノ酸に富む新生鎖を合成する途上で翻訳が破綻する現象(Intrinsic Ribosome Destabilization:内因性リボソーム不安定化現象、IRDと命名)を発見、その生物学的な意義も含めて報告した。ゲノムの遺伝情報の中にはIRDを誘発しタンパク質合成を途中で止め得るアミノ酸配列が多数書き込まれているが、必ずしもその全てが翻訳を中断するとは限らない。どのような条件でIRDが発生して翻訳を終わらせるのかについて、これまでに解明されていなかった。
研究成果
今回本研究グループはこの疑問を解決すべく、ゲノムの遺伝情報中に存在する負電荷アミノ酸に富む配列でのIRDについて検討を行った。その結果、リボソームが翻訳を開始してすぐに負電荷アミノ酸に富む配列を翻訳した場合、IRDによる翻訳破綻リスクが上昇する一方、ある程度合成が進行した場合にはリスクがほぼ抑制されることがわかった。両者の違いの詳細を、実際の細胞は使わない実験環境下(試験管内無細胞翻訳系)や、翻訳中のリボソームのmRNA上の分布を網羅的に記述する「リボソームプロファイリング」という方法で解析した結果、リボソームを貫通する「トンネル」内を占める新生鎖が長くなるほど、また、リボソームのタンパク質合成の場となる触媒中心付近(「トンネル」の入り口付近)での新生鎖のアミノ酸のサイズが大きくなる(かさ高くなる)ほど、IRDを強く抑制することが明らかとなった。つまり、リボソーム内の「トンネル」において新しいタンパク質(ポリペプチド鎖)が、長く、大きく、新たにできていればいるほど、リボソームは不安定化から免れることがわかった。
IRDを誘発し得る負電荷アミノ酸に富んだ配列は大腸菌をはじめとする原核生物の約半数以上の遺伝子に存在するが、リボソームトンネルと新生鎖の緩やかな相互作用によって翻訳の破綻が抑制されることで、細胞内のタンパク質社会の秩序が維持されているものと考えられる。
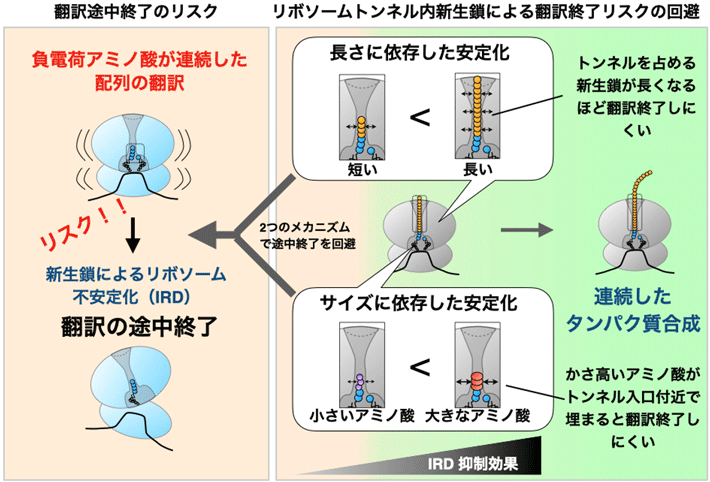
- 図1.
- 新生タンパク質(新生ポリペプチド鎖、新生鎖)によるリボソームの安定化によりタンパク質合成時の連続性が保証される。
リボソームはどんなアミノ酸配列でも連結してタンパク質を合成(翻訳)する必要があるが、負電荷アミノ酸が並んだ配列で翻訳が途中で終了するなどリスクを有する配列もある。リボソームに備わっているトンネル内部を合成途上の新生ポリペプチド鎖(新生鎖)が通過するとき、その新生鎖自身がリボソームを安定化し、翻訳の中断を軽減するメカニズムとなることがわかった。その安定化には、1)トンネル内新生鎖の長さ、2)リボソームの触媒中心付近での新生鎖のアミノ酸のサイズ、という2つのメカニズムが関わる。
今後の展開
これまで、リボソームが新生鎖を内側に内包する「トンネル」構造を持つ理由について様々な議論がされてきた。本研究で見出した「リボソーム『トンネル』はタンパク質合成が途中で終わるリスクを軽減するために必要である」という知見は、そうした議論に新たな視点をもたらし、リボソームの進化学的理解の一助となる可能性がある。また別の観点として、生物が多種多様なタンパク質をできる限りつつがなく合成するための大前提の1つが明らかになったとも言える。リボソームの「トンネル」がタンパク質合成をコントロールする、このメカニズムをさらに深く理解し、応用することで、これまで困難だった有用タンパク質の大量生産も可能になると期待される。
発表者
東京工業大学
科学技術創成研究院
特任助教 茶谷悠平
助教 丹羽達也
教授 田口英樹
生命理工学院
大学院生(修士課程2年 研究当時) 菅田信幸
大学院生(修士課程2年 研究当時) 伊藤遥介
理化学研究所
開拓研究本部 岩崎RNAシステム生化学研究室
主任研究員 岩崎信太郎
用語説明
[用語1] リボソーム : RNAとタンパク質からなる巨大な複合体でタンパク質の合成装置。リボソームはメッセンジャーRNAの塩基配列を読み取って、遺伝子に書き込まれている遺伝暗号に従って20種類のアミノ酸を選び、特定の順番に繋げていくことにより、タンパク質の鎖(ポリペプチド鎖)を合成する。
[用語2] 生命のセントラルドグマ : DNA→RNA→タンパク質という情報の流れと変換を記述した分子生物学の根幹をなす概念のこと。大きくは、DNAの塩基配列の情報がメッセンジャーRNAに写される「転写」と、メッセンジャーRNA、トランスファーRNA、およびリボソームなどの共同作用でタンパク質を合成する「翻訳」に分かれる。
論文情報
掲載誌 :The EMBO Journal
論文タイトル :Nascent polypeptide within the exit tunnel stabilizes the ribosome to counteract risky translation
(和訳:リボソームトンネル内の新生ポリペプチド鎖はリボソームを安定化して翻訳失敗のリスクを軽減する)
著者 :Yuhei Chadani, Nobuyuki Sugata, Tatsuya Niwa, Yosuke Ito, Shintaro Iwasaki, Hideki Taguchi