2021-08-28 厚生労働省
モデルナ社製の新型コロナワクチンについては、未使用の状態での異物の混入が複数の接種施設より報告され、関連する3ロットの使用見合わせを実施しているところです。これら3つのロットのうち、同様の異物混入は報告されていないものの、同じ時期に同じ設備で製造されたことにより使用を見合わせているロットの1つにおいて、ワクチンの接種後に2件の死亡事例が報告されましたのでお知らせします。
なお、2件の死亡事例の報告のうち1例目については、使用の見合わせの前に、既に副反応疑いとして報告されていましたが、2例目については、見合わせた後に、新たに報告されたものです。
対象ロット:
Lot 3004667(約5万7千本)※異物混入
Lot 3004734(約5万2千本)※異物混入の報告はないが、2例の死亡事例の報告あり。
Lot 3004956(約5万4千本)※異物混入の報告はない
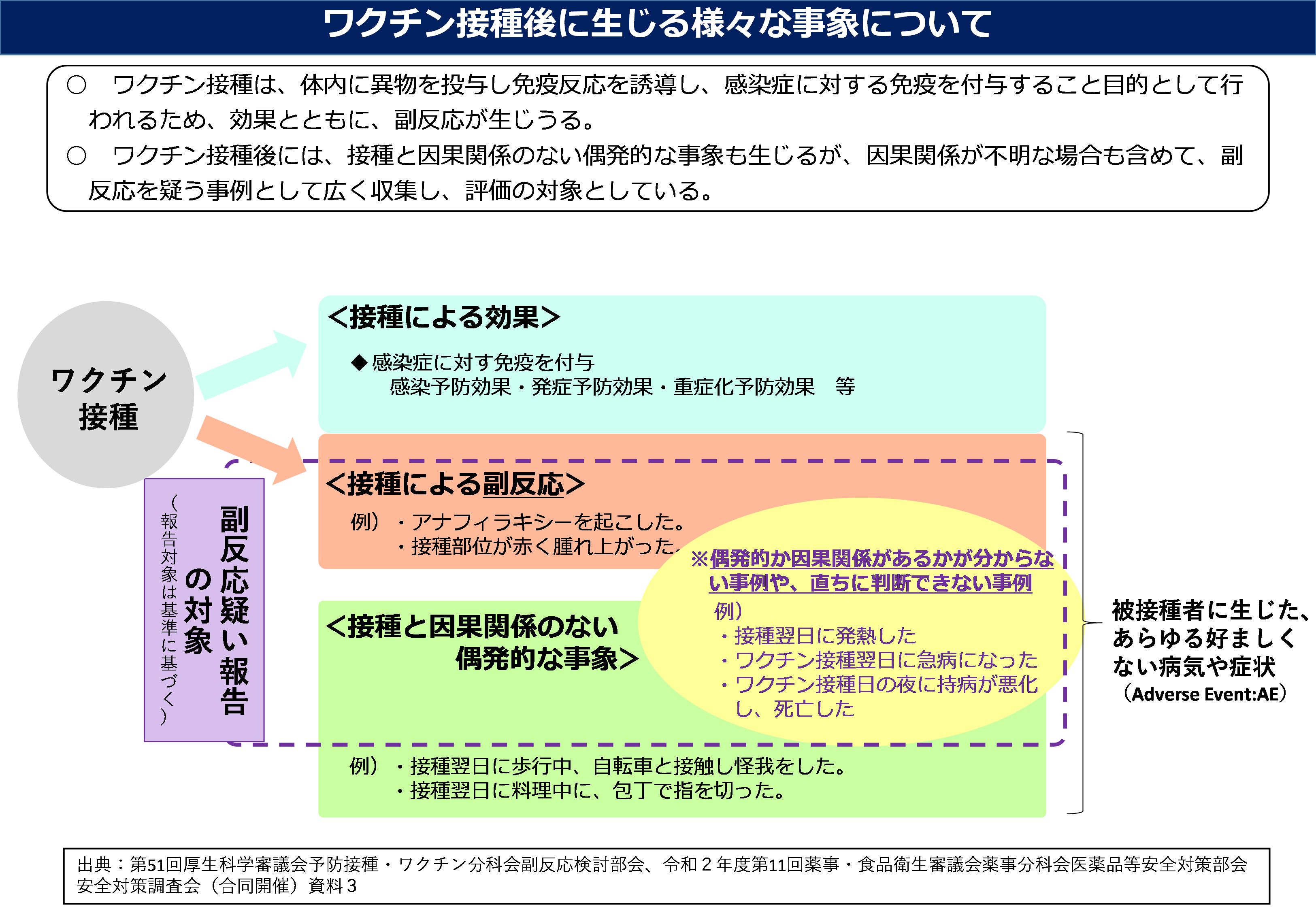
ワクチン接種後には、様々な反応が生じます。この副反応疑い報告は、国がワクチンの安全性の評価を行うために、ワクチン接種によるものではない偶発的な症状も含めて、広く収集しているものです。本プレスリリースは、使用見合わせの対象ロットで複数の死亡の報告を受けたことから、ワクチン接種との関係は不明ですが、副反応疑い報告制度の透明性の向上等のため、公表することとしたものです。
今後、厚生労働省では、専門家によるワクチン接種との因果関係の評価や審議会での検討を行い、ワクチン接種の安全性を評価することとしています。
<用語の説明>
副反応疑い報告制度:
予防接種後に発生した特定の症状(アナフィラキシー等)や、医師等が予防接種との関連を否定できない重篤な症状の報告を行う制度です。そのため、報告には、偶発的なものや他の原因によるものなど、予防接種との関連がないものも含まれ得ます。
副反応:
予防接種後に発生した病気や症状のうち、予防接種との因果関係が否定できないものです。
因果関係の評価:
国内外の科学的知見等をもとに、外部専門家と連携し、個々の副反応疑い報告事例について、ワクチン接種との関連の評価を行います。さらに、因果関係の評価結果を踏まえ、厚生労働省の審議会※で、ワクチン接種の安全性を評価します。
※厚生科学審議会予防接種・ワクチン分科会副反応検討部会、薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会
照会先
医薬・生活衛生局医薬安全対策課
室 長:高橋 暁子
課長補佐:塩川 智則
健康局健康課予防接種室
調整官:鶴田 真也
専門官:山口 敏弘
医薬・生活衛生局監視指導・麻薬対策課
室 長:江野 英夫
課長補佐:山本 剛