2021-09-07 奈良県立医科大学,立命館大学,徳島大学,名古屋大学,日本医療研究開発機構
概要
近年、筋萎縮性側索硬化症(ALS)や前頭側頭型認知症(FTD)などの神経疾患では、生物学的相分離(以下、「相分離」という。)※1制御の異常がおこることが報告されていますが、その詳細な機序については不明な点が多くあります。奈良県立医科大学の森英一朗准教授(未来基礎医学)、同大学の杉江和馬教授(脳神経内科学)、立命館大学の吉澤拓也講師、徳島大学の齋尾智英教授、名古屋大学の愛場雄一郎准教授らの共同研究チームは、C9orf72遺伝子の非翻訳領域リピート異常伸長が原因のALSやFTDにおいて産生される毒性ペプチドが、相分離制御因子の機能を阻害する分子メカニズムを明らかにしました。今回の研究成果は、ALSやFTDをはじめとする神経変性疾患の病態解明、治療法開発につながることが期待されます。本研究成果は、2021年9月6日18時(日本時間)付で国際科学誌『Nature Communications』に掲載されました。
研究の背景
筋萎縮性側索硬化症(ALS)は、運動神経が変性し、筋萎縮・構音嚥下障害が進行する神経難病です。前頭側頭型認知症(FTD)は、人格変化や言語障害がみられる認知症で、いずれも神経細胞内に凝集体が形成され、根本的な治療法がない疾患です。近年、遺伝性ALSなどの研究から、これらの疾患では細胞内における相分離という現象が重要であることが徐々に分かってきました。
相分離により、細胞内で物質が区画化され、ストレス顆粒などの膜を持たないオルガネラが形成されます。これらの中では、アミノ酸が数種類に偏った低複雑性(LC:low-complexity)ドメインを持つRNA結合タンパク質※2が、相分離して機能していますが、相分離の制御が破綻すると不溶性のアミロイド形成につながると考えられています。核-細胞質間のRNA結合タンパク質等の輸送は、Karyopherinβ2(Kapβ2)などの核内輸送受容体※3が担っていますが、これらは相分離の制御因子としても働いていることが近年報告されました。また最近、C9orf72遺伝子異常※4を有するALS/FTDで生じる毒性ペプチドが、核内輸送受容体に結合して、核-細胞質間の物質輸送を阻害することが報告されましたが、その詳細な分子メカニズムや相分離への影響は不明でした。
そこで本研究グループは、C9orf72遺伝子異常を有するALS/FTDで生じる毒性ペプチドが、Kapβ2などの相分離制御因子に与える影響を解析しました。
研究の成果
本研究では、生化学的、細胞生物学的実験や、物理化学的解析、構造解析、シミュレーションなどの幅広い手法を統合的に用いて、毒性ペプチドが相分離制御因子の機能を阻害するメカニズムを分子レベルで明らかにしました。Kapβ2はFUSなどのRNA結合タンパク質の核移行シグナル(NLS)に結合して相分離を制御することがこれまで報告されていますが、今回の研究で、アルギニンを多く含む毒性ペプチド(PRn)がKapβ2のNLS結合部位を標的とすることで相分離を破綻させる、というモデルが提唱されました(図1)。
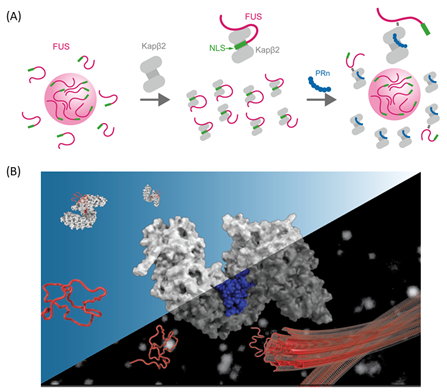
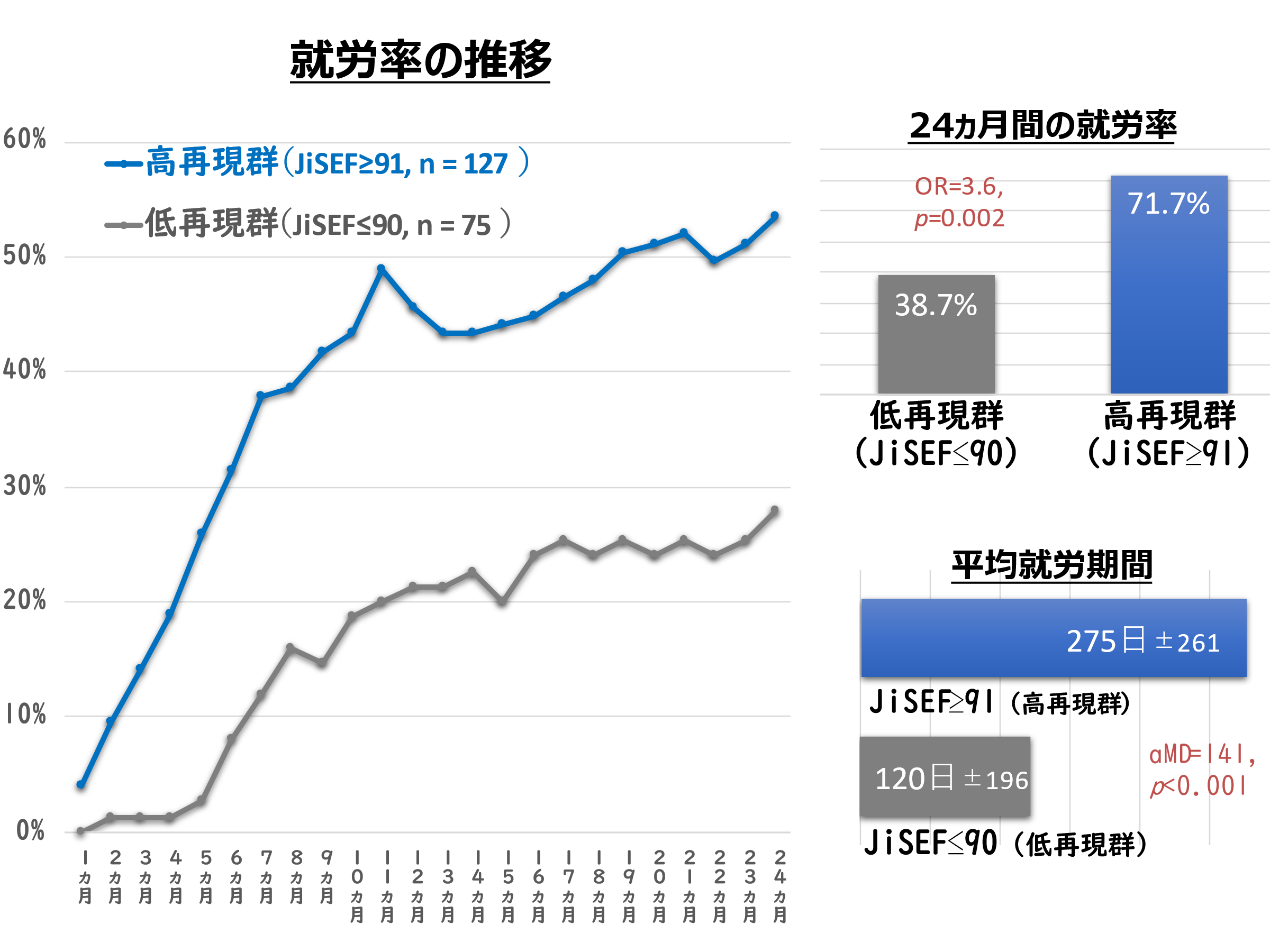
図1.PRnによるKapβ2の相分離制御機能阻害のモデル(A)Kapβ2はRNA結合タンパク質のFUSのNLSを認識して相分離を制御するが、PRnがKapβ2のNLS結合部位を標的とすることで、相分離が破綻する。(B)イメージ図。通常(左上)はKapβ2がRNA結合タンパク質の相分離を制御しているが、毒性ペプチドがあるとKapβ2の機能が阻害され、液滴形成や、ポリマー化が促進される(右下)。
今回の研究では、まずC9orf72の非翻訳領域リピートの異常伸長から産生される5種類の毒性ペプチドが、Kapβ2の相分離制御能に与える影響を解析しました(図2)。精製タンパク質を用いた濁度評価により、アルギニンを多く含む毒性ペプチドであるGRnおよびPRnが、Kapβ2の相分離制御能を阻害することが明らかとなりました。液滴形成の評価および、ヒドロゲルを用いた生化学的評価でも、PRnによる相分離制御能の阻害効果を確認しました。
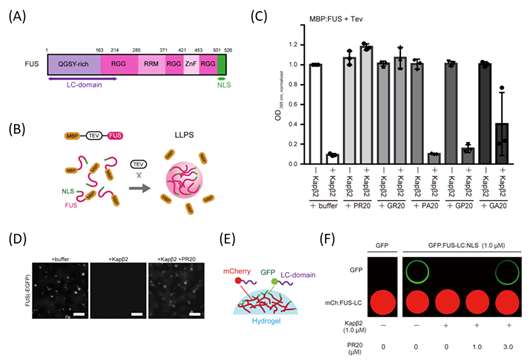
図2.アルギニン豊富な毒性ペプチドによる、Kapβ2の相分離制御の阻害(A)RNA結合タンパク質であるFUSは、アミノ酸が数種類に偏ったLCドメインおよび、核移行シグナル(NLS)を持ち、Kapβ2に認識される。(B)可溶性タグであるMBP(Maltose Binding Protein)をTEVプロテアーゼで切断すると、FUSの液滴が形成される実験系。(C)5種類の毒性ペプチドの、Kapβ2の相分離制御の阻害効果の検証。(D)Kapβ2によりFUSの液滴が消失するが、PRnにより液滴形成が促進される。(E)ヒドロゲル結合法によるポリマー化の評価。(F)Kapβ2によりFUSのポリマー化が抑制されるが、PRnによりFUSのポリマー化が促進される。
次に、PRnとKapβ2が細胞内で相互作用することを免疫沈降法により確認しました(図3)。また、等温滴定カロリメトリー(ITC)※5およびサイズ排除クロマトグラフィー-多角度光散乱法(SEC-MALS)※6などの物理化学的解析により、Kapβ2とPRnは1:1で強固に結合することが示唆されました。
図3.PRnのKapβ2との直接的な相互作用(A)免疫沈降法により、細胞内でPRnとKapβ2が相互作用することが示唆される。(B)ITCにより、PRnとKapβ2が強く結合することが示唆される。(C)SEC-MALSにより、PRnとKapβ2が1:1で結合することが示唆される。
さらに核磁気共鳴(NMR)装置※7により、Kapβ2とPRnの相互作用部位を詳細に解析しました(図4)。まず、安定同位体で標識したKapβ2のNMRスペクトラムを取得しました。Kapβ2は、FUSなどのRNA結合タンパク質の核移行シグナル(NLS)を認識して、相分離を制御していることがこれまで報告されています。そこで、Kapβ2にPRnを加えた際のスペクトルと、Kapβ2のNLS結合部位に結合するM9Mペプチドを加えた際のスペクトルを比較したところ、共通して変化するピークがみられました。これによりPRnの標的部位は、Kapβ2のNLS結合部位と部分的にオーバーラップすることが示唆されました。Kapβ2のNLS結合部位は負に帯電しており、正の電荷を持つPRnの標的部位となっていることが推察されます。分子動力学(MD)シミュレーション※8でも、Kapβ2とPRnとの相互作用を検討したところ、NMRの結果と合致しました(図5)。
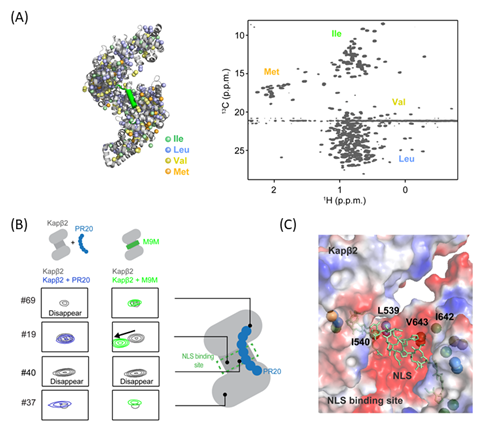
図4.NMRによるPRnとKapβ2との相互作用部位の検討(A)メチル基選択的に安定同位体標識したKapβ2およびNMRスペクトル。(B)PRnおよびM9Mを加えた際のKapβ2のスペクトルの比較。#40のように共通して変化するピークがみられ、結合部位がオーバーラップしていることが示唆される。(C)Kapβ2のNLS結合部位の拡大図。緑で表示されたNLSはM9Mペプチドと対応する。負に帯電した領域(赤色で表示)に位置するアミノ酸が、PRnと相互作用することが示唆される。
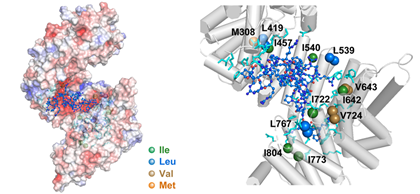
図5.MDシミュレーションによるPRポリペプチドとKapβ2の相互作用解析PRポリペプチド(青で表示)は、Kapβ2のNLS結合部位を標的とし(左側)、相互作用するアミノ酸もNMRでの解析結果と合致している(右側 拡大図)。
研究成果の意義
本研究により、C9orf72遺伝子異常を有するALS/FTDにおいて、アルギニンを多く含む毒性ペプチドが、Kapβ2などの相分離制御因子の機能を阻害する詳細な分子メカニズムが明らかとなりました。相分離制御因子とその破綻に着目した本研究成果から、ALSやFTDをはじめとする神経変性疾患の病態解明、新たな治療法開発につながることが期待されます。
用語説明
- ※1 生物学的相分離
- 核酸やタンパク質などの生体高分子が、弱い相互作用によって集まる現象。主に液滴を形成してダイナミックに変化する。核小体やRNA顆粒など膜のないオルガネラなどは、細胞内における相分離により形成される。サラダドレッシングの水と油のように、液体中で二相に分かれるのは、身近な相分離の一例である。
- ※2 RNA結合タンパク質
- RNAと結合するタンパク質の総称。RNAのスプライシングや安定化、翻訳などにおいて重要な役割を果たしている。アミノ酸が数種類に偏ったLCドメインを持ち、相分離するものが多い。FUSやTDP43などのRNA結合タンパク質のLCドメインに、ALSなどの神経変性疾患を引き起こす遺伝子変異が同定され、相分離異常と神経変性疾患との関連が注目されている。
- ※3 核内輸送受容体
- 細胞質から核内へタンパク質を輸送する分子。核内輸送受容体の一種であるKaryopherinβ2(Kapβ2)は、FUSがもつ核移行シグナル(NLS)を認識して核内に輸送するだけでなく、FUSの相分離制御因子としても機能することが報告されている。
- ※4 C9orf72遺伝子異常
- C9orf72遺伝子の第一イントロンにおける、GGGGCCの6塩基リピートの異常伸長が、遺伝性の筋萎縮性側索硬化症(ALS)/前頭側頭型認知症(FTD)の原因として最も多いことが報告された。ここから生じるリピート伸長RNAから、開始コドン(ATG)によらない翻訳(repeat-associated non-ATG,RAN翻訳)により、5種類の毒性ペプチドが産生され、ALS/FTDの病態に関与するといわれている。
- ※5 等温滴定カロリメトリー(ITC)
- 生体分子間の結合により生じた熱量を測定することで、相互作用の強さなどを定量的に解析する技術。
- ※6 サイズ排除クロマトグラフィー-多角度光散乱法(SEC-MALS)
- 水溶液中に溶解している高分子をサイズ別に分離した後、試料によって散乱した光を検出することで、分子量などを測定する手法。
- ※7 核磁気共鳴(NMR)装置
- 強い磁場の中にサンプルを入れて、核スピンの共鳴現象を観測することで、原子レベルで構造を解析する装置。分子量の大きいサンプルの測定には不向きであったが、本研究ではメチル基のシグナルを選択的に検出するmethyl-TROSYという技術により、100kDaを超える大きさのKapβ2の構造解析を行った。
- ※8 分子動力学(MD)シミュレーション
- 原子および分子の物理的な動きを、コンピューターを用いた計算によって解析する手法。
論文タイトルと著者
- タイトル
- C9orf72-derived arginine-rich poly-dipeptides impede phase modifiers
- 著者
- Hitoki Nanaura#, Honoka Kawamukai#, Ayano Fujiwara#, Takeru Uehara, Yuichiro Aiba, Mari Nakanishi, Tomo Shiota, Masaki Hibino, Pattama Wiriyasermkul, Sotaro Kikuchi, Riko Nagata, Masaya Matsubayashi, Yoichi Shinkai, Tatsuya Niwa, Taro Mannen, Naritaka Morikawa, Naohiko Iguchi, Takao Kiriyama, Ken Morishima, Rintaro Inoue, Masaaki Sugiyama, Takashi Oda, Noriyuki Kodera, Sachiko Toma-Fukai, Mamoru Sato, Hideki Taguchi, Shushi Nagamori, Osami Shoji, Koichiro Ishimori, Hiroyoshi Matsumura, Kazuma Sugie, Tomohide Saio*, Takuya Yoshizawa*, Eiichiro Mori*
(#:共同筆頭著者)(*:共同責任著者) - 掲載誌
- Nature Communications
- DOI
- 10.1038/s41467-021-25560-0
研究グループ
本研究は、日本医療研究開発機構(AMED)の戦略的国際脳科学研究推進プログラム「筋萎縮性側索硬化症の病態発症に関連した毒性ポリペプチドに関する研究開発」、難治性疾患実用化研究事業「遺伝性神経変性疾患に関わるRNA結合タンパク質のアミノ酸変異の相分離異常解析」、「液-液相分離の制御と破綻に着目した筋萎縮性側索硬化症の分子機構解明」、脳とこころの研究推進プログラム「相分離破綻に起因する神経変性疾患に関する研究開発」、科学技術振興機構(JST)、日本学術振興会(JSPS)などの支援のもとで行われたものです。
- 奈良県立医科大学
- 脳神経内科学 七浦 仁紀#、塩田 智、井口 直彦、桐山 敬生、杉江 和馬
未来基礎医学 中西 真理、菊池 壮太郎、長田 理瑚、松林 成也、森川 成孝、森 英一朗*
生体分子不均衡制御学 Pattama Wiriyasermkul、永森 收志(現:東京慈恵会医科大学) - 徳島大学 先端酵素学研究所 分子生命科学分野
- 川向 ほの香#、齋尾 智英*
- 立命館大学
- 生命科学部 生物工学科 構造生命科学研究室
藤原 彩乃#、上原 武尊、吉澤 拓也*、松村 浩由生命科学部 生命医科学科 プロテオミクス研究室
萬年 太郎 - 名古屋大学 大学院理学研究科 物質理学専攻 生物無機化学研究室
- 愛場 雄一郎、日比野 柾、荘司 長三
- 北海道大学 大学院理学研究院化学部門 構造化学研究室
- 石森 浩一郎
- 産業技術総合研究所 バイオメディカル研究部門・脳遺伝子研究グループ
- 新海 陽一
- 東京工業大学 科学技術創成研究院 細胞制御工学研究センター
- 丹羽 達也、田口 英樹
- 京都大学 複合原子力科学研究所 粒子線物性学研究分野
- 守島 健、井上 倫太郎、杉山 正明
- 横浜市立大学 生命医科学研究科 構造生物学研究室
- 佐藤 衛
- 立教大学 理学部生命理学科 分子構造生物物理学
- 小田 隆
- 金沢大学 ナノ生命科学研究所 生物物理学研究室
- 古寺 哲幸
- 奈良先端科学技術大学院大学 物質創成科学研究科 分子複合系科学研究室
- 深井 祥子(藤間 祥子)
お問い合わせ先
研究内容に関すること
奈良県立医科大学 未来基礎医学 准教授・森英一朗
立命館大学 生命科学部 生物工学科 構造生命科学研究室 講師・吉澤拓也
徳島大学 先端酵素学研究所 分子生命科学分野 教授・齋尾智英
名古屋大学 大学院理学研究科 物質理学専攻 生物無機化学研究室 准教授・愛場雄一郎
報道に関すること
奈良県立医科大学 研究推進課(武居)
立命館大学 広報課(遠藤)
徳島大学 研究・産学連携部 蔵本研究・産学支援課(河野)
名古屋大学 管理部総務課広報室(宇佐美)
AMEDの事業に関すること
日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
戦略的国際脳科学研究推進プログラム