2021-10-13 京都大学iPS細胞研究所
ポイント
- 免疫細胞を体外で培養・活性化して移植する治療法(養子免疫療法)が注目されている
- T細胞を刺激し増殖する過程で、細胞の疲弊や老化が課題となっている
- iPS細胞技術を利用してより高い増殖性をもつキラーT細胞のクローンを作ることに成功した
1. 要旨
河合洋平 研究員(増殖分化機構研究部門)および金子新 教授(同部門)らの研究グループは、iPS細胞を経由して、高い増殖性を持つ細胞傷害性T細胞(キラーT細胞/CTL)クローンを作製する方法を開発しました。
養子免疫療法は、がんやHIV/AIDSなどの慢性感染症に対する強力な手段として期待されていますが、大量のT細胞を製造する段階で、細胞の疲弊や老化、分化により、増殖能力が低くなることが課題になっています。疲弊したT細胞を活性化するために、一旦iPS細胞へと初期化し、細胞の若返りを目指す方法もあり、研究が進められています。一般的に使われる分化・培養方法でつくられたiPS細胞由来の細胞傷害性T細胞(iPSC-CTL)は、異常なナチュラルキラー活性注1)を持つ、自己複製能が低いなどの課題がありました。そこで、分化誘導方法を改良することで、高い自己複製能を持ち、強力なエフェクターT細胞注2)を生じさせる、初期の記憶T細胞の特徴を示すiPSC-CTLを作製しました。最適化された条件で増殖培養すると、iPSC-CTLは1015倍以上に増殖しました。今回の手法で作製した、iPSC-CTLを用いて再分化・拡大培養をすることにより、自家移植でも同種移植でも、記憶T細胞とエフェクターT細胞を供給できると期待されます。
この研究成果は2021年10月6日付で「Molecular Therapy」に掲載されました。
2. 研究の背景
T細胞などの免疫細胞を移植して治療する養子免疫療法が、様々ながんやHIV/AIDSなどの慢性感染症に対して効果を発揮し、新世代の免疫療法開発が進んでいます。しかし、細胞を傷害するなどのエフェクター機能や対象となる細胞を認識する能力を保ったまま、大量のT細胞を作ることが困難でした。体外に取り出したT細胞は、増殖させる過程で細胞の疲弊や、老化は避けられず、結果として治療効果も下がってしまいます。また、成熟したT細胞は抗原の刺激をうけて、ナイーブT細胞(TN)から記憶幹細胞(TSCM)、中央記憶細胞(TCM)、 エフェクター記憶細胞(TEM)そしてエフェクター細胞(TEMRA)へと分化していくことが重要です。分化が進むに伴い、T細胞は細胞傷害するなどのエフェクター機能を強化しますが、自己複製の能力は低下してしまいます。また、T細胞を移植する場合、分化の初期段階であるTNやTSCM、TCMが優れた細胞源であるという報告もあります。よって、幹細胞の状態を維持しながら機能を持ったT細胞を増やす方法が求められています。
iPS細胞を介してT細胞の若返りを目指す戦略はその一つの解決方法となります。これまでにiPS細胞から分化させた細胞傷害性T細胞(iPSC-CTL)が作られていますが、現在の培養方法で作られたiPSC-CTLはTEMに相当する細胞でした。
本研究では、高い増殖能力と強力なエフェクター細胞を生み出す能力をもった、初期の記憶T細胞(TSCMやTCM)へとiPSC-CTLを再分化させることで、この問題を解決することを目指しました。
3. 研究結果
1. 初期の記憶T細胞に近い遺伝子発現
ナイーブ型細胞に特徴的なマーカー(CCR7)、獲得免疫の細胞に特徴的なマーカー(CD5)、自然免疫の細胞に特徴的なマーカー(CD56)、細胞障害性T細胞に特徴的なマーカー(CD8αβ)を指標に、iPS細胞から初期の記憶T細胞へと分化誘導させる方法を構築しました。
今回の誘導方法で得られたiPSC-CTLについて、初期の記憶T細胞と後期の記憶T細胞に特徴づけることが知られている776種類の遺伝子の発現パターンを解析しました。すると、 初期の記憶T細胞であるTNやTSCM、TCMと類似性があり、より分化したTEMやTEMRAとは類似性が低いことがわかりました(図1)。
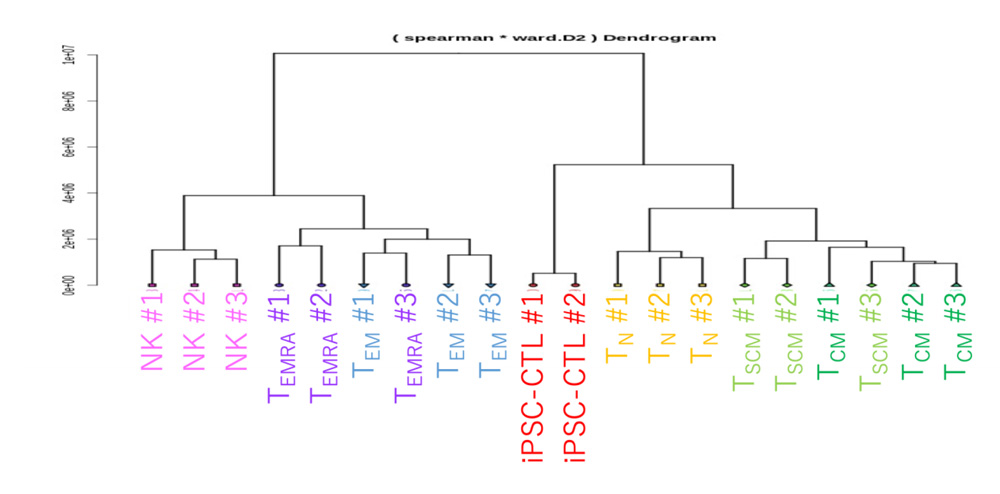
図1 RNAシーケンシングによる遺伝子発現パターンの解析
それぞれの細胞をつなぐ線の長さが短いほど遺伝子発現の類似性が高いことを示している。
2. iPSC-CTLは繰り返し培養して増殖することができた
iPSC-CTLの増殖能力を調べました。フィーダー細胞注3)を利用した最適化した条件で培養することで、一回の刺激で1,000倍以上に増殖し、取り分けて増殖させた細胞の各刺激後の実測数に基づいて計算したところ、10回の繰り返し刺激でも1032倍以上に増やすことができました。増殖させた後のiPSC-CTLでも、元になったT細胞と同様に認識能力は残っていました(図2)。 また、フィーダー細胞を使わない条件でも、6回の繰り返し刺激後の実測数に基づいて計算したところ、1015倍程度に増殖しました(図3)。
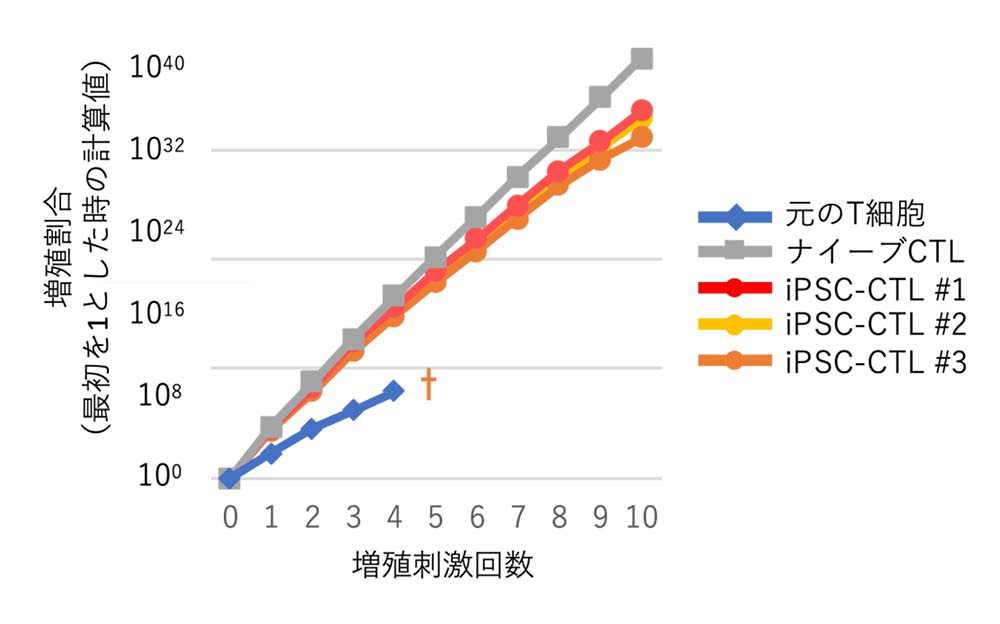
図2 フィーダー細胞をつかった最適化した条件でのiPSC-CTLの増殖
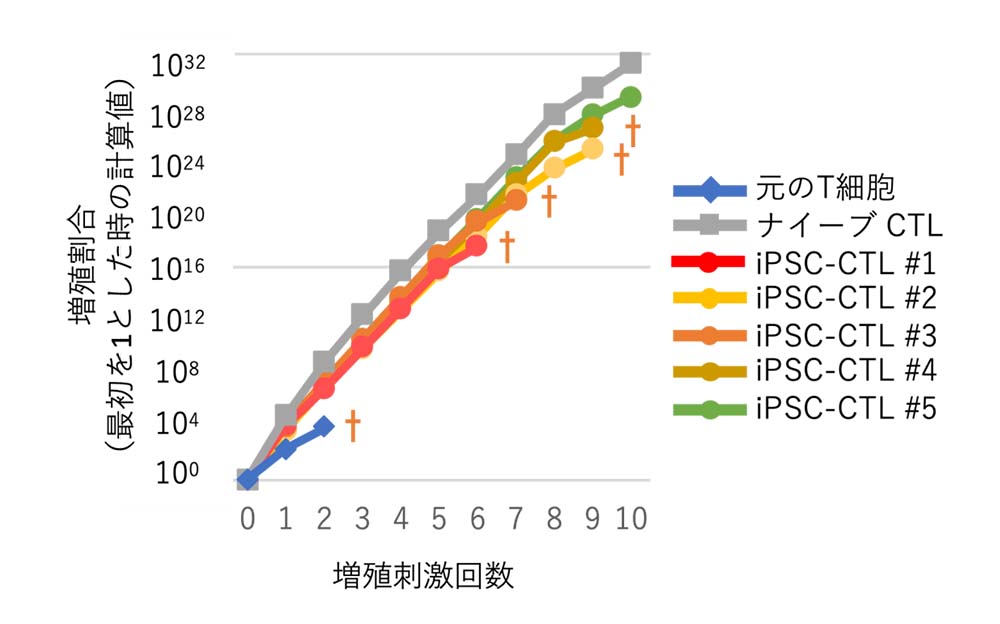
図3 フィーダー細胞を使わない条件でのiPSC-CTLの増殖
3. iPSC-CTLはマウスに移植した後も長期にわたり生存し細胞障害能力を保った
iPS-CTLあるいはiPS-CTLを作る元にしたT細胞を免疫不全マウスに移植し、体内での生存期間を調べたところ、iPSC-CTLの方が元のT細胞と比較して長期間生存していました(図4)。
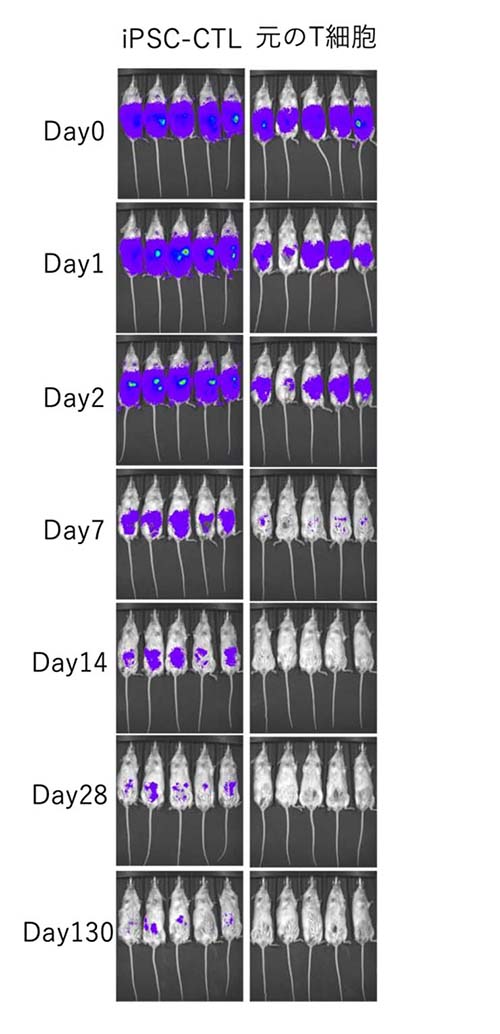
図4 移植後の日数とマウス体内で生存するT細胞(紫色の部分)
また、標的となる腫瘍細胞を皮下に接種したマウスに、iPSC-CTLおよび元のT細胞を移植して細胞障害活性を調べました。iPSC-CTLを移植したマウスではコントロールや元のT細胞を移植したマウスと比較して、がん(腫瘍)の成長を抑制し、マウスの生存率を高めました(図5)。
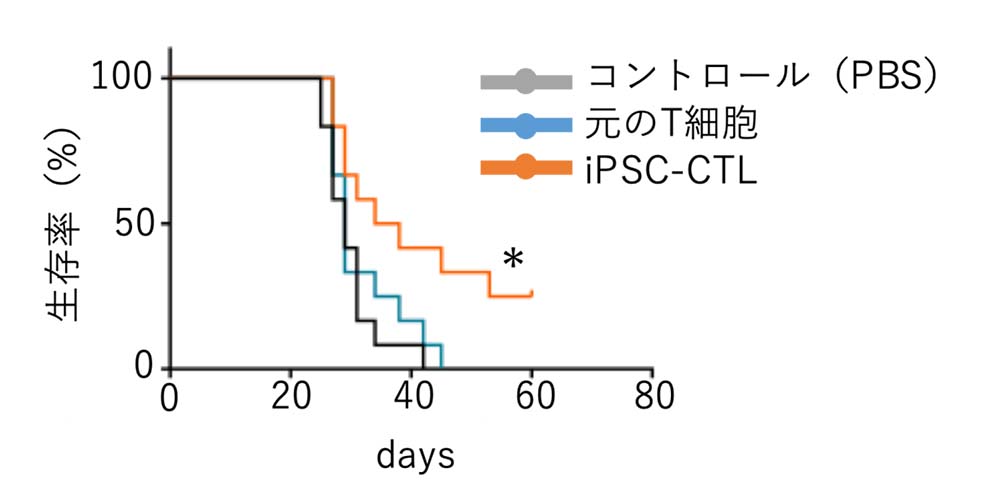
図5 腫瘍細胞を移植後の日数とマウスの生存率
4. まとめ
今回の成果により、iPS細胞から記憶細胞やエフェクター細胞を大量に作り出すことができることを明らかにしました。iPS細胞を利用することで、ゲノム編集などによる遺伝子操作をした細胞の品質管理が容易になり、養子免疫療法の新しいプラットフォームとなることが期待できます。
5. 論文名と著者
- 論文名
Generation of highly proliferative rejuvenated cytotoxic T cell clones through pluripotency reprogramming for adoptive immunotherapy - ジャーナル名
Molecular Therapy - 著者
Yohei Kawai1, Ai Kawana-Tachikawa2, Shuichi Kitayama1, Tatsuki Ueda1, Shoji Miki2, Akira Watanabe1 and Shin Kaneko1,*
*責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 国立感染症研究所 エイズ研究センター
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 文部科学省 科研費(18K15278, 25293226, and 23591413)
- AMED 新興・再興感染症に対する革新的医薬品等開発推進研究事業
- AMED 再生医療実現拠点ネットワークプログラム(iPS細胞研究中核拠点)
- AMED エイズ対策実用化研究事業
「HIV感染症治癒を目指したiPS細胞由来T細胞による新規免疫細胞療法に関する研究」
7. 用語説明
注1) ナチュラルキラー活性
自然免疫系のナチュラルキラー細胞の細胞障害活性を示す指標。本来、獲得免疫系であるCTLではこうした活性はほとんどない。
注2)エフェクターT細胞(TEMRA)
成熟したT細胞は、最初はナイーブT細胞と呼ばれる状態にある。他の免疫細胞(樹状細胞)から刺激をうけると、ナイーブT細胞が分裂、分化し、実際に病原体に対して攻撃をするエフェクターT細胞になる。エフェクターT細胞は仕事を終えると死んでしまう。
注3)フィーダー細胞
目的の細胞を培養する際、培養条件を整える補助的な役割をもつ細胞。