2021-11-04 大阪医療センター,大阪大学,群馬大学,東京大学,日本医療研究開発機構
概要
国立病院機構大阪医療センター・臨床研究センター・先進医療研究開発部(金村米博、福角勇人)、大阪大学大学院医学系研究科神経内科学(東郷一行、望月秀樹)、群馬大学(白尾智明)、東京大学大学院薬学系研究科(関野祐子)らの研究グループは共同で、脳型ドレブリン※1を指標としたシナプス成熟評価法を開発し、ヒトiPS細胞から分化誘導して作製したヒトiPS細胞由来神経細胞のシナプス成熟過程の詳細な解析とその成熟度評価を行い、その特徴を明らかにしました。また、多施設間バリデーション試験を実施し、頑健性を有するヒトiPS細胞由来神経細胞の分化誘導法の開発に成功しました。本研究成果は、2021年10月11日付で国際科学誌『Molecular Brain』に掲載されました。
研究の背景
ヒトiPS細胞から誘導された成熟神経細胞はヒト神経に関する研究や治療法開発に有用と考えられ、これまで様々な種類の神経細胞への分化誘導法が開発されてきました。また、その応用は神経細胞間で情報を伝達するシナプスへも期待されています。しかし、ヒトiPS細胞由来の神経細胞はシナプス形成に時間がかかり、これまでの既報告ではアストロサイト※2との共培養で形成促進を行っても数か月かかるとされています。このことがヒトiPS細胞由来神経細胞を利用したシナプス研究のボトルネックとなっていました。このため短い培養期間で機能的シナプス形成をもたらす手法の開発が待たれていますが、従来までのヒトiPS細胞由来神経細胞のシナプス形成過程の解析は電気生理学的手法が主に使用され、それ以外の遺伝子・タンパク質発現様式を指標に用いた解析手法はあまり実施されていません。今後、ヒトiPS細胞由来神経細胞を各種研究に応用していくためには、機能的シナプス形成とシナプス関連タンパク質の関係を明らかにして、研究を進めていく必要がありました。
研究の成果
本研究では、ヒトiPS細胞を神経前駆細胞※3に分化させたあと、神経前駆細胞の段階で維持・拡大培養を行い、その後に神経細胞を作製しました。この手法では、ヒトiPS細胞からの直接分化誘導法と比較して、均一性のある神経前駆細胞を簡便な手法で大量に作り出すことが可能となりました。この神経前駆細胞を神経細胞へ分化誘導させる段階において、経時的にシナプス形成の解析を行いました(図1)。
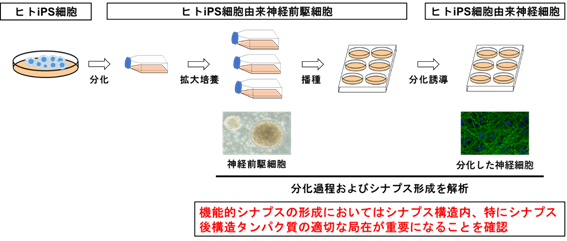
図1.研究概要
脳型ドレブリンを指標としたヒトiPS細胞由来神経細胞のシナプス成熟評価法の開発
本研究では、シナプス成熟に伴い選択的スプライシング※4を受けて全身型ドレブリン(ドレブリンE)から発現が切り替わる脳型ドレブリン(ドレブリンA)というタンパク質に着目し、ヒトiPS細胞のシナプス成熟度の評価を行いました。その結果、ドレブリンAがPSD-95※5等、シナプス後部に発現するその他の主要分子に先駆けてシナプス部分に発現・集積し、機能的シナプス後構造形成の指標になりうることを明らかにしました(図2)。
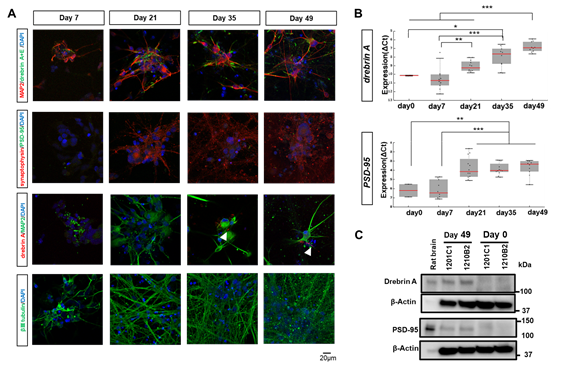
図2.ヒトiPS細胞のシナプス成熟度評価法の開発
- 細胞蛍光免疫染色法を用いた経時的なシナプス関連タンパク質発現解析の結果、シナプス前分子であるSynaptophysinは早期からの発現を認めた。一方、シナプス後構造において、ドレブリンAの発現は分化誘導後35日目頃から確認されたが(白矢頭)、PSD-95の発現は明らかでなかった。
- 遺伝子発現レベルではドレブリンA、PSD-95のいずれも経時的な発現上昇を認めており、シナプス形成の方向に向かっていることが確認された。
- ウエスタンブロット法を用いたタンパク質発現解析の結果、異なる2株(1210B2株、1201C1株)のヒトiPS由来神経前駆細胞において、ドレブリンA、PSD-95のいずれも分化誘導することでタンパク質発現が上昇することが確認された。
ドレブリンA発現を指標としたヒトiPS細胞由来神経細胞のシナプス形成過程の詳細解析とその特徴の解明
ヒトiPS細胞由来神経細胞における経時的な遺伝子発現解析の結果、シナプス関連分子の発現は、いずれも転写因子レベルでは上昇することが確認されました(図2、図3)。一方、細胞蛍光免疫染色解析においては、分化誘導後49日目の時点で、前シナプス構造に関連する分子(Synaptophysin)は、シナプス様の局在を呈しながら明瞭に発現したのに対して、後シナプス構造に関連するドレブリンA、PSD-95は、シナプス様構造内における発現と局在が不十分な状態にあることが確認されました(図2)。多点電極アレイを用いてこの状態のヒトiPS細胞由来神経細胞の生理学的機能を評価した結果、明らかな神経細胞様の電気生理活動は確認されず、ヒトiPS細胞由来神経細胞のシナプス成熟度は分化誘導後49日目の時点でもまだ不十分であることが明らかとなりました。
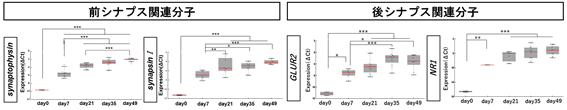
図3.iPS細胞由来神経細胞のシナプス形成過程の遺伝子発現解析結果遺伝子発現レベルではドレブリンA、PSD-95以外のシナプス関連分子についても経時的な発現上昇を認めた。
以上の結果から、ヒトiPS細胞由来神経細胞が機能的シナプスを形成するためには更なる分化成熟が必要であり、後シナプス関連分子のシナプス構造内での十分な発現と適切な局在をはじめとする、シナプス後構造の更なる成熟が重要であることが示唆されました。
頑健性を有するヒトiPS細胞由来神経細胞の分化誘導法の開発
本研究では、ヒトiPS由来細胞は神経前駆細胞の段階で維持・拡大培養を行っています。本手法はiPS細胞からの直接分化誘導法に比較して、大量に均一性のある細胞を作り出すことが可能となるメリットを有しますが、これまであまり用いられた報告はありません。そこで合計5施設で共通プロトコルに従ってヒトiPS細胞由来神経前駆細胞を神経細胞に分化させ、その後、各種遺伝子発現の解析を行う多施設間でのバリデーション試験を実施して本研究で使用した培養方法の再現性を確認しました。その結果、神経前駆細胞関連遺伝子群は分化に伴い発現が減少する一方、神経細胞関連遺伝子群、シナプス関連遺伝子群等の発現が上昇することを確認しました(図4)。以上の結果から、本手法において作製された神経細胞が、細胞分化・成熟に関連する分子を十分に発現し、経時的に分化していくことを、多施設間で再現性を持って確認することができ、本研究で用いたヒトiPS細胞由来神経細胞の分化誘導法は、十分な頑健性を有する手法であることが確認されました。
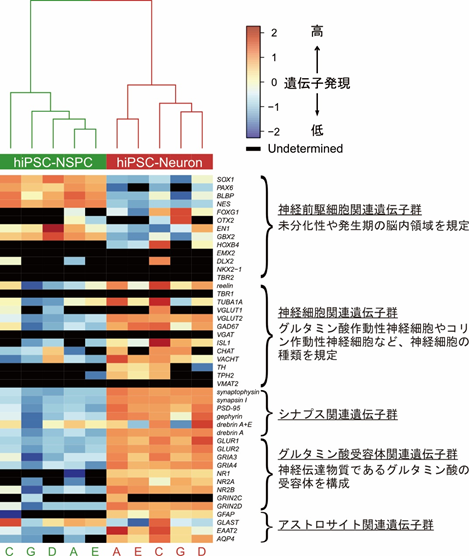
図4.多施設バリデーション試験結果共通プロトコルに従って、5施設(A、C、D、E、G)でヒトiPS細胞由来神経前駆細胞(hiPSC-NSPC)を神経細胞(hiPSC-Neuron)に分化させ、その後、各種遺伝子発現の解析を実施した。その結果、いずれの施設での培養においても神経前駆細胞関連遺伝子群は分化に伴い発現が減少する一方、神経細胞関連遺伝子群、シナプス関連遺伝子群、グルタミン酸受容体関連遺伝子群、アストロサイト関連遺伝子群は発現が上昇することを確認した。
研究成果の意義
ヒトの神経疾患においてアルツハイマー病やパーキンソン病、自閉症などシナプス機能障害が関わるとされる疾患が数多くあり、シナプス機能を対象とした研究には今後の展開が期待されています。本研究では、樹状突起スパインのアクチン細胞骨格を安定化させる脳型ドレブリン(ドレブリンA)がシナプス形成度評価の指標の1つになることを明らかにしました。シナプス形成での電気生理学的評価以外に加えて、本研究で得られた成果を新たな指標として用いることで、ヒトiPS細胞由来のシナプス成熟過程をより客観的・定量的に評価することが可能となり生理学的・病理学的研究やシナプス機能障害を標的とした治療といったさらなる発展に貢献することが期待されます。
本研究への支援
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の再生医療実現拠点ネットワークプログラム、疾患特異的iPS細胞の利活用促進・難病研究加速プログラム「2.5次元共培養系を用いたヒト神経細胞シナプス成熟法の開発」、再生医療実現拠点ネットワークプログラム「疾患・組織別実用化研究拠点」(拠点A)「iPS細胞由来神経前駆細胞を用いた脊髄損傷・脳梗塞の再生医療」、再生医療実用化研究事業「創薬のためのインビトロ脳機能評価法の確立と標準化ヒト神経細胞の開発」、科学研究費助成事業・基盤研究(C)「ヒト神経細胞の低酸素・虚血ストレス障害発生メカニズム解析と新規治療法開発」の支援のもとでおこなわれたものです。
用語説明
- ※1 ドレブリン
- アクチン線維の形を決めるアクチン結合蛋白質の1つで、ヒトでは全身型ドレブリン(ドレブリンE)および脳型ドレブリン(ドレブリンA)の2種類が存在しているとされている。これまでの研究で神経細胞ではその成熟とともにドレブリンEからドレブリンAに切り替わるとされている。ドレブリンAは神経細胞の樹状突起スパインを構成するアクチン細胞骨格を安定化させている。
- ※2 アストロサイト
- 脳を構成する細胞の一種で神経細胞に栄養を与えたり、神経細胞の生存と働きを助けたりする機能を持つ。
- ※3 神経前駆細胞
- 神経系の未分化細胞であり、自己増殖することが可能で神経細胞とグリア細胞に分化することができる。
- ※4 選択的スプライシング
- 1つの遺伝子から複数のmRNAを生成する機構。この機構により1つの遺伝子から異なる複数のタンパク質を作り出すことが可能とされている。
- ※5 PSD-95
- シナプス後部の主要なタンパク質の1つ。
論文タイトルと著者
- タイトル
- Postsynaptic structure formation of human iPS cell-derived neurons takes longer than presynaptic formation during neural differentiation in vitro
- 著者
- Kazuyuki Togo, Hayato Fukusumi, Tomoko Shofuda, Hiroshi Ohnishi, Hiroyuki Yamazaki, Mariko Kato Hayashi, Nana Kawasaki, Nobuyuki Takei, Takanobu Nakazawa, Yumiko Saito, Kousuke Baba, Hitoshi Hashimoto, Yuko Sekino, Tomoaki Shirao, Hideki Mochizuki, Yonehiro Kanemura*
(*:責任著者) - 掲載誌
- Molecular Brain
- DOI
- 10.1186/s13041-021-00851-1
- 研究グループ
- 大阪医療センター臨床研究センター先進医療研究開発部
福角勇人、正札智子、金村米博*(研究代表者) - 大阪大学大学院医学系研究科神経内科学
東郷一行(筆頭著者)、馬場孝輔、望月秀樹 - 群馬大学特別教授
白尾智明(研究分担者) - 群馬大学大学院医学研究科(現所属:群馬医療福祉大学 社会福祉学部)
山崎博幸 - 東京大学大学院薬学系研究科
関野祐子(研究分担者) - バリデーション研究チーム(順不同)
- 大阪大学大学院薬学研究科
橋本均 - 群馬大学大学院保健学研究科生体情報検査科学講座
大西浩史 - 国際医療福祉大学医学部医学科(現所属:昭和女子大学食健康科学部管理栄養学科)
林真理子 - 横浜市立大学大学院生命医科学研究科
川崎ナナ - 新潟大学脳研究所腫瘍病態学
武井延之 - 東京農業大学生命科学部
中澤敬信 - 広島大学大学院統合生命科学研究科
斎藤祐見子
お問い合わせ先
研究に関するお問い合わせ先
独立行政法人国立病院機構大阪医療センター
臨床研究センター 先進医療研究開発部・部長 金村米博
AMED事業に関する問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
再生医療実現拠点ネットワークプログラム