2021-12-03 京都大学iPS細胞研究所
中村壮 特任助教(CiRA 臨床応用研究部門)、江藤浩之 教授(CiRA同部門)らの研究グループは、高山直也 准教授(千葉大学大学院医学研究院)、曽根正光 助教(北海道大学)らとの共同研究で、ヒトiPS細胞注1)から血小板を産生するための従来法よりも効率的な手法の開発に取り組みました。その結果、細胞の増殖を妨げるCDKN1Aとp53という2つの遺伝子の働きを抑えることで、高効率に血小板産生細胞を得られることが分かりました。
この結果により、従来の血小板輸血では治療が困難な血小板不応症注2)の患者さんの治療にもつながることが期待されます。
本研究成果は、2021年12月2日に、学術誌「Stem Cell Reports」で公開されました。
1. 研究の背景
研究チームは以前、ヒト多能性幹細胞注3)を、血小板を生み出す細胞である巨核球へと分化させ、さらに増殖を促進するMYC, BMI1, BCLXLという3種類の遺伝子(これらをまとめて以降MBXとする)を強力に発現させることで、その巨核球を不死化注4)することに成功していました。これにより血小板の元となる不死化巨核球を大量に増殖させ、輸血に必要とされる膨大な血小板を作製することが理論上可能となりました。
しかし、多能性幹細胞から不死化巨核球を樹立できる確率は5%以下と低く、ほとんどの試行においてMBXを発現させても巨核球が増殖を2ヶ月以内に停止してしまうという問題がありました(図1上)。また増殖能力の低い巨核球は、一つの巨核球あたりから産生される血小板数も低いということが分かっていました。そこで研究チームは巨核球が不死化する確率が高くなるよう手法の改善を目指しました。
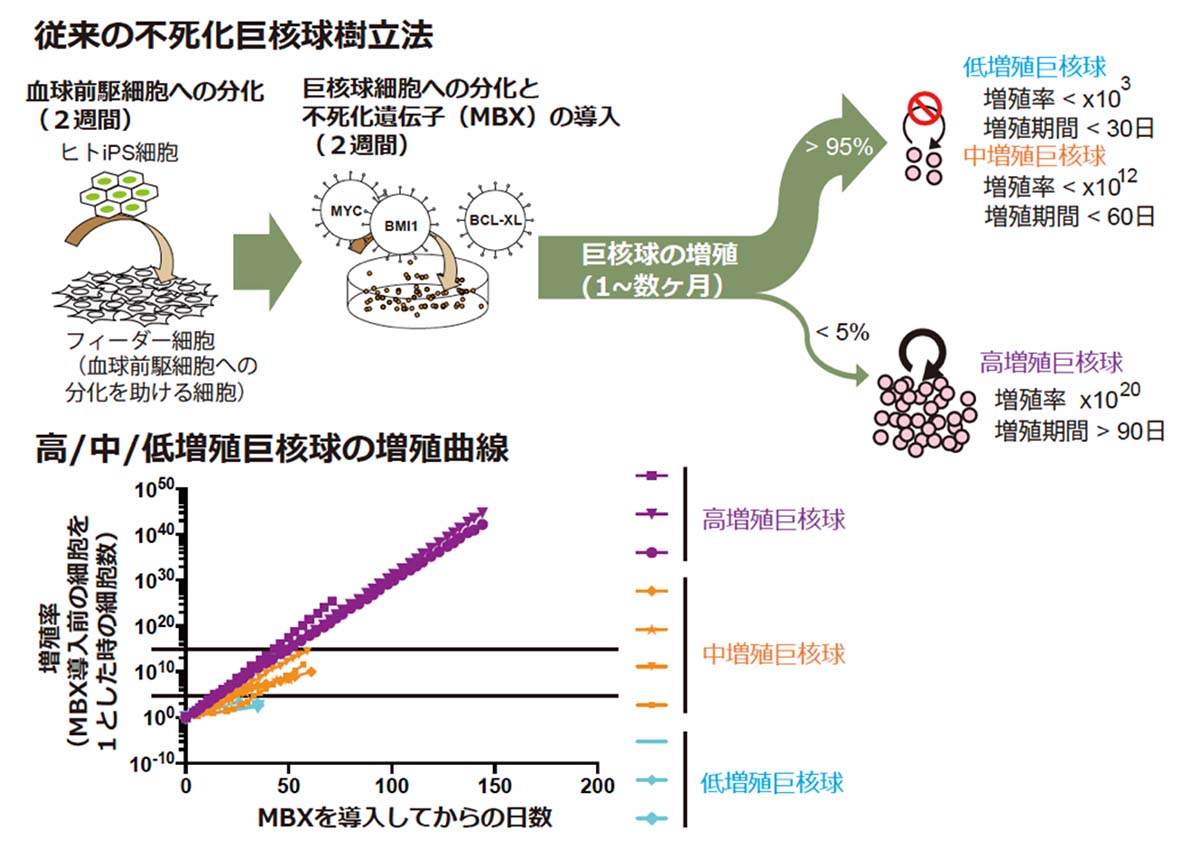
図1:従来の不死化巨核球樹立法と得られた巨核球の増殖曲線
2. 研究の成果
本研究では、まず様々なヒトiPS細胞株を元に、従来法で得られた巨核球をその増殖能力の程度によって高/中/低増殖の3カテゴリーに分類しました(図1下)。そして、RNA-seq法注5)により遺伝子発現解析を行ったところ、高増殖巨核球に比べ、低または中増殖巨核球では細胞の増殖を抑える働きがあることが知られるCDKN1AとCDKN2Aという遺伝子の発現が高い傾向にあることが明らかになりました。 そこで研究チームは、従来法で作製された低/中増殖巨核球において、shRNA注6)によりこれらの遺伝子を抑制することで、鈍化した増殖能を活性化することができるかどうかを試みました。
その結果、CDKN1A遺伝子に対するshRNAを導入した場合と、CDKN1Aの発現を促進するp53遺伝子に対するshRNAを導入した場合に、最終的に100倍以上の細胞数が得られ、増殖が著しく改善されました(図2左)。一方、CDKN2Aに対するshRNAにはそのような増殖促進効果はありませんでした。
次に、研究チームは新たにiPS細胞から巨核球を分化する過程でこれらのshRNAを導入し、巨核球の不死化効率が改善するかどうかを調べました(図2右)。その結果、MBXに加えてCDKN1Aとp53に対するshRNAを同時に導入することで、増殖期間が4倍程度、増殖率が1010以上と増殖能力が飛躍的に改善しました。
最後に研究チームはshRNAを用いて得られた増殖能の高い巨核球が血小板を生産することができるのか、その生産効率と生産された血小板の機能を解析しました。その結果、従来法で得た中増殖巨核球にshRNAを導入した巨核球株と(図3A-オレンジ格子柄)、iPS細胞からの分化の過程でshRNAを用いる新規法で樹立した巨核球(図3A-水色格子柄)は、いずれもshRNAを用いないで得た巨核球よりも血小板産生能力が数倍〜数十倍高いことが分かりました(図3A)。 その能力はこれまでに作製した中で最も血小板産生能力の高い巨核球株(図3A-紫)に比類するものでした。新規法で得た巨核球株は、同じiPS細胞由来の従来法で得た巨核球に比べDMS注7)を発達させている様子が観察され、高い血小板産生能力を裏付けていました(図3B、矢印)。さらに、血小板の機能を調べるためPMA刺激注8)を行ったところ、shRNAを用いた巨核球株由来の血小板が20%を超える高い割合でPAC1注9)抗体染色陽性となり、明瞭な応答性を示したことから機能性を有することが示されました(図3C)。
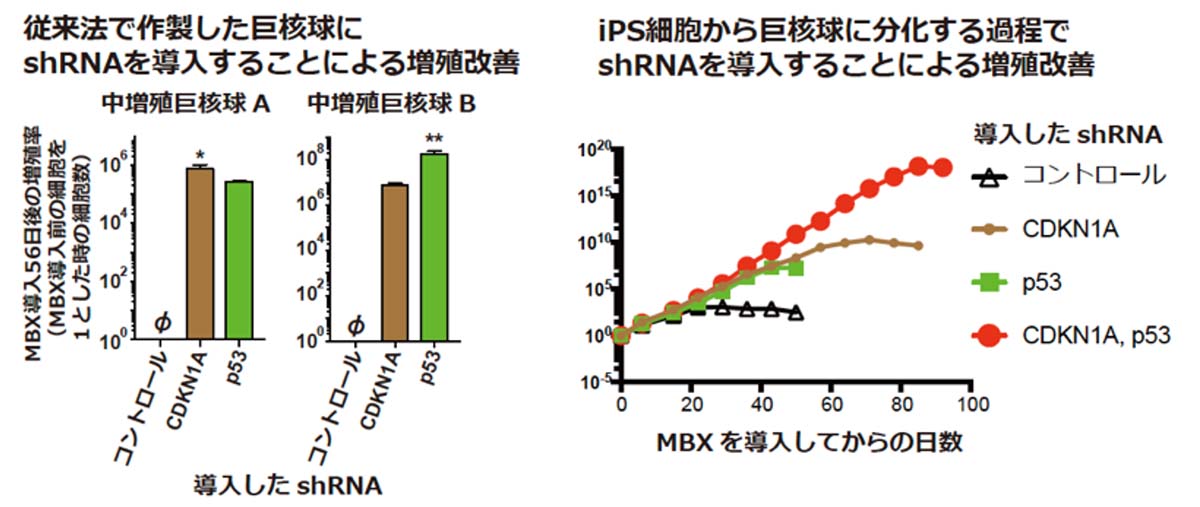
図2:CDKN1A, p53に対するshRNAによる巨核球の増殖改善
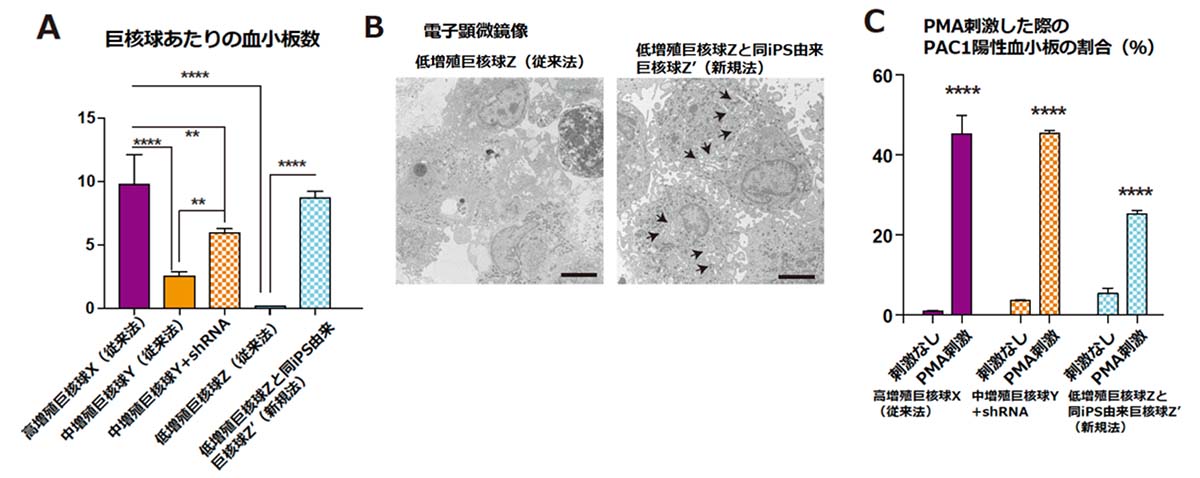
図3:shRNA導入巨核球の血小板産生能力と血小板機能の解析
3. 今後の展望
本研究により、CDKN1Aとp53という2つの遺伝子を抑制することにより高確率で増殖能力の高い巨核球を樹立できることが分かりました。この成果により、これまでネックとなっていた個別のiPS細胞から不死化巨核球の作製が効率化され、例えば血小板不応症の患者さんの体内で抗体反応が起きにくい血小板など、患者さんの疾患に合わせた機能を持つテイラーメイド血小板の作製に応用されることが期待されます。
4. 論文名と著者
- 論文名
Silencing of p53 and CDKN1A establishes sustainable immortalized megakaryocyte progenitor cells from human iPSCs - ジャーナル名
Stem Cell Reports - 著者
Masamitsu Sone1,7*, Sou Nakamura2*, Sachiko Umeda1, Harumi Ginya3 , Motohiko Oshima4, Maria Alejandra Kanashiro1, Sudip Kumar Paul1, Kanae Hashimoto2, Emiri Nakamura2, Yasuo Harada2, Kyoko Tsujimura1, Atsunori Saraya1, Tomoyuki Yamaguchi5, Naoshi Sugimoto2, Akira Sawaguchi6, Atsushi Iwama4, Koji Eto1,2** and Naoya Takayama1**
* 筆頭著者(共同)
**責任著者(共同) - 著者の所属機関
- 千葉大学大学院医学研究院
- 京都大学iPS細胞研究所(CiRA)
- 株式会社メガカリオン
- 東京大学医科学研究所
- 東京薬科大学 薬学部・生命科学部
- 宮崎大学 医学部
- 北海道大学 低温科学研究所
5. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 公益財団法人 持田記念医学薬学振興財団
- 公益財団法人 先進医薬研究振興財団
- 公益財団法人 テルモ生命科学振興財団
- AMED再生医療実現拠点ネットワークプログラム
「疾患・組織別実用化研究拠点」「技術開発個別課題」「iPS細胞研究中核拠点」 - 日本学術振興会(JSPS)
- 株式会社 メガカリオン
6. 用語説明
注1)iPS細胞
京都大学の山中教授らによって作製法が確立された、様々な細胞に分化する能力を持つ人工多能性幹細胞。個体になる能力を備え、生命の萌芽と見做すことのできる初期胚を壊して得られるES細胞と違い、体の細胞から作製することで倫理的問題を回避することができる。
注2)血小板不応症
血小板輸血を繰り返すことで、体内で輸血血小板に対する抗体が産生され、輸血血小板が速やかに排除されてしまう症状。この状態に陥ると血小板輸血が無効化され、治療が困難となる。
注3)多能性幹細胞
初期胚と同様に様々な細胞に分化する能力を持つ幹細胞で、前述のiPS細胞と胚性幹細胞(ES細胞)を含む。
注4)不死化
一般的に細胞が分裂できる回数は有限であるが、増殖を促進するタンパク質を発現させることなどにより、その制限を超えて無限に増殖できる状態にすること。
注5)RNA-seq法
近年開発された次世代シーケンサーと呼ばれる装置を用いて、細胞や組織における遺伝子の発現状態を網羅的に解析する手法。
注6)shRNA
short hairpin RNAの略。細胞に導入することで標的とする遺伝子のメッセンジャーRNAを破壊し、その遺伝子の機能を抑制することができる。
注7)DMS
demarcation membrane systemの略。血小板産生が旺盛な巨核球に見られる特殊な細胞内膜構造。
注8)PMA刺激
Phorbol 12-myristate 13-acetateの略。血小板内のプロテインキナーゼCという酵素を活性化することで、血小板の活性化を引き起こす。
注9)PAC1
血小板がかさぶた (血栓) を作る際にインテグリンという分子が活性化し、周囲の血小板同士が架橋され、血栓として強固となっていく。PAC1抗体は活性型のインテグリン分子に特異的に結合する抗体。