2021-12-27 神戸大学,日本医療研究開発機構
神戸大学大学院医学研究科の村田陽二准教授、坂本茉莉子大学院生、藤澤正人教授(現・神戸大学長)、的崎尚教授らの研究グループは、がん細胞を殺傷する能力を持つマクロファージ※1に存在するSIRPα※2およびSIRPβ1※3という膜タンパク質に特異的に結合する抗体を用いることで、マクロファージが活性化され、特定のがん細胞を効率よく排除出来ることを明らかにしました。特に、この抗腫瘍効果には、SIRPβ1が中心的な役割を担っていることを発見し、今後、SIRPβ1を標的とした新たながん治療薬の開発に繋がることが期待されます。
この研究成果は、令和3年12月20日(米国東部時間)の週に、米国科学誌「Proc. Natl. Acad. Sci. U.S.A.」にオンライン掲載されました。
ポイント
- マウス由来がん細胞(膀胱がんおよび乳がん株化細胞)を移植したマウスにおいて、SIRPαとそのファミリー分子SIRPβ1に結合する抗SIRPα/β1抗体の単独投与が、抗腫瘍効果を発揮した。
- 抗SIRPα/β1抗体の示す抗腫瘍効果には、マクロファージが重要な役割を担っていた。
- 抗SIRPα/β1抗体はマクロファージの膀胱がん、乳がん細胞に対する殺細胞作用(細胞傷害や細胞貪食)を増強した。
- 抗SIRPα/β1抗体によるマクロファージのがん細胞に対する殺細胞作用増強効果には、マクロファージ上のSIRPβ1と抗体との結合が特に重要であった。
- マクロファージのがん細胞に対する攻撃性を高め、腫瘍の成長を抑制する物質として、抗SIRPα/β1抗体の有効性が示され、さらにSIRPβ1が新たながん治療の標的となる可能性が示された。
研究の背景
日本国内において、がんはあらゆる病気の中でも最も死亡率の高い病気です。1981年以降、長年に渡って国内における死因の第1位を占め続けており、日本人の5人に1人の死因ががんであると言われています。加齢とともに増加するがんをいかにコントロールしていくかが喫緊の課題であり、新しい薬剤の開発が望まれています。
近年、免疫細胞に作用するがん治療薬の開発が精力的に行われていますが、その一つである、侵入してきた細菌や死細胞、さらにはがん細胞などを取り込んで除去する貪食能を持つマクロファージの機能を改変するがん免疫療法が、新たながん治療戦略として注目されています。
研究の内容
これまでに、的崎教授らの研究グループでは、マクロファージの細胞膜に存在するタンパク質SIRPαとその貪食標的となるがん細胞の細胞膜に存在するタンパク質CD47が結合すると、がん細胞を標的とする抗体医薬※4(がん細胞上に存在する抗原に結合)により誘導されるマクロファージのがん細胞に対する貪食活性が弱められる(図1A)一方で、SIRPαに結合し、かつ、SIRPαとCD47の結合を阻害する作用を持つ抗体(抗SIRPα抗体)が、上記の活性を高め強力な抗腫瘍効果をもたらすことを見出していました(図1B)。
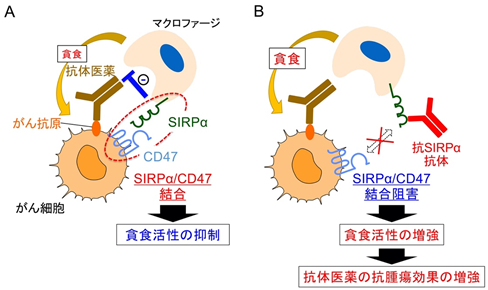
図1 SIRPαとCD47との結合によるマクロファージのがん細胞貪食の抑制と抗SIRPα抗体によるその増強
このように、がん細胞を標的とする抗体との併用下において、抗SIRPα抗体の有用性が示されていましたが、抗SIRPα抗体の単独使用の抗腫瘍効果については十分には明らかになっていませんでした。そこで、研究グループは抗SIRPα抗体が単剤使用でもがんの治療薬として利用可能であるか、さらにはそのメカニズムについて複数のマウス由来がん細胞(膀胱がん、乳がん、肺がん、および骨肉腫細胞)を移植した腫瘍モデルマウスを用い検討を進めました。
その結果、抗SIRPα抗体の単独使用が、膀胱がんや乳がん細胞を移植した腫瘍モデルマウスにおいて、腫瘍の成長を著明に抑制することを発見しました(図2)。また、この抗腫瘍効果にはマクロファージが中心的な役割を果たしていました。そして抗SIRPα抗体は単独でマクロファージの膀胱がんや乳がん細胞に対する殺細胞作用(細胞傷害および細胞貪食)を増強することができ、さらにこの殺細胞作用には抗SIRPα抗体に反応したマクロファージから分泌される炎症性サイトカイン※5であるTNFα※6が関わっていることもわかりました。すなわち、抗SIRPα抗体がマクロファージのがん細胞を攻撃する能力を高め、膀胱がんや乳がんに対して抗腫瘍効果を発揮することが示されました(図3)。
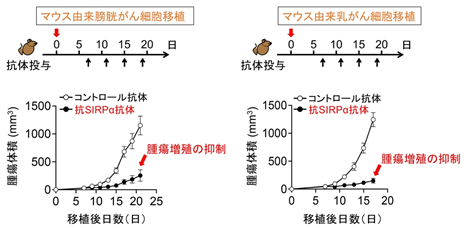
図2 抗SIRPα抗体単独投与による腫瘍増殖の抑制効果
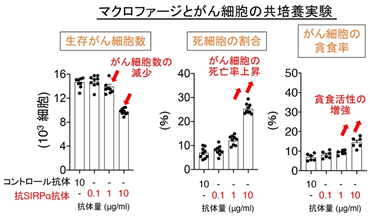
図3 抗SIRPα抗体によるマクロファージの膀胱がん細胞に対する細胞傷害
次に抗SIRPα抗体による膀胱がん細胞に対する抗腫瘍効果に、マクロファージの持つSIRPαが重要であるか否かについて確かめることにしました。興味深いことに、SIRPαタンパク質を欠失したマクロファージにおいても、抗SIRPα抗体によりマクロファージの膀胱がん細胞に対する殺細胞作用が増強されることが観察され(図4A)、抗SIRPα抗体がマクロファージに存在するSIRPα以外の分子にも結合することで抗腫瘍効果を発揮していると考えられました。さらに、以前の研究において、今回の研究で用いた抗SIRPα抗体はSIRPα以外に、SIRPβ1(SIRPαと非常に類似したアミノ酸配列をとる)にも結合することを見出していたことから、SIRPβ1とこの抗体の結合がマクロファージのがん細胞に対する殺細胞作用に関わるのではないかと考えました。そこで、RNA干渉法※7によりSIRPβ1タンパク質の発現量を低下させたマクロファージを用いた実験を行ったところ、抗SIRPα抗体よるマクロファージの膀胱がん細胞に対する殺細胞作用の著明な低下が認められました(図4B)。
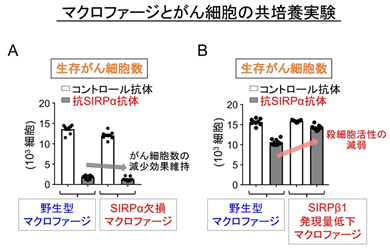
図4 抗SIRPα抗体による膀胱がん細胞に対するマクロファージ(MΦ)の殺細胞作用増強へのSIRPβ1の関与
これらのことから、今回の研究で用いた抗SIRPα抗体(SIRPαとSIRPβ1のいずれにも結合する抗SIRPα/β1抗体)は少なくともマクロファージ上に存在するSIRPβ1に結合することでマクロファージの膀胱がんや乳がん細胞に対する攻撃作用(殺細胞作用)を高め、これらの腫瘍に対して抗腫瘍効果を発揮すると考えられ、また、SIRPβ1が新たながんの治療標的分子になり得る可能性を示すことができました(図5)。
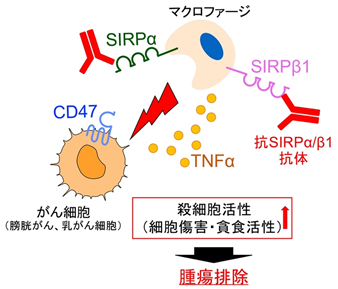
図5 SIRPβ1を標的とした新たながん治療戦略
今後の展開
本研究により、マクロファージのがん細胞に対する攻撃性を高め、腫瘍の成長を抑制する物質としてSIRPαとSIRPβ1に同時に作用する抗SIRPα/β1抗体の有効性を示すとともに、マクロファージ上のSIRPβ1が新たながん治療の標的となる可能性が示されました。今後、抗SIRPα/β1抗体(または抗SIRPβ1抗体)およびがん治療標的としてのSIRPβ1の有効性と安全性、また抗体の詳細な作用メカニズムをさらに解析することで、マクロファージの機能制御を利用した新たながん治療薬の開発へと繋げたいと考えています。
用語解説
- ※1 マクロファージ
- 生体内に侵入した病原体などを貪食し排除するのに特化した免疫細胞。老化した細胞やがん細胞なども貪食し、生体内からの不要な細胞の排除にも関わっている。
- ※2 SIRPα
- 細胞の内外を分ける細胞膜上に存在する膜タンパク質の一つで、マクロファージに豊富に存在している。SIRPαはマクロファージの貪食標的となる細胞上の別の膜タンパク質CD47と結合することで、その貪食の活性調節を担っている。SIRPαは、Signal regulatory protein αの略。
- ※3 SIRPβ1
- SIRPαと非常によく似たアミノ酸配列を持つSIRPαのファミリータンパク質の一つ。SIRPαと同様に、マクロファージに豊富に存在しており、貪食の活性調節を担っているが、SIRPαとは異なりCD47とは結合しないことが分かっている。詳細な役割については未だ不明な点も多い。
- ※4 抗体医薬
- B細胞という免疫細胞から産生され、抗原と呼ばれる特定の分子と特異的に結合する性質を持つタンパク質(抗体)をもとに改変を加えた分子標的薬(がん細胞や正常細胞に存在する特定のタンパク質に作用する薬剤)の一つ。
- ※5 炎症性サイトカイン
- 免疫細胞などから分泌され、細胞間の情報伝達を仲介する低分子タンパク質の総称である。サイトカインの中でもTNFαやIL-1、IL-6など、生体内で炎症反応を促進する働きを持つものを炎症性サイトカインと呼ぶ。
- ※6 TNFα
- Tumor Necrosis Factor-α(腫瘍壊死因子α)の略。腫瘍細胞の壊死を誘導する因子として発見された、炎症性サイトカインの1つ。主に活性化されたマクロファージから分泌され、様々な生理活性を持つ。例えば、細菌やウイルスの感染を防いだり、腫瘍細胞を排除したりする働きを持つ一方で、TNFαの過剰な産生は慢性的な炎症反応を引き起こし、胃がん、大腸がんや乳がんの発症を引き起こす、という二面性を持つ。
- ※7 RNA干渉法
- 21塩基から23塩基の小さな2本鎖RNAを細胞内に導入することで、特定の遺伝子の発現を抑え、タンパク質の合成量を減少させる技術。標的の遺伝子の機能を大きく減弱させることで、その遺伝子の機能を簡便に解析できる手法の一つとして広く用いられている。
謝辞
本研究は、主に日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)「貪食細胞-がん細胞相互作用を制御する新たながん免疫療法の開発」(研究開発代表者:的崎尚)、科学研究費補助金事業基盤研究(A)「がん細胞の生存・維持の分子機構の解明」および「自然免疫制御によるがん細胞の生存・維持の分子基盤の解明」(研究代表者:的崎尚)、および科学研究費補助金事業基盤研究(C)「細胞間シグナルを介したがん細胞の新たな免疫監視回避機構の解析」(研究代表者:村田陽二)の支援を受けて実施されました。
論文情報
- タイトル
- “Anticancer efficacy of monotherapy with antibodies to SIRPα/SIRPβ1 mediated by induction of antitumorigenic macrophages”
- DOI
- 10.1073/pnas.2109923118
- 著者
- Mariko Sakamotoa,b, Yoji Murataa,*, Daisuke Tanakaa, Yuka Kakuchia,Takeshi Okamotoa, Daisuke Hazamaa, Yasuyuki Saitoa, Takenori Kotania,Hiroshi Ohnishic, Masayuki Miyasakad, Masato Fujisawab, and Takashi Matozakia,*
aDivision of Molecular and Cellular Signaling, Department of Biochemistry and Molecular Biology, Kobe University Graduate School of Medicine, Kobe, Japan.
bDivision of Urology, Department of Surgery Related, Kobe University Graduate School of Medicine, Kobe, Japan.
cDepartment of Laboratory Sciences, Gunma University Graduate School of Health Sciences, Gunma, Japan.
dImmunology Frontier Research Center, Osaka University, Osaka, Japan.
*Corresponding authors - 掲載誌
- Proc. Natl. Acad. Sci. U.S.A.
お問い合わせ先
研究について
国立大学法人神戸大学医学研究科生化学・分子生物学講座 シグナル統合学分野
教授 的崎尚
報道担当
国立大学法人神戸大学総務部広報課
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
次世代がん医療創生研究事業(P-CREATE)

