2022-02-07 理化学研究所,国立がん研究センター,東京大学医学部附属病院,東京大学定量生命科学研究所
理化学研究所(理研)革新知能統合研究センター目的指向基盤技術研究グループがん探索医療研究チームの町野英徳特別研究員、浜本隆二チームリーダー、小松正明副チームリーダー、浅田健研究員、国立がん研究センター研究所の金子修三ユニット長、同中央病院婦人腫瘍科の加藤友康科長、病理診断科の吉田裕医員、東京大学医学部附属病院の曾根献文講師、織田克利教授、大須賀穣教授らの国際共同研究グループは、医療ビッグデータとコンピュータ科学を活用し、卵巣がんの新しい治療標的として、「LKB1-MARK3経路[1]」を同定しました。
本研究成果は、卵巣がんのうち最も死亡者数の多い「高異型度漿液性卵巣がん」の新しい治療法の開発につながると期待できます。
今回、国際共同研究グループは、卵巣がん患者の検体から取得した遺伝子発現情報に関するビッグデータを、さまざまなアルゴリズムを用いてコンピュータで解析(ビッグデータ解析)しました。その結果、正常組織に比べて、がん組織ではLKB1-MARK3経路の遺伝子の発現が抑制されており、その遺伝子発現量の低下が臨床予後の悪化に関わることが分かりました。また、LKB1-MARK3経路が、タンパク質合成経路に関わる代謝性ストレスに応答して細胞周期[2]G2/M期[2]停止を誘導する細胞周期チェックポイント[2]であることを明らかにしました。LKB1-MARK3経路が機能異常に陥っている卵巣がんは、代謝性ストレスに対する脆弱性が高まり、予後不良を引き起こすと考えられます。
本研究は、科学雑誌『Communications Biology』オンライン版(1月11日付)に掲載されました。
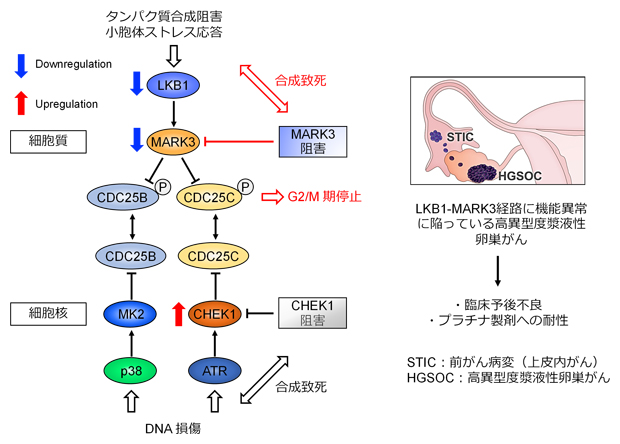
高異型度漿液性卵巣がんにおけるLKB1-MARK3経路の機能異常
背景
「高異型度漿液性卵巣がん」は卵巣がんによる死亡者数の70~80%を占め、最も予後の悪い婦人科系悪性腫瘍です注1)。近年のゲノム解析の結果、高異型度漿液性卵巣がんのほぼ全例にがん抑制遺伝子TP53[3]の不活性化型変異が認められ、染色体不安定性によるゲノム構造の異常が広汎に引き起こされていることが分かっています。このうち、約半数には相同組換え修復経路[4]の分子に発現変化・機能異常が認められ、PARP阻害剤[5]が有効な治療法とされていますが、残りの約半数の症例に対する治療標的は十分には確立していません。
また、高異型度漿液性卵巣がんは、ゲノムの点突然変異[6]の頻度が低い一方で、染色体不安定性によるコピー数変化[6]が頻繁に生じていることが分かっています。そのため、個別の遺伝子変異に注目した従来型の研究手法では、これ以上新しい治療標的を発見できない可能性があります。従って、国際共同研究グループは、さまざまなアルゴリズムを用いてコンピュータで解析する「ビックデータ解析」に基づき、遺伝子発現量の変化を定量的に評価する必要があると考え、研究を開始しました。
注1)Bowtell, D. D. et al. Rethinking ovarian cancer II: reducing mortality from high-grade serous ovarian cancer. Nat. Rev. Cancer 15, 668-679 (2015).
研究手法と成果
国際共同研究グループは、高異型度漿液性卵巣がんのがん組織と正常卵巣組織の遺伝子発現量を比較解析するために、大規模なマイクロアレイ[7]データ、RNA-seq[8]データ、臨床情報などが含まれる複数のデータベースの統合解析を行い、遺伝子発現変化が臨床予後に影響する遺伝子を抽出するために、新しい解析プラットフォームを構築しました(図1)。その結果、「LKB1-MARK3経路」のMARK3遺伝子が高異型度漿液性卵巣がんで発現抑制されており、その遺伝子発現量の低下が臨床予後の悪化に関わることが分かりました(図1)。
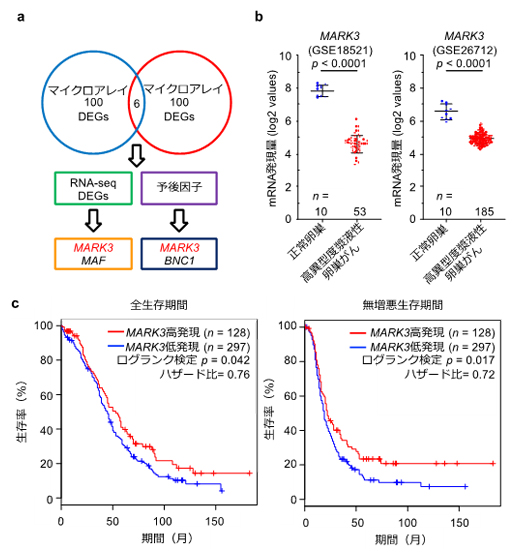
図1 医療ビックデータ解析による新規治療標的の探索パイプラインと解析結果
a:独立した2種類のマイクロアレイデータセット間で重複する発現変動遺伝子(DEGs)を抽出した。このうちRNA-seqデータセットでも同様の発現プロファイルを持ち、かつ、遺伝子発現量が臨床予後と相関する遺伝子としてMARK3を同定した。
b:2種類のマイクロアレイデータセットにおいて、正常卵巣組織と比較して高異型度漿液性卵巣がん組織でMARK3遺伝子の発現量が低下している。
c:MARK3遺伝子の発現量が低下している高異型度漿液性卵巣がん症例(青線)は、MARK3遺伝子の発現量が低下しない例(赤線)に比べて有意に臨床予後不良であった。
タンパク質MARK3は、AMPK関連キナーゼ(リン酸化酵素)に分類されるセリンスレオニンキナーゼであり、タンパク質LKB1から直接リン酸化修飾を受けることでキナーゼとしての機能が活性化することが知られていましたが、LKB1-MARK3経路の卵巣がんにおける異常については報告されていませんでした。
次に、ビックデータ解析の結果を臨床医学的に検証するために、高異型度漿液性卵巣がんの正常組織(卵管上皮細胞)と前がん病変(上皮内がん)、浸潤がんの患者由来検体を用いて、LKB1とMARK3のタンパク質発現量を評価しました。その結果、正常組織ではLKB1とMARK3がいずれも発現している一方、前がん病変(上皮内がん)でLKB1の発現が低下し、浸潤がんでMARK3の発現が低下することが分かりました(図2)。
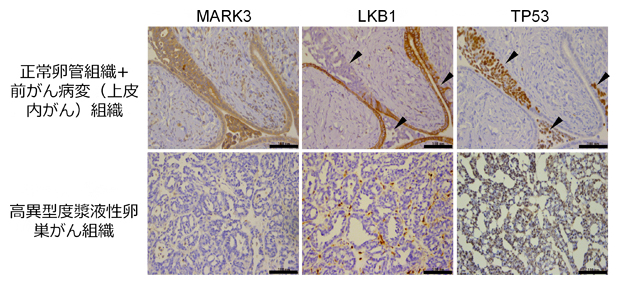
図2 卵巣がん組織におけるLKB1とMARK3のタンパク質発現プロファイル
上段は正常卵管組織と前がん病変(上皮内がん)組織。下段は高異型度漿液性卵巣がん組織。TP53が発現する前がん病変(上皮内がん)組織では、LKB1の発現が低下する(▼矢印)。高異型度漿液性卵巣がん組織では、MARK3の発現が低下する。スケールは100マイクロメートル(μm、1μmは1,000分の1mm)。
次に、MARK3の機能を解析するために、卵巣がん細胞株(OVCAR3)にMARK3を強制発現させた際の影響をRNA-seqを用いて評価しました。KEGGパスウェイ解析[9]の結果、MARK3の強制発現によって細胞周期の経路に関わる遺伝子群の発現量が低下することが分かりました。
そこで、MARK3が細胞周期に影響を与える機序を解明するために、リン酸化モチーフ解析[10]により、MARK3がキナーゼとしてリン酸化修飾をする対象となる新しい基質を探索しました。その結果、興味深いことに、MARK3が細胞周期のG2/M期移行をつかさどるCDC25Bをリン酸化修飾する可能性が示されたため、キナーゼアッセイ[11]で検証したところ、確かにMARK3がCDC25Bの323番目のセリンを直接リン酸化することが分かりました。機能的に、MARK3はCDC25の323番目のセリンをリン酸化することで、CDC25Bの核内移行を阻害し、細胞周期のG2/M期停止を誘導する役割を持つと考えられました。
このCDC25ファミリーをリン酸化するMARK3の機能は、細胞がDNA損傷を受けた際にCDC25ファミリーをリン酸化して細胞周期停止を誘導する、CHEK1などのDNA損傷応答性の細胞周期チェックポイントキナーゼの機能と類似していました。
そこで、「MARK3も何らかの細胞ストレスに応答して細胞周期を調整する細胞周期チェックポイントキナーゼである」という仮説を立て、さまざまなストレス誘導物質を反応させた際のMARK3活性化の有無を評価しました。その結果、タンパク質合成阻害剤であるアニソマイシンや、不良タンパク質の蓄積状態を模倣する小胞体ストレス[12]誘導物質であるタプシガルギンと反応させたときに、MARK3が活性化することが明らかになりました。興味深いことに、CHEK1に代表されるDNA損傷応答性チェックポイントキナーゼを活性化させるDNA損傷誘導物質と反応させたときには、MARK3は活性化しませんでした。
また、MARK3遺伝子の上流にあるLKB1遺伝子をノックダウン[13]したところ、アニソマイシンによるMARK3の活性化は起こりませんでした。さらに、MARK3遺伝子をノックアウト[13]した細胞株に対しては、アニソマイシンとタプシガルギンの抗腫瘍効果が高まることが示されました。以上から、LKB1-MARK3経路はタンパク質合成経路に関わる代謝性ストレスに応答する「細胞周期チェックポイント」であると考えられました。
MARK3による細胞への影響をさらに詳しく解明するために、網羅的クロマチン構造[14]解析法であるATAC-seq[14]を用いて、卵巣がん細胞株(OVCAR3)にMARK3を強制発現させた際のクロマチン構造情報を取得し、転写因子モチーフ解析[15]を行いました。その結果、MARK3の強制発現によって、JUNやFOSなどから構成されるAP-1複合体[16]のDNA結合活性が低下することが示唆され(図3a)、ウェスタンブロッティング法[17]でもJUNのリン酸化修飾が減弱することが示されました。
また、AP-1複合体はHippoシグナル伝達[18]の転写因子[15]と相互作用することが報告されていましたが、今回取得したRNA-seqデータの結果も、MARK3の強制発現によってHippoシグナル伝達の標的遺伝子の発現量が低下することを示していました(図3b)。以上から、MARK3は卵巣がん細胞株においてAP-1複合体とHippoシグナル伝達の標的遺伝子を発現抑制することによって抗腫瘍効果を発揮すると考えられました。
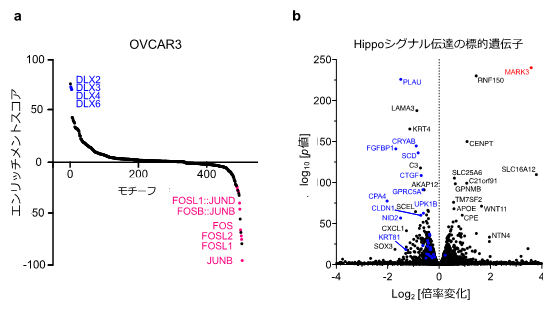
図3 網羅的クロマチン構造解析の結果
a:ATAC-seqによる転写因子モチーフ解析の結果、MARK3の強制発現によってピンク字で示したJUNやFOSなどのDNA結合モチーフのエンリッチメントスコアが低下した。これは、JUNやFOSなどよって構成されるAP-1複合体のDNA結合活性が低下することを示唆する。
b:MARK3の強制発現によりHippoシグナル伝達の標的遺伝子(青字の遺伝子)の発現量が低下した。
最後に、マウスの皮下組織にMARK3を強制発現させた卵巣がん細胞株(OVCAR3)を移植したところ、コントロール群と比較して有意に腫瘍形成と血管新生が阻害され、MARK3が生体内においても強力な抗腫瘍効果を持つことが明らかになりました(図4)。
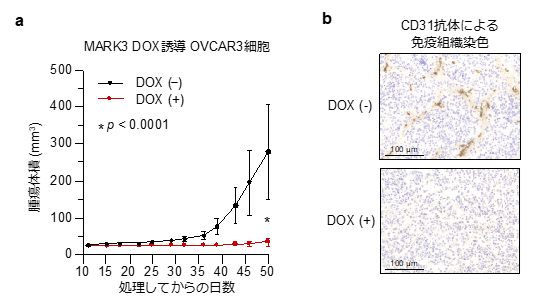
図4 マウス皮下移植モデルを用いた研究結果
a:卵巣がん細胞株(OVCAR3)にDoxycycline(DOX)誘導性にMARK3を強制発現させると、マウスの皮下組織における腫瘍形成が有意に阻害された。
b:MARK3の強制発現によってマウス生体内のCD31染色で標識される血管内皮細胞(茶色)の形成が阻害された。
今後の期待
本研究では、理研革新知能統合研究センターが保持する先導的な情報科学技術を用いて医療ビッグデータを解析し、従来の医学研究手法でその結果を検証しました。この成果は、がん研究においても情報科学と医学が融合した学際的な研究手法が重要であることを示しています。
卵巣がんは婦人科系悪性腫瘍の中で最も死亡者数の多いがん種であり、有効な治療法の開発が強く求められています。本研究では、正常組織とがん組織の遺伝子発現情報に着目したビッグデータ解析手法を導入することによって、今まで知られていなかった卵巣がんにおけるLKB1-MARK3経路の機能異常を同定することに成功しました。今回のビッグデータ解析手法は、異なるがん種や疾患の原因探索にも応用できる可能性があります。
また、本研究では、LKB1-MARK3経路がタンパク質合成経路に関わる代謝性ストレスに応答する細胞周期チェックポイントであることを世界に先駆けて報告しました。ストレス応答性チェックポイントが機能異常に陥っているがんは細胞ストレスに対して脆弱になり、予後が悪化する傾向にあるため、今後、LKB1-MARK3経路はがんの新しい治療標的としてますます重要視される可能性があります。
補足説明
1.LKB1-MARK3経路
LKB1はセリンスレオニンキナーゼをコードするがん抑制遺伝子であり、生殖細胞変異した場合、消化管の過誤腫性ポリポーシスを発症するポイツ・ジェガース症候群を引き起こすほか、肺腺がんでは頻繁に体細胞変異が生じていることが知られている。MARK3は、LKB1によって直接的にリン酸化修飾を受けるセリンスレオニンキナーゼである。
2.細胞周期、G2/M期、細胞周期チェックポイント
細胞が分裂する際の一連の事象が発生する周期のことを「細胞周期」といい、G0期、G1期、S期、G2期、M期に分類される。G2期はDNA合成が完了した後の間期であり、M期には有糸分裂と細胞質分裂が行われる。正常な細胞分裂が行われることを監視する機構のことを「細胞周期チェックポイント」といい、G2/M期細胞周期チェックポイントがG2からM期への移行を制御している。
3.TP53
ヒトがんにおいて最も変異頻度の高い遺伝子のひとつである。TP53の遺伝子産物p53は、細胞内においてDNA修復や細胞周期の停止、アポトーシスなどの細胞増殖サイクルの抑制を制御する機能を持つ。
4.相同組換え修復経路
DNAに二本鎖切断などの損傷が生じた場合に、姉妹染色分体の相同なDNA配列を利用して正確なDNA修復を行う経路のこと。
5.PARP阻害剤
本剤はPARP(ポリアデノシン5’二リン酸リボースポリメラーゼ)を阻害することで1本鎖切断を担う塩基除去修復を妨げる。これにより、修復されないDNAの1本鎖切断はDNA複製の過程で2本鎖切断に至るが、相同組換えができない卵巣がん細胞では、2本鎖切断を修復できず細胞死に至る。本剤はこのような作用の仕組みによって細胞死が誘導され抗腫瘍効果を示すとされる。
6.点突然変異、コピー数変化
「点突然変異」は1塩基置換とも呼ばれ、遺伝物質DNAの1ヌクレオチド塩基が別のヌクレオチド塩基に置換されることであり、結果としてナンセンス変異、ミスセンス変異、サイレント変異を生ずる。「コピー数変化」は、体細胞において後天的に生じるDNAのコピー数の変化のことであり、DNA複製のミスや紫外線の照射、突然変異誘発物質などで生じる。これらは、体細胞に遺伝子異常が蓄積する源とされ、体細胞ががん細胞化する原因の一つとされる。
7.マイクロアレイ
オリゴヌクレオチド、cDNAなどをガラスなどの基板上に高密度に整列固定したツールである。このマイクロアレイ上に、検体となるRNAやDNAをハイブリダイゼーションすることによって、遺伝子発現量、塩基配列の決定、遺伝子変異・SNP解析、染色体コピー数変動といったRNAやDNAの多様な質的および量的変化を調べることができる。
8.RNA-seq
次世代シーケンサーを駆使したトランスクリプトーム解析を実施するための実験手法である。マイクロアレイなど、他の手法と比較してダイナミックレンジに優れ、低発現遺伝子の検出、新規遺伝子およびアイソフォームの探索が可能である。
9.KEGGパスウェイ解析
RNA-seq解析などから明らかになった発現変動遺伝子やゲノム解析から同定された遺伝子が、どのようなシグナル伝達経路や代謝系に関わっているのかを可視化するツールの一つである。KEGGはKyoto Encyclopedia of Genes and Genomesの略。
10.リン酸化モチーフ解析
タンパク質リン酸化酵素(キナーゼ)は、リン酸化するアミノ酸の周辺配列に対して特異性を持つことが知られている。このリン酸化された特異的配列はリン酸化モチーフと呼ばれ、キナーゼやリン酸化部位の推定に有用な解析手法である。
11.キナーゼアッセイ
培養細胞や大腸菌から精製したキナーゼを用いてリン酸化酵素活性能の解析やタンパク質のリン酸化部位の同定に用いる実験手法。
12.小胞体ストレス
生体恒常性維持に欠かせない細胞小器官(オルガネラ)の一つである小胞体は、膜タンパク質や分泌タンパク質の翻訳後修飾や適正な折り畳みを担っている。また、細胞の内外から種々の刺激負荷がかかると、小胞体内でのタンパク質折り畳みに障害が起こり、折り畳み不全の不良タンパク質が蓄積する。この状態を小胞体ストレスと呼ぶ。
13.ノックダウン、ノックアウト
短い2本鎖RNA断片を細胞内に導入して、標的mRNAの働きを抑制することを「ノックダウン」と呼び、遺伝子の機能を強力に阻害するが、完全に除去されることはない。一方、ゲノム編集などで特定の遺伝子コードを変更する「ノックアウト」では、遺伝子の機能は完全に除去される。
14.クロマチン構造、ATAC-seq
4種類のヒストン(H2A、H2B、H3、H4)の各2個が形成した8個のタンパク質複合体に約146塩基対のDNAが巻き付いたヌクレオソームが、数珠状に連なっている状態を「クロマチン構造」と呼ぶ。「ATAC-seq」は、プロモーターやエンハンサーといった遺伝子発現制御領域に対応するオープンクロマチン領域(ヌクレオソームのない領域)に見られる塩基配列を網羅的に解析する手法の一つであり、疾患や細胞変化に関わる転写因子の結合を予測できる。
15.転写因子、転写因子モチーフ解析
「転写因子」とはDNAに結合して遺伝子の転写を促すタンパク質を指し、哺乳類ではおおよそ1,500程度あると考えられている。DNAの特異的な配列に結合することが知られており、転写因子が結合するDNA配列(モチーフ)を調べることを、「転写因子モチーフ解析」と呼ぶ。
16.AP-1複合体
Activator protein-1の略で、JUNやFOSなどによって構成される転写因子の一つ。AP-1複合体は細胞増殖、分化、アポトーシスなどさまざまな細胞応答に関わることが知られている。
17.ウェスタンブロッティング法
生化学実験で一般的に用いられるタンパク質検出法の一つ。電気泳動によりタンパク質のサイズに応じた分離を行い、その後メンブレンと呼ばれるタンパク質や核酸に結合する膜に転写する。転写されたタンパク質に対して、抗体を利用して特異的にタンパク質を検出する。目的タンパク質の発現解析として用いられる。
18.Hippoシグナル伝達
シグナル伝達の一つで、ショウジョウバエで最初に発見された。進化的にも保存されたシグナルとして知られており、哺乳類ではYAPやTAZなどの制御を介して、細胞増殖、アポトーシスなどのさまざまな細胞応答に関与することが知られている。
国際共同研究グループ
理化学研究所 革新知能統合研究センター
目的指向基盤技術研究グループ がん探索医療研究チーム
特別研究員 町野 英徳(まちの ひでのり)
(国立がん研究センター研究所 医療AI研究開発分野 外来研究員)
チームリーダー 浜本 隆二(はまもと りゅうじ)
(国立がん研究センター研究所 医療AI研究開発分野 分野長)
副チームリーダー 小松 正明(こまつ まさあき)
研究員 浅田 健(あさだ けん)
国立がん研究センター研究所 医療AI研究開発分野
ユニット長 金子 修三(かねこ しゅうぞう)
テクニカルスタッフ 井川 典子(いかわ のりこ)
研修生 生水 貫人(しょうず かんと)
研修生 同前 愛(どうぜん あい)
国立がん研究センター中央病院
婦人腫瘍科
科長 加藤 友康(かとう ともやす)
病理診断科
医員 吉田 裕(よしだ ひろし)
東京大学 大学院医学系研究科 医学部/東京大学医学部附属病院
生殖・発達・加齢医学専攻 産婦人科学講座
教授(研究当時) 藤井 知行(ふじい ともゆき)
教授 大須 賀穣(おおすが ゆたか)
講師 曾根 献文(そね けんぶん)
生体物理医学専攻 医用生体工学講座
教授 織田 克利(おだか つとし)
東京大学 定量生命科学研究所 大規模生命情報解析研究分野
講師 中戸 隆一郎(なかと りゅういちろう)
米国メモリアルスローンケタリングがんセンター
Medical Oncologist ゴットフリード・フォン・クーデル(Gottfried von Keudell)
米国国立がん研究所 がん研究センター
Physician-Scientist Early Investigator ヴァシリキ・サローラ (Vassiliki Saloura)
研究支援
本研究は、文部科学省「次世代人工知能技術等研究開発拠点形成事業費補助金」による支援を受けて行われました。
原論文情報
Hidenori Machino, Syuzo Kaneko, Masaaki Komatsu, Noriko Ikawa, Ken Asada, Ryuichiro Nakato, Kanto Shozu, Ai Dozen, Kenbun Sone, Hiroshi Yoshida, Tomoyasu Kato, Katsutoshi Oda, Yutaka Osuga, Tomoyuki Fujii, Gottfried von Keudell, Vassiliki Saloura, and Ryuji Hamamoto, “The metabolic stress-activated checkpoint LKB1-MARK3 axis acts as a tumor suppressor in high-grade serous ovarian carcinoma”, Communications Biology, 10.1038/s42003-021-02992-4
発表者
理化学研究所
革新知能統合研究センター 目的指向基盤技術研究グループ がん探索医療研究チーム
特別研究員 町野 英徳(まちの ひでのり)
(国立がん研究センター研究所 医療AI研究開発分野 外来研究員)
チームリーダー 浜本 隆二(はまもと りゅうじ)
(国立がん研究センター研究所 医療AI研究開発分野 分野長)
国立がん研究センター 中央病院 婦人腫瘍科
科長 加藤 友康(かとう ともやす)
東京大学 医学部(生殖・発達・加齢医学専攻 産婦人科学講座)/東京大学医学部附属病院
講師 曾根 献文(そね けんぶん)
報道担当
理化学研究所 広報室 報道担当
国立がん研究センター 企画戦略局 広報企画室
東京大学医学部附属病院 パブリック・リレーションセンター
東京大学定量生命科学研究所 総務チーム