2022-03-30 ワシントン大学セントルイス校
・フィトクロムは、重要な光受容体の一つであり、赤色光、遠赤色光、そして温度を感知する。しかし、フィトクロムがどのように機能するかは不明なままであった。
・ワシントン大学セントルイス校とヴァンアンデル研究所(VAI)は、フィトクロムB(PhyB)の分子構造を決定し、これまで知られていたものとは全く異なる構造を持つことを明らかにした。
・研究成果は、3月30日発行の『Nature』誌に掲載され、農業や「グリーン」バイオエンジニアリングの実践に多くの示唆を与えています。
<関連情報>
- https://source.wustl.edu/2022/03/molecular-blueprint-illuminates-how-plants-perceive-light/
- https://www.nature.com/articles/s41586-022-04529-z
植物フィトクロムBはユニークなシグナル伝達能を持つ非対称二量体である Plant phytochrome B is an asymmetric dimer with unique signalling potential
Hua Li,E. Sethe Burgie,Zachary T. K. Gannam,Huilin Li &Richard D. Vierstra
Nature Published: 30 March 2022
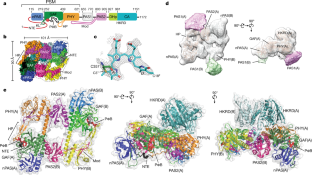
Abstract
Many aspects of plant photoperception are mediated by the phytochrome (Phy) family of bilin-containing photoreceptors that reversibly interconvert between inactive Pr and active Pfr conformers1,2. Despite extensive biochemical studies, full understanding of plant Phy signalling has remained unclear due to the absence of relevant 3D models. Here we report a cryo-electron microscopy structure of Arabidopsis PhyB in the Pr state that reveals a topologically complex dimeric organization that is substantially distinct from its prokaryotic relatives. Instead of an anticipated parallel architecture, the C-terminal histidine-kinase-related domains (HKRDs) associate head-to-head, whereas the N-terminal photosensory regions associate head-to-tail to form a parallelogram-shaped platform with near two-fold symmetry. The platform is internally linked by the second of two internal Per/Arnt/Sim domains that binds to the photosensory module of the opposing protomer and a preceding ‘modulator’ loop that assembles tightly with the photosensory module of its own protomer. Both connections accelerate the thermal reversion of Pfr back to Pr, consistent with an inverse relationship between dimer assembly and Pfr stability. Lopsided contacts between the HKRDs and the platform create profound asymmetry to PhyB that might imbue distinct signalling potentials to the protomers. We propose that this unique structural dynamism creates an extensive photostate-sensitive surface for conformation-dependent interactions between plant Phy photoreceptors and their signalling partners.


