抗生物質がマイクロバイオームを破壊し、さらなる尿路結石のリスクを増加させる可能性 Antibiotics may increase risk of further UTIs by disrupting microbiome
2022-05-02 ワシントン大学セントルイス
新しい研究によれば、尿路結石を繰り返す女性は、ある感染症を根絶するために投与された抗生物質が、別の感染症を発症させるという悪循環に陥っている可能性があるとのことである。セントルイスのワシントン大学医学部とマサチューセッツ工科大学とハーバード大学のブロード研究所の研究者によるこの研究では、抗生物質の投与によって膀胱から病気を引き起こす細菌は除去されるが、腸からは除去されないことが明らかにされた。腸内で生き残った細菌は増殖し、再び膀胱に広がり、別の尿路結石を引き起こす可能性がある。
同時に、抗生物質の投与が繰り返されると、腸内に通常生息している有用な細菌群、いわゆる腸内細菌叢に大打撃を与えることになる。腸内細菌と免疫系が関連する他の疾患と同様に、今回の研究で尿路結石を再発した女性は、マイクロバイオームの多様性が低く、炎症の制御に役立つ重要な細菌群が欠乏しており、血液中には炎症を示す独特の免疫学的シグネチャーが認められました。
この研究は、5月2日発行のNature Microbiologyに掲載されています。
<関連情報>
- https://source.wustl.edu/2022/05/recurrent-utis-linked-to-gut-microbiome-chronic-inflammation/
- https://www.nature.com/articles/s41564-022-01107-x
女性における腸内細菌叢の異常と尿路感染症の再発を縦断的なマルチオミクス解析で関連付ける Longitudinal multi-omics analyses link gut microbiome dysbiosis with recurrent urinary tract infections in women
Colin J. Worby,Henry L. Schreiber IV,Timothy J. Straub,Lucas R. van Dijk,Ryan A. Bronson,Benjamin S. Olson,Jerome S. Pinkner,Chloe L. P. Obernuefemann,Vanessa L. Muñoz,Alexandra E. Paharik,Philippe N. Azimzadeh,Bruce J. Walker,Christopher A. Desjardins,Wen-Chi Chou,Karla Bergeron,Sinéad B. Chapman,Aleksandra Klim,Abigail L. Manson,Thomas J. Hannan,Thomas M. Hooton,Andrew L. Kau,H. Henry Lai,Karen W. Dodson,Scott J. Hultgren & Ashlee M. Earl
Nature Microbiology Published: 02 May 2022
Abstract
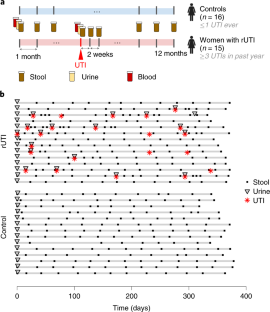
Recurrent urinary tract infections (rUTIs) are a major health burden worldwide, with history of infection being a significant risk factor. While the gut is a known reservoir for uropathogenic bacteria, the role of the microbiota in rUTI remains unclear. We conducted a year-long study of women with (n = 15) and without (n = 16) history of rUTI, from whom we collected urine, blood and monthly faecal samples for metagenomic and transcriptomic interrogation. During the study 24 UTIs were reported, with additional samples collected during and after infection. The gut microbiome of individuals with a history of rUTI was significantly depleted in microbial richness and butyrate-producing bacteria compared with controls, reminiscent of other inflammatory conditions. However, Escherichia coli gut and bladder populations were comparable between cohorts in both relative abundance and phylogroup. Transcriptional analysis of peripheral blood mononuclear cells revealed expression profiles indicative of differential systemic immunity between cohorts. Altogether, these results suggest that rUTI susceptibility is in part mediated through the gut–bladder axis, comprising gut dysbiosis and differential immune response to bacterial bladder colonization, manifesting in symptoms.