2022-05-26 名古屋大学,愛知医科大学,日本医療研究開発機構
名古屋大学大学院医学系研究科神経内科学の勝野雅央 教授、佐橋健太郎 講師、辻河高陽 医員(筆頭研究者)らの研究グループは、国立研究開発法人日本医療研究開発機構(AMED)脳とこころの研究推進プログラム(領域横断的かつ萌芽的脳研究プロジェクト)の支援を受け、横浜市立大学大学院医学研究科遺伝学の松本直通 教授、濱中耕平 助教、愛知医科大学加齢医科学研究所の吉田眞理 特命研究教授、名古屋大学大学院医学系研究科細胞生物学の宮田卓樹 教授、新潟大学医学部脳研究所 兼 JALPAC※1コンソーシアムの池内健 教授、東京大学大学院医学系研究科神経病理学 兼 J-ADNI※2コンソーシアムの岩坪威 教授、その他の複数の研究機関との共同研究により、アクチン結合蛋白フィラミンAがタウの凝集を促進し、進行性核上性麻痺の病態に関与することを明らかにしました。
進行性核上性麻痺は、アルツハイマー病と同様に、脳内に凝集したタウが神経細胞死を引き起こすと考えられている神経難病です。認知症症状だけではなく、パーキンソン病に類似した運動障害も併発します。これまで、病気の発端となるタウの凝集メカニズムを含め、進行性核上性麻痺の病態には不明な点が多く、十分な治療薬がいまだありません。
今回、勝野教授らの研究グループは、進行性核上性麻痺の患者の脳組織や遺伝子を解析し、凝集したタウとフィラミンAが共局在すること、および、遺伝子解析によりフィラミンAの遺伝子に変異を持つ患者を同定しました。さらに、フィラミンAが細胞骨格分子のアクチンを介してタウを凝集する作用を明らかにしました。また、マウス個体においても、フィラミンA過剰発現は、進行性核上性麻痺の患者と同様の、脳内におけるタウの異常凝集を誘導することを確認しました。
本研究により、フィラミンAは進行性核上性麻痺の病態に関与し、治療標的となりうることが示唆されました。研究成果は米国科学振興協会の科学雑誌「Science Advances」(米国東部標準時間2022年5月25日電子版)に掲載されました。
ポイント
- 進行性核上性麻痺の患者(死後剖検脳)において、フィラミンAがタウとともに凝集していることを発見した。フィラミンAのゲノムコピー数変異※3やレアバリアント※4が、患者の一部に見出された。
- 細胞実験により、フィラミンAがタウの凝集を促進することを証明した。
- フィラミンA過剰発現マウスを作製したところ、進行性核上性麻痺の患者と同様の、脳内のタウ凝集が再現された。
背景
進行性核上性麻痺(progressive supranuclear palsy:PSP)は、脳内の神経細胞とグリア細胞において微小管結合蛋白タウが異常に凝集し、神経細胞死をきたす難病であり、その患者の多くが発症後5年から10年で死亡します。経過中に多様な神経症状、認知症症状、精神症状をきたし、転倒や誤嚥・窒息などによる合併症を伴うことから、患者のご家族に深刻な介護負担を招きやすく、解決すべき大きな社会的問題となっています。死後脳剖検で見られる、星形のグリア細胞であるアストロサイトにおいて房状にタウが凝集する「tufted astrocyte」が、PSPの大きな特徴です。かつては核上性※5の眼球運動障害や姿勢反射障害を主徴とするRichardson症候群がPSPの神経症状とみなされていましたが、死後剖検脳の知見の蓄積により、現在ではパーキンソン病や脊髄小脳変性症と診断される患者の中に、実際にはPSPである患者が含まれることが明らかになっています。そのため、PSPの有病率は人口10万人あたり約18人と考えられてきましたが、実際にはそれ以上の患者数が潜在的に存在すると推測されます。しかしながら、PSPの分子病態には不明な点が多く、病態を抑止する根本的治療はいまだ確立されていません。
タウの異常凝集を伴った神経細胞死が確認されている疾患は、アルツハイマー病が代表的であり、PSP等とともにタウオパチーと称されます。アルツハイマー病においては、アミロイドβがタウに凝集を促すというアミロイド仮説が知られており、現在までにアミロイドβを標的とした治療開発が展開されてきました。一方、PSPにおいてはアミロイドβの関与は否定的であり、PSPのタウの凝集を支配する分子は長らく不明でした。
研究成果
タウオパチーで検出される凝集したタウは界面活性剤のサルコシルに溶けにくいことが知られています。今回、我々はPSPの患者の脳組織をサルコシル含有の溶液に溶かし、タウ以外の不溶性の分子を液体クロマトグラフィータンデム質量分析(LC-MS/MS)※6によって探索したところ、細胞骨格を担うアクチンと結合する作用が知られているフィラミンAを同定しました。PSPに加えて、健常の方やPSP以外の神経難病(アルツハイマー病、大脳基底核変性症、ピック病、パーキンソン病、レビー小体型認知症)の患者の脳組織も用いて検討し、サルコシル不溶性のフィラミンAは、特にPSPの患者の脳に豊富だということがわかりました。続いて病理学的な検討を行ったところ、PSPの患者の脳ではフィラミンAが凝集したタウと共存していること(図1)を観察し、それらが分子レベルでの関係性を持つことが予想されました。また、我々が解析した患者には同時期にPSPを発症した一卵性双生児例が含まれており、彼らのゲノムを解析したところ、フィラミンAの遺伝子が2倍に重複したコピー数変異を認めました。さらに日本のPSP患者312名に対してフィラミンA遺伝子の塩基配列を解析し、12名にp.Ser2523Asn型等のレアバリアントを認めました。このフィラミンA遺伝子レアバリアントについて、健常者499名の遺伝情報を用いた症例対照研究※7を実施し、オッズ比※83.91の効果を持ってPSPの発症に寄与する可能性を示しました。
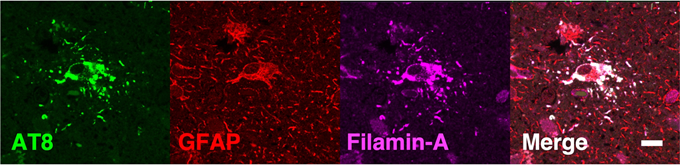
図1 患者死後脳の蛍光免疫染色(孤発性PSPにおける皮質下白質のtufted astrocyte)リン酸化タウ(AT8:緑)とフィラミンA(Filamin-A:マゼンタ)が共局在(Merge:白)している。その共局在の部位では、アストロサイトのマーカーであるGFAP(赤)の染色性が低下しており、アストロサイトの機能低下を示唆する。Scale bar = 10μm。
フィラミンAは生前の脳の発生過程において神経細胞を移動させるための重要な分子であることは既に知られていましたが、タウへの影響については十分な知見が得られていませんでした。そこで、培養細胞を用いた実験を行い、フィラミンAの過剰発現により、タウが過剰なリン酸化や蛋白安定化を伴って凝集することを示しました。また、共免疫沈降※9により、フィラミンAとタウが相互作用をもち、フィラミンAの過剰発現時にはタウにユビキチン化※10が増強し、分子シャペロン※11を誘導することを示しました。また、ラットのアストロサイトを単離してフィラミンAを過剰発現させると、細胞体内にリン酸化したタウが凝集しました。こうしたフィラミンAによるタウの変化は、PSPの患者の脳内のタウの特徴と類似しています。
次に、in utero electroporation※12を用いてマウス胎仔脳に正常型フィラミンAを導入したところ、神経細胞において、移動障害とともに、タウの増加を認めました。アクチン結合作用を減弱させるp. Ala39Gly変異型フィラミンAを共発現させた場合には、移動障害やタウの増加は抑制されました。また、正常型フィラミンAを導入したマウス胎仔脳から単離した神経細胞には、アクチンの重合とタウの過剰リン酸化が生じていましたが、アクチン重合阻害剤サイトカラシンDの投与により、タウの過剰リン酸化が解消されました。これらより、フィラミンAはアクチンを介してタウに影響を与えることが考えられました(図2)。
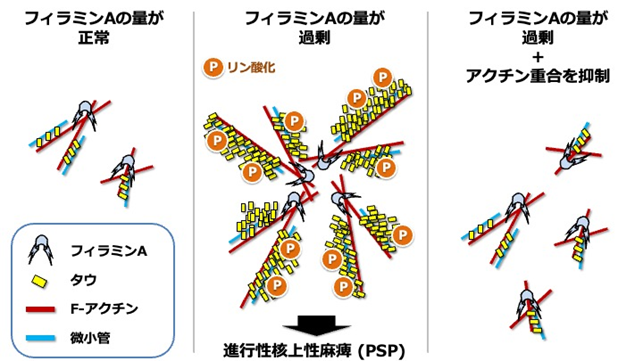
図2 本研究の概要図アクチン結合蛋白フィラミンAの量が過剰である場合、繊維状アクチン(F-アクチン)の重合が促進され、微小管「結合蛋白タウはリン酸化という化学修飾を受けて凝集しやすくなる。しかし、アクチンの重合を抑制すると、タウの凝集が軽減する。
さらに生後のマウス個体でも検証するため、アクチンとの相互作用に重要なドメインを集約した短縮型フィラミンAの発現を誘導するアデノ随伴ウイルス※13(AAV-ΔFLNA)を開発しました。2ヶ月齢の野生型マウスの脳内にAAV-ΔFLNAを遺伝子導入し1ヶ月後に調べたところ、野生型マウス脳内でタウが増加しました。タウはマウスとヒトでは構造が異なる部分があるため、マウスのタウを持たずヒトのタウのみを発現する遺伝子改変マウス(ヒト化タウマウス)を用いて、同様に検討しました。その結果、ヒト化タウマウスにおいてもAAV-ΔFLNAを遺伝子導入によりタウの増加を確認しました。
最後に、我々はヒトの全長フィラミンAを発現する遺伝子改変(FLNA-Tg)マウスを新たに作製しました。FLNA-Tgマウスの脳内にはフィラミンAが過剰に産生されます。すると、5ヶ月齢の段階でサルコシル不溶性のリン酸化タウが検出されました。病理学的な検討を行い、神経細胞とグリア細胞において、PSPの脳組織同様、フィラミンAが凝集したタウと共存していることが確認されました。FLNA-Tgマウスから単離した神経細胞は、タウがリン酸化し神経突起の短縮など細胞形態が損なわれていましたが、レンチウイルス※14を用いてフィラミンAの発現を是正すると、タウのリン酸化は軽減し、神経細胞の形態は正常化しました。
以上から、フィラミンAの過剰発現によるタウ蛋白量の増加は長らく不明であったPSPの分子病態の主要なファクターであると考えられ、フィラミンAをウイルス遺伝子導入や遺伝子改変したマウスがPSPの病態を十分に反映し、そしてPSPの治療標的としてフィラミンAが有用である可能性を示唆しました。
今後の展開
我々はフィラミンAを治療標的とするPSPの治療薬を開発するため、名古屋大学創薬科学研究科との共同研究や国内製薬企業との産学連携を行い、創薬スクリーニングのアッセイ系構築に着手しています。また、FLNA-Tgマウスの更なる遺伝子改変やPSP患者由来のiPS細胞樹立も試みており、PSP更なる病態解明とともに創薬研究を加速させていきたいと考えています。
用語説明
- ※1 JALPAC
- Japanese Longitudinal Biomarker Study in PSP and CBDの略。進行性核上性麻痺及び大脳皮質基底核変性症を対象としたオールジャパン体制の多施設共同コホート研究。
- ※2 J-ADNI
- Japanese Alzheimer’s Disease Neuroimaging Initiativeの略。アルツハイマー病を対象としたオールジャパン体制の多施設共同コホート研究。
- ※3 コピー数変異
- 染色体レベルの変化により、遺伝子の数が増減していること。
- ※4 レアバリアント
- 頻度の低い遺伝子型のこと。集団の1%未満、もしくは0.1%未満の遺伝子型を示すことが多い。
- ※5 核上性
- 例えば眼球運動は大脳皮質から脳幹に至る神経と脳幹から眼球に至る神経に支配されており、前者を核上性、後者を核下性として区別される。
- ※6 液体クロマトグラフィータンデム質量分析(LC-MS/MS)
- 質量分析法の一つで、ペプチドや蛋白の同定に用いられる。
- ※7 症例対照研究
- ある疾患を罹患している集団と罹患していない集団に対して特定の要因を比較し、その要因と疾患の関連について評価する研究。
- ※8 オッズ比
- 罹患しやすさの統計的な尺度の一つ。症例対照研究により算出される。
- ※9 共免疫沈降
- 特異抗体を使って蛋白間の相互作用を同定する実験手法。
- ※10 ユビキチン化
- 蛋白分解などに関わる翻訳後修飾の一つ。
- ※11 分子シャペロン蛋白
- 蛋白の折りたたみ(フォールディング)を管理する役割をもつ。
- ※12 in utero electroporation
- マウス子宮内の胎仔脳に対して電気パルスを利用して目的の遺伝子を導入する実験手法。
- ※13 アデノ随伴ウイルス
- 目的の遺伝子を細胞や動物組織に導入するために用いられるウイルス。
- ※14 レンチウイルス
- アデノ随伴ウイルス同様、目的の遺伝子を細胞や動物組織に導入するために用いられるウイルス。
発表雑誌
- 掲雑誌名
- Science Advances
- 論文名
- Actin-binding protein filamin-A drives tau aggregation and contributes to progressive supranuclear palsy pathology
- 著者
- Koyo Tsujikawa1-3, Kohei Hamanaka4, Yuichi Riku1,5, Yuki Hattori6, Norikazu Hara7, Yohei Iguchi1, Shinsuke Ishigaki1,8, Atsushi Hashizume1,9, Satoko Miyatake4,10, Satomi Mitsuhashi4,11, Yu Miyazaki1, Mayumi Kataoka1, Li Jiayi1, Keizo Yasui2, Satoshi Kuru3, Haruki Koike1, Kenta Kobayashi12, Naruhiko Sahara13, Norio Ozaki14, Mari Yoshida5, Akiyoshi Kakita15, Yuko Saito16, Yasushi Iwasaki5, Akinori Miyashita7, Takeshi Iwatsubo16, Japanese Alzheimer’s Disease Neuroimaging Initiative (J-ADNI)a, Takeshi Ikeuchi7, Japanese Longitudinal Biomarker Study in PSP and CBD (JALPAC) Consortiumb, Takaki Miyata6, Gen Sobue8, Naomichi Matsumoto4, Kentaro Sahashi1, Masahisa Katsuno1,9
- 所属
- 1 Department of Neurology, Nagoya University Graduate School of Medicine, Nagoya, Japan
2 Department of Neurology, Japanese Red Cross Aichi Medical Center Nagoya Daini Hospital, Nagoya, Japan
3 Department of Neurology, National Hospital Organization Suzuka National Hospital, Suzuka, Japan
4 Department of Human Genetics, Yokohama City University Graduate School of Medicine, Yokohama, Japan
5 Department of Neuropathology, Institute for Medical Science of Aging, Aichi Medical University, Nagakute, Japan
6 Department of Anatomy and Cell Biology, Nagoya University Graduate School of Medicine, Nagoya, Japan
7 Department of Molecular Genetics, Brain Research Institute, Niigata University, Niigata, Japan
8 Research Division of Dementia and Neurodegenerative Disease, Nagoya University Graduate School of Medicine, Nagoya, Japan
9 Department of Clinical Research Education, Nagoya University Graduate School of Medicine, Nagoya, Japan
10 Clinical Genetics Department, Yokohama City University Hospital, Yokohama, Japan.
11 Department of Genomic Function and Diversity, Medical Research Institute Tokyo Medical and Dental University, Tokyo, Japan.
12 Section of Viral Vector Development, National Institute for Physiological Sciences, Okazaki, Japan
13 Department of Functional Brain Imaging, National Institutes for Quantum and Radiological Science and Technology, Chiba, Japan
14 Department of Psychiatry, Nagoya University Graduate School of Medicine, Nagoya, Japan
15 Department of Pathology, Brain Research Institute, Niigata University, Niigata, Japan
16 Department of Neurology and Neuropathology (The Brain Bank for Aging Research), Tokyo Metropolitan Geriatric Hospital and Institute of Gerontology, Tokyo, Japan.
17 Department of Neuropathology, Graduate School of Medicine, The University of Tokyo, Tokyo, Japan - DOI
- 10.1126/sciadv.abm5029
お問い合わせ先
研究内容に関すること
名古屋大学医学部・医学系研究科 神経内科学
教授 勝野 雅央
愛知医科大学 加齢医科学研究所
特命研究教授 吉田 眞理
広報に関すること
名古屋大学医学部・医学系研究科 総務課総務係
愛知医科大学医学部 庶務課
AMED事業に関すること
日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
脳とこころの研究推進プログラム(領域横断的かつ萌芽的脳研究プロジェクト)