研究により20の手がかりが得られ、それを追求するためのプラットフォームが提供される Study yields 20 other clues, provides platform to pursue them
2022-05-25 ワシントン大学セントルイス
<関連情報>
- https://source.wustl.edu/2022/05/genetic-roots-of-three-mitochondrial-diseases-idd-via-new-approach/
- https://www.nature.com/articles/s41586-022-04765-3
ディープマルチオミクスプロファイリングによるミトコンドリアタンパク質の機能解明 Defining mitochondrial protein functions through deep multiomic profiling
Jarred W. Rensvold,Evgenia Shishkova,Yuriy Sverchkov,Ian J. Miller,Arda Cetinkaya,Angela Pyle,Mateusz Manicki,Dain R. Brademan,Yasemin Alanay,Julian Raiman,Adam Jochem,Paul D. Hutchins,Sean R. Peters,Vanessa Linke,Katherine A. Overmyer,Austin Z. Salome,Alexander S. Hebert,Catherine E. Vincent,Nicholas W. Kwiecien,Matthew J. P. Rush,Michael S. Westphall,Mark Craven,Nurten A. Akarsu,Robert W. Taylor,Joshua J. Coon & David J. Pagliarini
Nature Published:25 May 2022
DOI:https://doi.org/10.1038/s41586-022-04765-3
Abstract
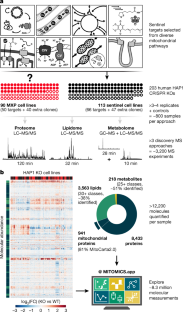
Mitochondria are epicentres of eukaryotic metabolism and bioenergetics. Pioneering efforts in recent decades have established the core protein componentry of these organelles1 and have linked their dysfunction to more than 150 distinct disorders2,3. Still, hundreds of mitochondrial proteins lack clear functions4, and the underlying genetic basis for approximately 40% of mitochondrial disorders remains unresolved5. Here, to establish a more complete functional compendium of human mitochondrial proteins, we profiled more than 200 CRISPR-mediated HAP1 cell knockout lines using mass spectrometry-based multiomics analyses. This effort generated approximately 8.3 million distinct biomolecule measurements, providing a deep survey of the cellular responses to mitochondrial perturbations and laying a foundation for mechanistic investigations into protein function. Guided by these data, we discovered that PIGY upstream open reading frame (PYURF) is an S-adenosylmethionine-dependent methyltransferase chaperone that supports both complex I assembly and coenzyme Q biosynthesis and is disrupted in a previously unresolved multisystemic mitochondrial disorder. We further linked the putative zinc transporter SLC30A9 to mitochondrial ribosomes and OxPhos integrity and established RAB5IF as the second gene harbouring pathogenic variants that cause cerebrofaciothoracic dysplasia. Our data, which can be explored through the interactive online MITOMICS.app resource, suggest biological roles for many other orphan mitochondrial proteins that still lack robust functional characterization and define a rich cell signature of mitochondrial dysfunction that can support the genetic diagnosis of mitochondrial diseases.