2022-06-10 東京大学
発表のポイント
- 発表者らの研究チームは、主要なアセチル化酵素の一つであるp300が、ゲノムDNAを収納しているヌクレオソームに結合した様子を世界で初めて解明しました。
- p300はヌクレオソームの様々な位置に結合可能であることが明らかになり、この性質によってp300は多様なヒストンアセチル化に機能していることが示唆されました。
- p300によるヒストンアセチル化の制御異常は、がんを含む様々な疾患を引き起こすことから、本研究で得られた知見は創薬に向けて応用されることが期待されます。
発表概要
東京大学大学院理学系研究科の畠澤卓 大学院生、東京大学定量生命科学研究所クロマチン構造機能研究分野の滝沢由政 准教授、胡桃坂仁志 教授らの研究チームは、コロラド大学のTatiana Kutateladze教授との共同研究で、細胞の恒常性維持に重要なタンパク質であるp300の活性ドメインと、ヒトのゲノムDNA収納の基盤構造であるヌクレオソームが結合した複合体の構造を世界で初めて解明しました。
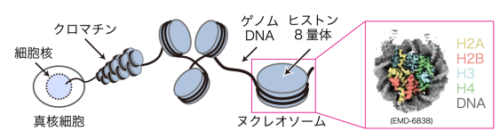
ヒトをはじめとする真核生物のゲノムDNAは、ヒストン複合体に巻き付いてヌクレオソームを形成し、これが数珠状に連なることでクロマチンを形成して細胞核内に収納されています。ヒストンのアセチル化はクロマチン構造を変化させることで、DNAの塩基配列に依存しない後成的な遺伝子制御を担っています。p300は主要なヒストンアセチル化酵素であり、多様なヒストンのアセチル化を介して特定の遺伝子の活性化を誘導することで、細胞機能の正常な維持に貢献しています。しかし、p300がどのようにヌクレオソームに結合して、クロマチンにおいてヒストンのアセチル化を触媒するのか、そのメカニズムは不明でした。
そこで本研究チームは、試験管内で再構成したヌクレオソームと、アセチル基転移活性中心を含むp300ドメイン(p300活性ドメイン)の複合体を調製し、クライオ電子顕微鏡によってその複合体構造群を明らかにしました。その結果、p300活性ドメインはヌクレオソーム上の様々なポジションに結合することが分かりました。この性質によって、p300の特徴であるヌクレオソーム中の多様なヒストンのアセチル化が可能となっていると考えられました。他のアセチル化酵素においては、これまでにヌクレオソーム上の定まった位置での結合様式が報告されています。本研究ではこのような結合様式とは異なった、p300独自の結合様式を明らかにすることができました。p300によるヒストンアセチル化の制御異常は、がんや神経変性を引き起こすことが知られています。本研究で得られた知見によって、疾患モデル細胞におけるp300の制御異常に関する理解が進み、これらの疾患の発症メカニズムの解明や治療方法の確立につながることが期待されます。
本研究は、国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「胡桃坂クロマチンアトラスプロジェクト」(研究総括:胡桃坂仁志、JPMJER1901)をはじめ、日本学術振興会(JSPS)の新学術領域研究「遺伝子制御の基盤となるクロマチンポテンシャル」(代表:胡桃坂仁志、JP18H05534)、「革新的なクロマチン基盤膜を用いたクライオ電子顕微鏡3次元構造解析」(代表:滝沢由政、JP19K06522)、「クロマチン上で起こる転写と共役した二重鎖切断修復の分子機構の解明」(代表:胡桃坂仁志、JP20H00449)、国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS)「エピジェネティクス研究と創薬のための再構成クロマチンの生産と性状解析」(代表:胡桃坂仁志、JP21am0101076)、および生命科学・創薬研究支援基盤事業(BINDS)「エピジェネティクスの基盤原理解明と創薬のためのヒストンおよび再構成クロマチンの生産」(代表:胡桃坂仁志、JP22ama121009)などの支援を受けて行われました。また、クライオ電子顕微鏡解析は、AMED BINDS(代表:吉川雅英、JP20am0101115)からの支援を受けて実施されました。