2022-06-21 理化学研究所
理化学研究所(理研)開拓研究本部岩崎RNAシステム生化学研究室の岩崎信太郎主任研究員、松浦絵里子研究員、眞貝細胞記憶研究室の眞貝洋一主任研究員、島津忠広専任研究員、生命機能科学研究センター翻訳構造解析研究チームの伊藤拓宏チームリーダーらの研究グループは、リボソーム[1]の構成因子であるリボソームタンパク質に起きる特異的な修飾を発見し、その修飾がリボソームの性能を決定する要因の一つであることを突き止めました。
本研究成果は、メッセンジャーRNA(mRNA)[2]の遺伝暗号を読み取ってタンパク質を合成する「翻訳」の根本的な理解やタンパク質の品質管理システムの理解に貢献すると期待できます。
リボソームタンパク質は多くの翻訳後修飾[3]を受けます。しかし、それらの修飾がリボソームの性能をどのように調節するのかはほとんど不明でした。
今回、研究グループは、ヒトの培養細胞を用いてヒスチジンメチル化酵素METTL18の基質を探索し、リボソームタンパク質RPL3にヒスチジンメチル化が起きることを発見しました。次に、細胞内の翻訳状態を網羅的に解析する手法であるリボソームプロファイリング[4]と試験管内の翻訳反応系を用いた解析から、RPL3のヒスチジンメチル化は、リボソームが特定のアミノ酸コドン[5]を読み取る速さを調節していることを突き止めました。さらに、この制御が合成されるタンパク質を高品質に保つために必要であることを明らかにしました。
本研究は、オンライン科学雑誌『eLife』(6月8日付)に掲載されました。
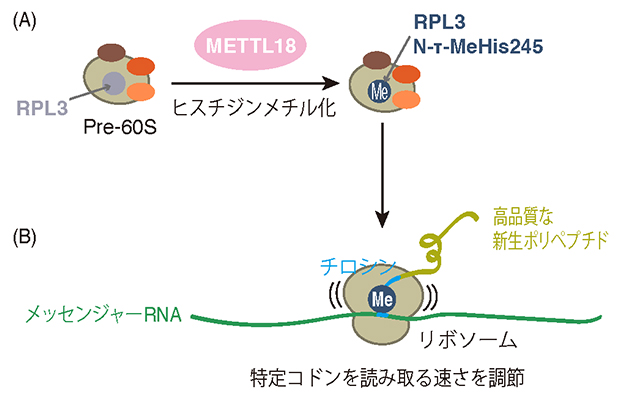
リボソームにおけるPRL3タンパク質のヒスチジンメチル化の役割
背景
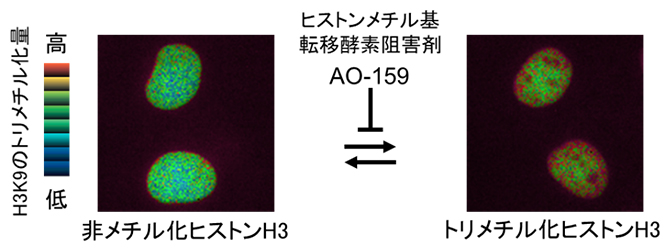
細胞内で翻訳されたタンパク質は、その後、さまざまな種類の化学的修飾を受けます。このような化学的修飾を「翻訳後修飾」と呼び、タンパク質の構造や細胞内局在、酵素活性、他の分子との相互作用など、タンパク質の機能を決める上で非常に重要な役割を果たします。翻訳後修飾の一種であるメチル化は、一般的にリジン残基およびアルギニン残基に起こりますが、近年の研究から、ヒスチジン残基にも起きることが分かってきました。これまで、ヒスチンジンメチル化修飾を受けるタンパク質は限定的であると考えられていましたが、最近の網羅的研究によって、これまで考えられていたよりも広範なタンパク質に起きていることが示されています。
ヒスチジンメチル化には、π-N位(π-N-メチルヒスチジン、または1-メチルヒスチジン)とτ-N位(τ-N-メチルヒスチジン、または3-メチルヒスチジン)の2種類があります。特にτ-N位についてはこれまでに、酵母のHpm1が唯一のτ-N位のメチル化酵素として報告されています。一方、ヒトにおいてはHpm1のホモログ[6]である「METTL18」が保存されていますが、METTL18の酵素活性や基質についての知見がなかったことから、τ-Nヒスチジンメチル化のヒトにおける生物学的機能は全く解明されていませんでした。
メッセンジャーRNA(mRNA)の遺伝暗号を読み取ってタンパク質を合成する過程である「翻訳」は、翻訳装置である「リボソーム」が担っています。リボソームは、約80個のリボソームタンパク質と4種類のリボソームRNA(rRNA)からなる超巨大複合体です。これまでリボソームタンパク質には、多くの翻訳後修飾が起きていることが分かっていましたが、その役割の解明は進んでいませんでした。
以上のような背景から、本研究ではヒト細胞を用いてMETTL18の基質を探索し、その基質が翻訳ならびに合成されるタンパク質に与える影響を調べました。
研究手法と成果
研究グループはまず、METTL18の基質探索のために、メチル基[7]供与体S-アデノシルメチオニン(SAM)の類似体であるプロパルギリックSe-アデノシル-L-セレノメチオニン(ProSeAM)と組換えMETTL18を用いて、METTL18ノックアウト細胞の抽出液に含まれるタンパク質を反応させました。ProSeAMは、メチル基の代わりにプロパルギル基[8]を標的タンパク質に付加します。その後、ビオチンアジドとのクリック反応[9]により、プロパルギル化の起きたタンパク質を標識し、濃縮後、質量分析[10]を行いました(図1)。
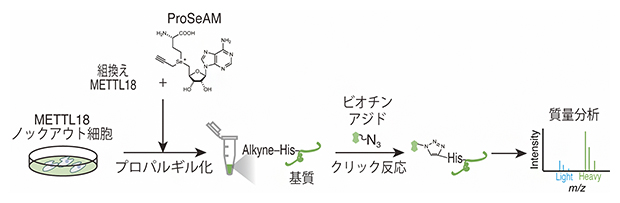
図1 METTL18基質探索の方法
まずMETTL18ノックアウト細胞の抽出液にProSeAMと組換えMETTL18を加え、標的タンパク質にプロパルギル基を付加する(プロパルギル化)。その後、ビオチンアジドとのクリック反応により、プロパルギル化の起きたタンパク質を標識し、濃縮後、質量分析を行う。
その結果、METTL18の基質として、リボソームタンパク質であるRPL3を同定しました。また、クライオ電子顕微鏡法[11]による構造解析によって、ヒスチジンメチル化RPL3がリボソームに取り込まれていること、またそれがMETTL18の欠損によって消失することも分かりました(図2)。
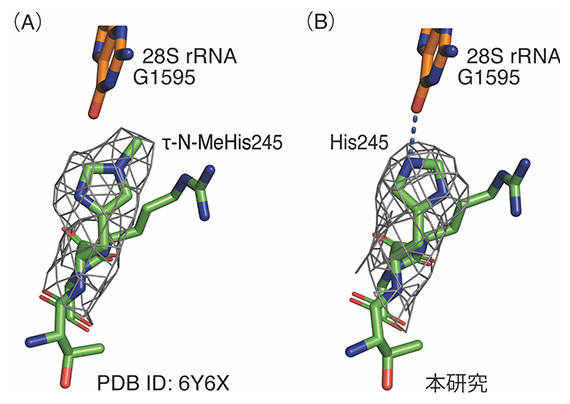
図2 RPL3メチル化部位のクライオ電子顕微鏡による構造解析
(A)野生型リボソームにおけるRPL3ヒスチジンメチル化部位の構造。
(B)METTL18ノックアウト細胞のリボソームにおけるRPL3ヒスチジンメチル化部位の構造。245番目のヒスチジン残基(His245)でのメチル化が消失している。
(E Matsuura-Suzuki, T Shimazu et al., eLife, 2022より引用)
次に、RPL3のヒスチジンメチル化がリボソームの翻訳活性に与える影響を調べました。リボソームプロファイリングと人工的な翻訳反応系を用いた実験から、RPL3のヒスチジンメチル化がない場合、リボソームはチロシンコドンでの翻訳を素早く行うことが分かりました。つまり、RPL3のヒスチジンメチル化は、リボソームがチロシンコドンを読み取る速さを抑制していることが示されました(図3)。
さらに、新生ポリペプチドの合成速度と品質の関係に着目して、研究を進めました。新生ポリペプチドは一般的に、リボソームで合成中に折り畳みが始まり、最終的に機能性を獲得します。リボソームがあまりに合成を速くし過ぎてしまうと、新生ポリペプチドの折り畳みに必要な時間が得られず、十分な機能を持ったタンパク質が合成されないと考えられています。また、そのような不良タンパク質は細胞内で凝集して、細胞毒性を示すことが知られています。
そこで、RPL3のヒスチジンメチル化によるコドン読み取り速度の抑制が新生ポリペプチドの折り畳みに影響を及ぼすかを調べました。細胞毒性の評価や細胞内の凝集タンパク質の同定・解析を行った結果、RPL3のヒスチジンメチル化のない細胞では、野生型と比較して著しい細胞毒性が検出され、チロシン残基を多く含むタンパク質が細胞内凝集体に濃縮してしまうことが分かりました。
これらの結果から、RPL3のヒスチジンメチル化はチロシンコドンでの翻訳の速さを調節して、新生ポリペプチドの品質を制御していると考えられます(図3)。
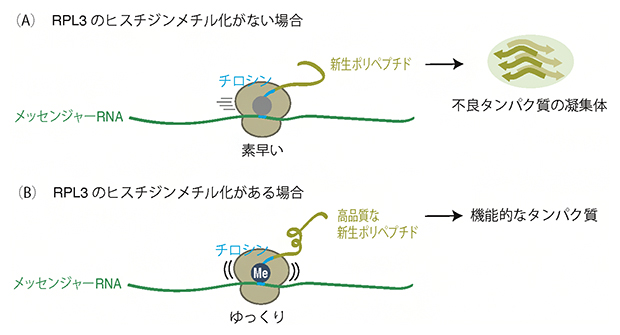
図3 RPL3のヒスチジンメチル化が新生ペプチドの合成と品質に与える影響
(A)RPL3のヒスチジンメチル化がない場合、リボソームは素早くチロシンコドンを読み取る。合成された新生ポリペプチドは品質が悪く、細胞内で凝集体を形成する。
(B)RPL3のヒスチジンメチル化がある場合、リボソームはゆっくりチロシンコドンを読み取る。合成された新生ポリペプチドは適切に折り畳まれ、機能的である。
今後の期待
本研究では、METTL18によるRPL3のヒスチジンメチル化を同定しました。そして、RPL3のヒスチジンメチル化はリボソームの性能(=チロシンコドンを読み取る速さ)を制御することを見いだし、その制御はタンパク質の品質管理に必要であることを明らかにしました。
がん細胞や神経変性疾患では、翻訳の異常な活性化や不活性化が起きています。また、一部のがん細胞ではMETTL18の発現異常も報告されています。従って、本研究で得られた基礎的な知見は、がんや神経変性の発症機構の理解につながると期待できます。
補足説明
1.リボソーム
リボソームRNA(rRNA)とリボソームタンパク質から構成される超巨大複合体。リボソームはメッセンジャーRNA(mRNA)にコードされているコドンを読み取り、タンパク質を合成する。
2.メッセンジャーRNA(mRNA)
タンパク質のアミノ酸の並び方の情報(コドン)を持つRNAである。リボソームによってそのコドンが読み取られ、タンパク質が合成される。
3.翻訳後修飾
タンパク質が生合成された後(翻訳後)に,タンパク質へ付加されるさまざまな修飾のこと。リン酸化、アセチル化、メチル化、糖鎖付加などが知られている。
4.リボソームプロファイリング
組織からリボソームを抽出し、リボソームと結合しているRNA配列を同定することで、どの遺伝子がどの程度の効率で翻訳されているかを知る解析法。リボソームは大きな複合体であるため、一定のmRNA領域を覆うように結合する。これらのリボソームとmRNAの複合体に対してRNA分解酵素で処理するとリボソームが保護するmRNA断片だけが分解されずに回収される。
5.コドン
タンパク質の中のアミノ酸の並び方は、そのタンパク質の遺伝子(DNA)の中の塩基配列に対応している。三つの塩基がひとまとまりになって一つのアミノ酸に対応しており、この3塩基の並びをコドンと呼ぶ。
6.ホモログ
相同遺伝子。進化系統上で同一の祖先から派生した、類似性の高い遺伝子。
7.メチル基
有機化学において、-CH3と表される最も分子量の小さいアルキル置換基。
8.プロパルギル基
-CH2C≡CHで表される炭素間三重結合を持つ炭化水素基。
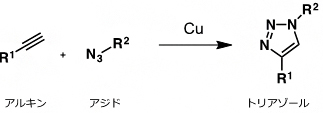
9.クリック反応
シートベルトをカチッとつなげるように、狙い通りに、2分子を連結させるための合成反応の総称。生体のようにさまざまな分子が存在する水中において、室温でも進行する反応が有用であり注目を集めている。その代表的な反応が、銅触媒存在下、アジドとアルキンを用いるトリアゾール形成反応である。本研究では、ProSeAMにより修飾を受けたタンパク質に対して、ビオチンを導入するために用いている。
10.質量分析
物質を原子・分子レベルの微細なイオンにし、その質量数と数を測定することで物質の同定や定量を行う。
11.クライオ電子顕微鏡法
生体試料を液体エタンにより急速凍結し、ガラス状の氷に閉じ込め、透過型電子顕微鏡を用いて直接観察する手法。画像処理技術を駆使することで、リボソームなどの超分子複合体やタンパク質複合体の三次元立体構造を得られる。
研究グループ
理化学研究所
開拓研究本部
岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎(イワサキ・シンタロウ)
研究員 松浦 絵里子(マツウラ・エリコ)
眞貝細胞記憶研究室
主任研究員 眞貝 洋一(シンカイ・ヨウイチ)
専任研究員 島津 忠広(シマヅ・タダヒロ)
テクニカルスタッフⅠ(研究当時) 事柴 芳(コトシバ・カオル)
袖岡有機合成化学研究室
主任研究員 袖岡 幹子(ソデオカ・ミキコ)
(環境資源科学研究センター 触媒・融合研究グルーブ グループディレクター)
テクニカルスタッフⅠ 赤壁 麻依(アカカベ・マイ)
(環境資源科学研究センター 触媒・融合研究グルーブ テクニカルスタッフⅠ)
専任研究員 五月女 宜裕(ソウトメ・ヨシヒロ)
(環境資源科学研究センター 触媒・融合研究グルーブ 専任研究員)
生命機能科学研究センター 翻訳構造解析研究チーム
チームリーダー 伊藤 拓宏(イトウ・タクヒロ)
研究員 柏木 一宏(カシワギ・カズヒロ)
技師 髙橋 真梨(タカハシ・マリ)
環境資源科学研究センター 生命分子解析ユニット
ユニットリーダー 堂前 直(ドウマエ・ナオシ)
専任技師 鈴木 健裕(スズキ・タケヒロ)
研究支援
本研究は、文部科学省科学研究費助成事業学術変革領域研究(B)「新規Disome-Seq法: パラメトリックなリボソーム渋滞の網羅的探索(研究代表者:岩崎信太郎)」、日本学術振興会(JSPS)科学研究費助成事業若手研究(A)「翻訳開始因子パラログによる選択的翻訳の網羅的解析(研究代表者:岩崎信太郎)」、同挑戦的研究(萌芽)「重力による翻訳制御の網羅的解析(研究代表者:岩崎信太郎)」、同基盤研究(A)「ヒストンH3K9メチル化修飾による転写抑制の包括的理解(研究代表者:眞貝洋一)」、新学術領域研究(研究領域提案型)「細胞分化にともなうクロマチンポテンシャルの変化とその分子基盤(研究代表者:眞貝洋一)」、同基盤研究(B)「複合体間の動的な相互作用による翻訳制御の構造基盤(研究代表者:伊藤拓宏」、同基盤研究(C)「タンパク質ヒスチジンメチル化の理解(研究代表者:島津忠広)」「リボソームタンパク質の希少修飾ヒスチジンメチル化を介した新規翻訳制御機構の解明(研究代表者:松浦絵里子)」、理化学研究所運営費交付金(組織横断連携プロジェクト「ライフサイエンスの横断的取組による超高齢社会課題解決への貢献」、RIKEN Pioneering Projects「Biology of Intracellular Environments(研究分担者:岩崎信太郎、伊藤拓宏)」「Genome building from TADs(研究分担者:眞貝洋一)」、BDR Structural Cell Biology Project(伊藤拓宏)、奨励課題(松浦絵里子)、『連携のタネ』ファンド(松浦絵里子))による支援を受けて行われました。
原論文情報
Eriko Matsuura-Suzuki, Tadahiro Shimazu, Mari Takahashi, Kaoru Kotoshiba, Takehiro Suzuki, Kazuhiro Kashiwagi, Yoshihiro Sohtome, Mai Akakabe, Mikiko Sodeoka, Naoshi Dohmae, Takuhiro Ito, Yoichi Shinkai, Shintaro Iwasaki, “METTL18-mediated histidine methylation of RPL3 modulates translation elongation for proteostasis maintenance”, eLife, 10.7554/eLife.72780
発表者
理化学研究所
開拓研究本部 岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎(イワサキ・シンタロウ)
研究員 松浦 絵里子(マツウラ・エリコ)
眞貝細胞記憶研究室
主任研究員 眞貝 洋一(シンカイ・ヨウイチ)
専任研究員 島津 忠広(シマヅ・タダヒロ)
生命機能科学研究センター 翻訳構造解析研究チーム
チームリーダー 伊藤 拓宏(イトウ・タクヒロ)
報道担当
理化学研究所 広報室 報道担当