2022-07-26 理化学研究所
理化学研究所(理研)生命機能科学研究センター栄養応答研究チームの小坂元陽奈基礎科学特別研究員、小幡史明チームリーダーらの共同研究グループは、三大栄養素の一つであるタンパク質の欠乏を細胞が感知し、個体レベルで栄養不良に適応する新たな分子機構を発見しました。
本研究成果は、栄養欠乏に応答する生命の基本的な仕組みの解明に貢献し、細胞の栄養感知異常や個体の摂食障害による疾患メカニズムの理解、寿命延長効果をもたらす栄養シグナル制御手法への応用が期待できます。
今回、共同研究グループは、栄養学や遺伝学のモデルとして使われるショウジョウバエ[1]の幼虫を用いて、食餌中のタンパク質欠乏を感知する機構とそれに対する適応機構を解析しました。その結果、「非必須(可欠)アミノ酸[2]」の一つであるチロシンの量の低下がタンパク質欠乏を感知する機構であることを見いだしました。さらに、チロシンはタンパク質合成(翻訳)[3]の抑制や摂食量の増加を誘導することで、栄養欠乏に対する適応応答を起こすことが分かりました。この結果は、必ずしも食餌から摂る必要のないとされるチロシンが、個体の栄養状態を感知し適応するために必須(不可欠)であることを示しており、これまでの栄養感知機構の定説を覆す新発見です。
本研究は、科学雑誌『Nature Metabolism』オンライン版(7月25日付:日本時間7月26日)に掲載されました。
背景
ヒトを含めほとんどの動物は、食事(餌)からの栄養吸収に依存して生命活動を維持しています。特に、三大栄養素の一つであるタンパク質は身体の構築に欠かせない原料であり、タンパク質不足を感知することは生物が栄養環境を認識して生き残るために重要です。タンパク質摂取が制限される(タンパク質制限)と、細胞はエネルギー消費を抑制する「飢餓応答」を引き起こし、栄養不良に適応(「栄養欠乏適応」)しようとします。特に、細胞内のタンパク質合成(翻訳)は大量のエネルギーを消費する反応であるため、翻訳抑制は典型的な栄養欠乏適応の一つです。
タンパク質は20種類のアミノ酸から構成されており、食餌中のタンパク質は消化の働きで最終的にアミノ酸に分解されます。生体内ではタンパク質が欠乏すると、これらの20種類のアミノ酸を感知する「アミノ酸センシング機構[4]」が発動し、栄養欠乏適応のための分子応答(栄養欠乏応答)を引き起こすと考えられています。タンパク質制限による飢餓応答は、実際には20種類のアミノ酸がそれぞれ異なる栄養シグナルを誘導した結果が合わさったものであると考えられています。また、アミノ酸ごとに欠乏の影響を受けやすい臓器も異なります。従って、生物の身体の中では、臓器同士の協調によってうまく環境適応する戦略をとっているはずです。
しかし、これまで行われた栄養感知の研究は培養細胞を用いた実験系がほとんどで、どのアミノ酸が、どの臓器に、どのようなセンシング機構を介して、栄養飢餓シグナルを誘導し、個体としての生存を支えているのかは明らかになっていませんでした。中でも、体内での生合成が十分可能とされている「非必須アミノ酸」は、食餌からの摂取に依存する「必須アミノ酸[2]」と比べてその必要性は見過ごされており、生体にもたらす効果とそのメカニズムの解明は立ち遅れていました。
そこで本研究では、栄養学や遺伝学のモデルとして使われるショウジョウバエの幼虫を用いて、食餌中のタンパク質欠乏を感知する機構と、それに対する適応機構を解析しました。
研究手法と成果
共同研究グループはまず、ショウジョウバエ幼虫の食餌中タンパク質を制限しました(低タンパク質餌)。その結果、主要な代謝組織である脂肪組織で栄養欠乏応答が起こることを見いだしました。特に、タンパク質合成(翻訳)は猛スピードで成長中の幼虫にとって必要なプロセスですが、タンパク質制限中の脂肪組織においては、このタンパク質合成が大きく抑制されていました。このメカニズムを解析したところ、転写因子ATF4[4]によって発現誘導されるタンパク質合成抑制遺伝子4E-BP [5]の発現が上昇していることを見いだしました。
転写因子ATF4は、飢餓をはじめさまざまなストレス応答のマスター制御因子であり、4E-BP遺伝子のほかにも適応応答に必要な複数の遺伝子の発現を誘導することが知られています。これまで培養細胞を用いた実験により、ATF4の活性化にはアミノ酸の欠乏を感知するセンサーであるタンパク質リン酸化酵素のGCN2[4]が関与することが明らかになっていました。GCN2は、20種類のアミノ酸のいずれかが欠乏すると、その種類にかかわらず活性化することが知られています。
低タンパク質餌を摂食中のショウジョウバエ幼虫においても、体内で多くのアミノ酸の量が低下したため、GCN2を介してATF4が活性化し、タンパク質制限応答を誘導している可能性が考えられました。しかし、驚くべきことに、GCN2の機能を遺伝学的に欠損した変異体でも、依然としてタンパク質制限応答が見られることが分かりました。この結果から、ショウジョウバエ生体内では、GCN2に依存しない新たな栄養感知機構があると予想されました。
以上の結果から、タンパク質制限応答は既存の経路とは異なるATF4活性制御様式で担われている可能性が考えられました。そこで、アミノ酸量の全体的な低下ではなく、20種類のアミノ酸のどれかを選択的に感知するような機構の存在を想定し、低タンパク質餌に一つずつアミノ酸を加える実験を行いました。すると興味深いことに、チロシンもしくはその前駆体のフェニルアラニンのみが、脂肪組織のタンパク質制限応答を抑制することが分かりました。チロシンはフェニルアラニンから体内で作られるため、必ずしも食餌から摂る必要のない非必須(可欠)アミノ酸として知られています。
しかしこの結果から、脂肪組織はアミノ酸の全体量や必須アミノ酸の量ではなく、単一の「非必須」アミノ酸であるチロシンの体内量を敏感に感知することで、栄養状態を把握していることが分かりました。さらなる栄養操作実験の結果、実はショウジョウバエ個体(幼虫)はチロシンだけがない(他のアミノ酸は十分ある)餌に対しても、強い栄養欠乏応答を起こすことが分かりました(図1)。これは、非必須であるチロシンが生合成だけでは十分賄いきれない栄養素であることを示しており、これまでの定説を覆す現象です。
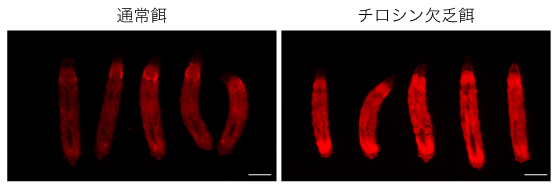
図1 食餌中のチロシン欠乏によるショウジョウバエ幼虫での栄養欠乏応答
ストレス応答のマスター制御因子ATF4により誘導されるタンパク質合成抑制遺伝子4E-BPの発現を、赤色蛍光タンパク質をレポーターとする遺伝子組換え体により観察した。他のアミノ酸を十分与えていても、食餌中のチロシンが欠乏するとショウジョウバエの幼虫は強い栄養欠乏応答を示す(右)。スケールバーは1ミリメートル。
次に、チロシン欠乏の感知により生じる個体の適応応答を詳細に調べました。まず、ATF4を介したチロシン欠乏感知は、翻訳抑制の他に、細胞の成長をつかさどるmTORシグナル[6]も抑制することが分かりました。このmTORシグナルの制御機構は、ATF4によって発現が誘導されるscylla(scyl)[7]という遺伝子を介する、これまでに知られていない経路によるものでした。mTORシグナルは通常、必須アミノ酸であるロイシンやメチオニンを介して活性化することが知られていますが、今回発見したチロシンによる制御は、ロイシンによって起こる制御とは独立であることも分かりました。
また一方で、個体としては栄養価の低い餌を食べているときには、質の悪さを量でカバーしようと摂食量が増加します。今回の研究から、このような摂食量を増大させるという仕組みも、チロシン感知により起こることが分かりました。チロシン欠乏を感知した脂肪組織は、内分泌ホルモンであるCNMアミド(CNMa)[8]を分泌するようになり、これが脳に到達して摂食をつかさどるセロトニン神経系[9]を刺激することで、摂食量を増やすようにしていることが示唆されました(図2)。
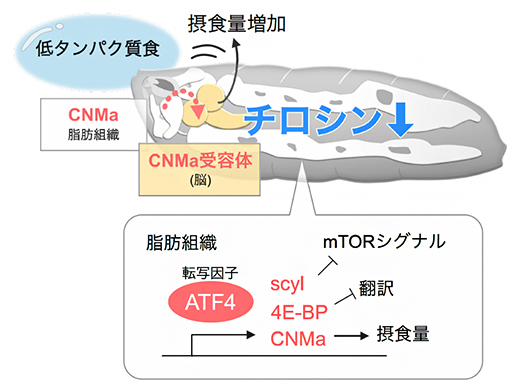
図2 チロシンセンシングの模式図
ショウジョウバエの幼虫にタンパク質を制限した餌(低タンパク質餌)を与えると、脂肪組織のタンパク質合成(翻訳)の低下やmTORシグナルの抑制、摂食量の増加が引き起こされる。これは、タンパク質摂取量の減少に伴う体内チロシン量の低下によって、脂肪組織で転写因子ATF4が活性化することで、種々の遺伝子が発現誘導されることによる。内分泌ホルモンCNMaは脂肪組織外に分泌され、脳で受容されて摂食量の増加を引き起こす。
今後の期待
細胞が自らの栄養状態を感知し適応することは、個体の恒常性を維持する重要な機構の一つです。基礎研究分野では、主に特定の必須アミノ酸の欠乏を感知するメカニズムの研究が盛んに行われてきました。しかし、観察された現象が培養細胞だけでなく実際の動物個体内で、アミノ酸の組織分布や動態、代謝の影響を受けてもなお成立する応答であるかは十分に検証されていません。
本研究では、ショウジョウバエ個体での解析を主体とすることで、これまで知られていなかった非必須アミノ酸チロシンを介した栄養応答機構が明らかとなりました。これは、生理的な条件における「非必須アミノ酸の必須な機能」を浮かび上がらせたという意味で、従来の定説を覆す発見といえます。また、細胞の栄養感知異常や個体の摂食障害による疾患メカニズムの理解にも貢献すると期待できます。
近年、タンパク質、あるいは特定アミノ酸の摂取制限が、健康寿命の延長やがんの抑制に効果的であることが報告されています。しかし、アミノ酸は生存に欠かせないため、食餌からしか供給されない必須アミノ酸の過剰な摂取制限は、逆に体への悪影響が出る可能性があります。一方で、非必須アミノ酸であるチロシンは常に体内量の半分程度を生合成で確保できるため、食餌制限による悪影響が出にくいという利点があります。今後、哺乳類やヒトでの検証が進めば、チロシン摂取量の増減により栄養シグナルを操ることで、健康増進がかなうかもしれません。さらに、チロシンセンシング機構を創薬の標的とすることで、食餌制限なしに栄養シグナルを制御する手法を確立できる可能性もあります。
補足説明
1.ショウジョウバエ
ショウジョウバエは、体長2~3mm前後の大きさで、飼育が容易であり、遺伝学的な解析に優れていることから、さまざまな研究分野でモデル生物として用いられている。
2.非必須(可欠)アミノ酸、必須アミノ酸
タンパク質を構成する20種類のアミノ酸のうち、動物が合成できないアミノ酸を必須アミノ酸と呼び、ヒトではフェニルアラニンなど9種類、ショウジョウバエではヒトの必須アミノ酸にアルギニンを加えた10種類である。これに対して、食餌から摂取しなくても炭水化物や必須アミノ酸から合成できるアミノ酸を非必須(可欠)アミノ酸と呼ぶ。
3.タンパク質合成(翻訳)
mRNAの情報を基にリボソームでタンパク質を合成する反応。タンパク質の材料となるアミノ酸の生合成まで含めると、全体として非常に多くのエネルギーを消費する過程であり、さまざまなストレスにさらされた細胞はまず翻訳を抑制しようとする。
4.アミノ酸センシング機構、ATF4、GCN2
細胞がアミノ酸飢餓状態を感知する仕組みをアミノ酸センシング機構と呼ぶ。GCN2は、アミノ酸欠乏を感知するセンサーとして機能するタンパク質リン酸化酵素。ATF4は、GCN2の活性化により翻訳が促進される転写因子。GCN2とATF4を介したアミノ酸センシング機構は多くの動物で共通している。GCN2はGeneral control nonderepressible 2の略、ATF4はActivating transcription factor 4の略。
5.4E-BP
タンパク質の合成(翻訳)を開始する際に協調的に働く翻訳開始因子に結合し、翻訳を抑制するタンパク質をコードする遺伝子。4E-BPはEukaryotic translation initiation factor 4E-binding proteinの略。
6.mTORシグナル
タンパク質リン酸化酵素mTORを介したシグナル伝達経路。mTORは、栄養や増殖因子などの刺激に反応して、S6キナーゼや4E-BPなどのタンパク質をリン酸化し、細胞応答を制御する機能を持つ。mTORはmechanistic target of rapamycinの略。
7.scylla(scyl)
mTORシグナルを不活性化することで、細胞成長を抑制するタンパク質をコードする遺伝子。低酸素環境で活性化することが既に知られていた。
8.CNMアミド(CNMa)
体液中に放出され、脳にある受容体(CNMamide receptor)に受容されて摂食を制御する神経ペプチド。ショウジョウバエ成虫の腸から分泌され、必須アミノ酸への嗜好性をつかさどることが2021年に明らかにされた(Kim et al. Nature 593(7860): 570-574, 2021)。
9.セロトニン神経系
セロトニンを伝達物質として用いる神経細胞群とその標的細胞の受容体からなる神経系。セロトニン神経系は摂食や性行動、成長、認知機能などを制御することが知られる。中枢神経系と、咽頭から腸にかけて伸びる腸管神経系とを構成するセロトニン神経系にCNMaの受容体が発現している。
共同研究グループ
理化学研究所 生命機能科学研究センター 栄養応答研究チーム
基礎科学特別研究員 小坂元 陽奈(コサカモト・ヒナ)
チームリーダー 小幡 史明(オバタ・フミアキ)
(京都大学 大学院生命科学研究科 客員准教授)
東京大学 大学院薬学系研究科
教授 三浦 正幸(ミウラ・マサユキ)
大学院生 相川 英(アイカワ・ヒデ)
筑波大学 生存ダイナミクス研究センター
教授 丹羽 隆介(ニワ・リュウスケ)
助教 岡本 直樹(オカモト・ナオキ)
慶應義塾大学 医学部 医化学研究室
教授 末松 誠(スエマツ・マコト)
講師 杉浦 悠毅(スギウラ・ユウキ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、主に日本医療研究開発機構(AMED)健康・医療の向上に向けた早期ライフステージにおける生命現象の解明「発生期環境による寿命制御機構の解明(研究代表者:小幡史明)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(B)「神経の栄養プログラミング機構の解明(研究代表者:小幡史明)」の支援により行われました。また、AMEDの微生物叢と宿主の相互作用・共生の理解と、それに基づく疾患発症のメカニズム解明「腸内細菌により駆動される成人病胎児起源説DOHaDの分子機構解明(研究代表者:小幡史明)」、老化メカニズムの解明・制御プロジェクト「老化機構・制御研究拠点(研究代表者:原英二)」、および日本学術振興会(JSPS)科学研究費助成事業学術変革領域研究(B)「革新的多重イメージングによる組織複雑化過程の可視化(研究代表者:小幡史明)」、同基盤研究(B)「排出を起点とした代謝恒常性制御機構の遺伝学的解析(研究代表者:小幡史明)」、同基盤研究(S)「細胞死を起点とした細胞外コミュニケーションの発動と生理機能(研究代表者:三浦正幸)」、同基盤研究(A)「個体ごとの表現型を決める非細胞死カスパーゼ活性化機構の解明(研究代表者:三浦正幸)」、同挑戦的研究(萌芽)「遺伝情報を拡大する翻訳時のタンパク質多様性産生のメカニズムと生理機能(研究代表者:三浦正幸)」からの支援を受けました。また、上原記念生命科学財団、日本分子生物学会富澤基金による若手研究助成、筑波大学生存ダイナミクス研究センターTARAプロジェクトの支援を受けて行いました。
原論文情報
Hina Kosakamoto, Naoki Okamoto, Hide Aikawa, Yuki Sugiura, Makoto Suematsu, Ryusuke Niwa, Masayuki Miura, and Fumiaki Obata, “Sensing of the non-essential amino acid tyrosine governs the response to protein restriction in Drosophila”, Nature Metabolism, 10.1038/s42255-022-00608-7
発表者
理化学研究所
生命機能科学研究センター 栄養応答研究チーム
基礎科学特別研究員 小坂元 陽奈(コサカモト・ヒナ)
チームリーダー 小幡 史明(オバタ・フミアキ)
報道担当
理化学研究所 広報室 報道担当