2023-03-14 理化学研究所
理化学研究所(理研)脳神経科学研究センター タンパク質構造疾患研究チームの遠藤 良 研究員、田中 元雅 チームリーダーらの共同研究チームは、神経細胞内で翻訳途中のリボソーム[1]におけるタンパク質の品質管理の破綻が、発達障害などの神経疾患を引き起こす機構を分子レベルで解明しました。
本研究成果は、認知障害や発達障害をはじめとする幅広い神経疾患の発症機構の解明につながる可能性があります。さらに、神経細胞における翻訳制御機構を標的とした、新たなバイオマーカーや治療法の開発に貢献すると期待できます。
今回、共同研究チームは培養神経細胞とマウスを用いて、翻訳途中のリボソームにおけるタンパク質の品質管理が破綻すると、神経細胞はTTC3というタンパク質の量を増やし、翻訳開始[2]を抑制することで、合成が途中で止まった異常なタンパク質(アレスト産物)の蓄積を防いでいることを明らかにしました。一方、TTC3が翻訳開始を抑制すると、神経細胞の発達が妨げられ、認知障害および発達障害が引き起こされることも分かりました。すなわち、神経細胞には翻訳途中に異常が起きた際、自身を守る防御機構が存在するものの、その代償として神経細胞の発達に異常が生じ、それが神経疾患につながることを示しました。
本研究は、科学雑誌『Proceedings of the National Academy of Sciences(PNAS)』オンライン版(3月13日付:日本時間3月14日)に掲載されました。
神経細胞内でのリボソーム品質管理機構(RQC)の破綻によるTTC3の蓄積と認知障害・発達障害
背景
細胞内では、リボソームがメッセンジャーRNA(mRNA)の遺伝子情報を基に新しいタンパク質を合成(翻訳)します。翻訳の制御が正常でなくなると、異常なタンパク質が産生・蓄積され、さまざまな疾患の原因となります。しかし、細胞には異常なタンパク質の産生を防ぐ、あるいは取り除く、さまざまな防御機構(タンパク質の品質管理機構)が備わっています。
翻訳の途中で異常が起きると、リボソームはmRNA上で停止します。この際、リボソームには途中まで合成されたタンパク質が残ってしまいます。このようなタンパク質は凝集しやすく細胞にとって有害になるため、速やかに除去される必要があります。このような停止したリボソーム上に残ったタンパク質の分解と除去を担っているのが、「リボソーム品質管理機構(RQC)」といわれるものです。
これまでにRQCの研究は、世界中で主に酵母細胞や哺乳類動物の分裂細胞を使って行われ、RQCに関わるさまざまな因子が報告されています。例えば、Ltn1というタンパク質は、リボソーム上に残った不完全なタンパク質に複数のユビキチン[3]と呼ばれるシグナルを付加し、プロテアソーム[4]による分解へと誘導します。一方で、RQC機能の破綻は神経疾患の原因となることが示唆されていました。
しかし、神経細胞でRQCがどのように機能しているのか、さらにはその機能不全がどのようにして神経疾患を引き起こすかは、技術的な制約や実験系を構築する難しさから、ほとんど分かっていませんでした。
研究手法と成果
共同研究チームは、神経細胞内でのRQCの機能および神経疾患との関連を解明するために、RQCの主要因子の一つであるLtn1を欠損させ、RQC機能を喪失させたLtn1ノックアウト(KO)マウスを作製しました。Ltn1-KOマウス由来の神経細胞(Ltn1-KO神経細胞)を用いて、まずはRQCの機能を失った神経細胞内でのタンパク質の変動を定量的プロテオミクス解析[5]によって網羅的に調べました。その結果、Ltn1-KO神経細胞では、TTC3というタンパク質とタンパク質の翻訳後修飾[6]の一つであるUFM1化[7](タンパク質にUFM1を付加する)に関与するタンパク質群が著しく増加していることが明らかになりました(図1)。
図1 Ltn1-KO神経細胞で上昇しているTTC3およびUFM1化タンパク質
ウェスタンブロッティングによって、Ltn1-WT(野生型)神経細胞とLtn1-KO神経細胞内のTTC3タンパク質(左)、UFM1化タンパク質(右)を検出した。それぞれの右側にあるグラフはWTに対するKOでの相対的なタンパク質量を示す。Ltn1-KO神経細胞内では、どちらのタンパク質も著しく増加していた。
次に、RQCの機能不全によって蓄積するTTC3の神経細胞内での局在を解析したところ、TTC3は主に小胞体に結合したリボソームのうち、40Sサブユニットに多く局在していることを明らかにしました。このことは、TTC3は神経細胞内でmRNAの翻訳、特に翻訳開始に関与している可能性を示しています。さらに、TTC3とUFM1化との関連を調べるために、Ltn1-KO神経細胞内でUFM1化タンパク質をノックダウン[8]することによって発現を抑制したところ、TTC3の量が著しく低下したことから、UFM1化はTTC3の量を安定化していることが示唆されました。
TTC3の神経細胞内での機能、特にRQCへの関与を調べるために、人為的にリボソームを翻訳途中で停止させる配列を含む遺伝子を神経細胞に発現させ、合成が途中で止まったタンパク質(アレスト産物)の検出を試みました。その結果、Ltn1-KO神経細胞では、予想通りにアレスト産物を分解・除去できず、アレスト産物の蓄積が見られました。次に、Ltn1-KO神経細胞内でTTC3の発現を抑制すると、アレスト産物のさらなる蓄積が見られたことから、TTC3はRQCが機能しないときにアレスト産物のさらなる蓄積を防いでいることが明らかになりました。
そのメカニズムとして、TTC3が翻訳開始を抑制している可能性が考えられることから、リボソームプロファイリング[9]によって翻訳開始の変化を解析したところ、Ltn1-KO神経細胞では翻訳開始が抑制されていることが明らかになりました。さらに、TTC3の発現を低下させると、Ltn1-KO神経細胞で見られた翻訳開始の抑制は解除されました。このことは、Ltn1-KO神経細胞において異常に増加したTTC3は翻訳開始を抑制することで、アレスト産物のさらなる蓄積を防いでいることを示しています。
次に、Ltn1-KO神経細胞の形態を観察したところ、樹状突起の長さが短く、神経細胞の発達が遅れていることが分かりました。この神経細胞の発達不全にTTC3が関与するかを調べるため、TTC3をノックダウンしたところ、Ltn1-KO神経細胞で見られた発達不全は回復しました(図2)。この結果は、Ltn1を欠損することで異常に蓄積するTTC3は神経細胞の発達を阻害することを示しています。
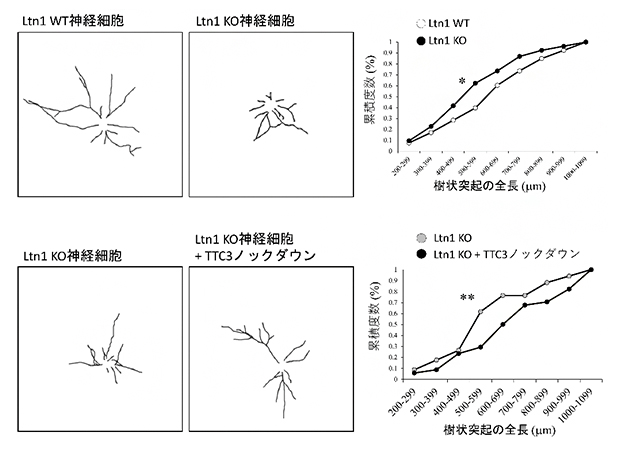
図2 Ltn1-KO神経細胞で蓄積するTTC3と神経突起の成長の関係
神経細胞の樹状突起を染色(左図)し、その全長を計測した(右グラフ)。
上:Ltn1-KO神経細胞では、樹状突起の全長がLtn1-WT(野生型)神経細胞と比較して短く、発達不全が見られる。
下:Ltn1-KO神経細胞でTTC3をノックダウンすると、樹状突起の発達不全が回復した。
最後に、Ltn1-KOマウスで神経疾患に関連した行動異常が見られるかを、さまざまな行動解析によって調べました。その結果、Ltn1-KOマウスは発達障害の一種である自閉スペクトラム症[10]や認知障害に関連した行動異常を示しました。一方で、Ltn1-KOマウスは運動機能に異常は見られず、神経細胞死も認められませんでした。このことから、Ltn1-KOマウスでは神経変性は起きておらず、認知障害・発達障害を呈していることが示されました。次に、これらの行動異常にTTC3が寄与しているかを、Ltn1-KOマウスの内側前頭前皮質でTTC3をノックダウンして検証したところ、行動異常の一部は優位に回復しました。
これらの結果から、神経細胞内でRQCの機能が破綻すると、神経細胞はTTC3の量を著しく増やし、不完全なタンパク質のさらなる蓄積を抑制することで自身を保護している一方、神経の成長を遅らせて認知障害や発達障害を起こすことが明らかになりました。
今後の期待
近年、神経細胞内でのタンパク質の品質管理および翻訳制御は脳の高次機能に重要であることが示されています。今回、翻訳途中のタンパク質の品質管理の破綻がTTC3の発現とタンパク質翻訳後修飾の一つであるUFM1化の異常な亢進を引き起こし、認知障害や発達障害に関与することを見いだしました。
この結果は、認知症や発達障害を含む幅広い神経疾患の発症機構の解明につながる可能性があります。さらに、これらの疾患に対して、神経細胞でのTTC3およびUFM1化を標的とした新たなバイオマーカーや治療法の開発にもつながると期待できます。
補足説明
1.リボソーム
mRNAの遺伝情報からタンパク質を合成する巨大なタンパク質・RNAの複合体。真核生物では、40Sの小サブユニットと60Sの大サブユニットからなる。
2.翻訳開始
遺伝子の情報を持つmRNA、翻訳の最初のアミノ酸を提供するMet-tRNA、翻訳反応を進行させるリボソームの三者が会合し、タンパク質の合成を開始させるまでの過程。
3.ユビキチン
76個のアミノ酸からなるタンパク質であり、基質となるタンパク質に結合することでさまざまな生命現象に関わる。基質タンパク質に複数のユビキチンが結合(ポリユビキチン化)すると、基質タンパク質は分解される。
4.プロテアソーム
ユビキチンが付加されたタンパク質を選択的に分解する巨大な酵素複合体。細胞内のタンパク質恒常性の維持に重要な役割を担っている。
5.定量的プロテオミクス解析
細胞や組織内で発現しているタンパク質やペプチドを標識し、網羅的に解析することで、サンプル間におけるタンパク質の量を比較する実験手法。
6.翻訳後修飾
タンパク質が合成された後に糖鎖、リン酸またはポリペプチドなどが付加されること。翻訳後修飾はタンパク質の構造や活性に影響を与える。
7.UFM1化
タンパク質の翻訳後修飾の一つで、英語ではUFMylationという。タンパク質のユビキチン化に似ており、UFM1化ではユビキチンの代わりにUFM1が基質タンパク質へと付加される。近年発見された翻訳後修飾であり、その基質タンパク質および機能に関してはいまだに未解明な部分が多い。
8.ノックダウン
特定のDNAの遺伝子情報を基にRNAへの変換過程を阻害することで、その遺伝子の機能を大きく減弱させること。
9.リボソームプロファイリング
細胞や組織からリボソームを単離し、リボソーム内に取り込まれて翻訳されている最中にあるmRNAの配列を次世代シーケンサーで解析することにより、実際に翻訳されているmRNAを網羅的かつ定量的に調べる手法。
10.自閉スペクトラム症
発達障害の一種であり、社会性やコミュニケーションの難しさや特定の関心事に強いこだわりを見せるなどの特徴を持つ。
共同研究チーム
理化学研究所 脳科学研究センター タンパク質構造疾患研究チーム
研究員 遠藤 良(エンドウ リョウ)
研究員(研究当時)Yi-Kai Chen(イーカイ・チェン)
テクニカルスタッフⅠ John Burke(ジョン・バーク)
テクニカルスタッフⅠ 高嶋 紀子(タカシマ ノリコ)
国際プログラム・アソシエイト Nayan Suryawanshi(ナヤン・スーリャワンシー)
研究員(研究当時)Kelvin Kai-Wan Hui(ケルビン・カイワン・フイ)
チームリーダー 田中 元雅(タナカ モトマサ)
岐阜大学 医学部附属病院 病理部
教授 宮崎 龍彦(ミヤザキ タツヒコ)
研究支援
本研究は、日本医療研究開発機構(AMED)Brain/MINDS Project(研究代表者:田中元雅)、同Pioneering Brain Research Project(研究代表者:田中元雅)、革新的先端研究開発支援事業(AMED-CREST)(研究代表者:田中元雅)、同学術変革領域研究(A)(研究代表者:田中元雅)などによる助成を受けて行われました。
原論文情報
Ryo Endo, Yi-Kai Chen, John Burke, Noriko Takashima, Nayan Suryawanshi, Kelvin K. Hui, Tatsuhiko Miyazaki, Motomasa Tanaka, “Dysregulation of ribosome-associated quality control elicits cognitive disorders via overaccumulation of TTC3”, Proceedings of the National Academy of Sciences(PNAS)
発表者
理化学研究所
脳科学研究センター タンパク質構造疾患研究チーム
研究員 遠藤 良(エンドウ・リョウ)
チームリーダー 田中 元雅(タナカ・モトマサ)
報道担当
理化学研究所 広報室 報道担当