線維芽細胞およびマウスES/ヒトiPS細胞から心臓中胚葉細胞の直接誘導に成功
2018-08-10 国立大学法人 筑波大学,慶應義塾大学医学部,国立研究開発法人 産業技術総合研究所,国立研究開発法人 日本医療研究開発機構
研究成果のポイント
- 線維芽細胞から心臓中胚葉(注1)細胞を直接誘導し、多能性幹細胞(注2)からの中胚葉分化全体をも制御する重要な遺伝子Tbx6を発見しました
- Tbx6導入による、新しい心筋・血管細胞作製法を開発しました
- 簡便・短期間・安価な心筋作製技術への発展が期待されます
概要
国立大学法人筑波大学 医学医療系 家田真樹教授(循環器内科)、慶應義塾大学医学部 貞廣威太郎助教(循環器内科)、国立研究開発法人産業技術総合研究所創薬分子プロファイリング研究センター 五島直樹研究チーム長らの研究グループは、Tbx6という遺伝子を導入するだけで、線維芽細胞やマウス・ヒトの多能性幹細胞から心臓中胚葉細胞を直接誘導できることを発見しました。
これまで、多能性幹細胞から心筋細胞を誘導するためには、複数の液性因子(注3)を使用して、まず心臓の幹細胞である心臓中胚葉細胞を誘導し、その後に心筋を誘導する方法が一般的でした。しかし、これまでの方法には、1)誘導の工程が煩雑、2)誘導効率が不安定、3)液性因子が高価であるという課題がありました。家田教授らは、新しい心臓再生法として心臓に存在する心筋以外の心臓線維芽細胞に心筋誘導遺伝子を導入し、マウス生体内で直接心筋細胞を作製できることなどを報告してきましたが、心筋以外の血管細胞などを作製できない、作製した心筋細胞は増殖できないなど課題がありました。
本研究では、線維芽細胞から心臓中胚葉細胞を直接誘導する遺伝子Tbx6を発見しました。また、Tbx6をマウスES細胞・ヒトiPS細胞といった多能性幹細胞に導入することにより、液性因子を使用せずに効率よく増殖可能な心臓中胚葉細胞を作製し、さらにこれを心筋細胞や血管細胞を誘導することに成功しました。この仕組みとして、Tbx6が心臓発生に重要なMesp1・BMP4遺伝子の発現を一過的に上昇させて心筋誘導することを明らかにしました。さらにTbx6の発現期間を調整することで、同じく中胚葉から分化する骨格筋や軟骨細胞も誘導が可能であることを見出し、Tbx6が心臓だけでなく多能性幹細胞からの中胚葉分化全体を制御する重要な因子であることを発見しました。
本研究により、Tbx6導入による、液性因子を使用しない新しい心筋・血管細胞作製法が開発されました。本研究成果は、心筋梗塞や拡張型心筋症をはじめとする様々な心臓疾患に対する再生医療への応用だけでなく、薬剤開発にも資する、簡便・短期間・安価な心筋作製技術への発展に寄与することが期待されます。
※本研究の成果は、2018年8月9日(日本時間8月10日午前0時)付「Cell Stem Cell」で公開される予定です。
研究の背景
心不全は世界の死亡原因の上位を占め、新規治療の開発が望まれています。心筋細胞は再生できないため、心疾患により心機能が低下した心臓は心不全となります。ES細胞、iPS細胞などの多能性幹細胞から誘導された心筋細胞は心臓再生医療や薬剤開発のツールとして期待されており、効率的な心筋誘導を目的とした研究が活発に行われています。幹細胞から心筋細胞を誘導する際は、中胚葉細胞のなかでも特に心臓中胚葉細胞を経由することが知られています。この細胞は自己複製能を有し、心筋への高い分化能を示すだけでなく、血管内皮細胞など心臓内の全ての細胞に分化することが可能です。その一方で、幹細胞から心臓中胚葉細胞を誘導するには、複数の液性因子が必要であることが知られています。しかし、これらの薬剤が高価であることに加えて、誘導工程が不安定かつ煩雑であることは、心臓再生医療の課題でした。さらに心臓中胚葉誘導の分子機構や、選択的な分化を制御する遺伝子の存在はこれまで明らかではありませんでした。そこで、この機構を解明し、心臓への分化を制御する遺伝子を発見すれば、液性因子を使用せずに、遺伝子発現を制御することのみで心筋誘導が可能になると考え、本研究を開始しました。
本研究に先駆け、2010年に家田教授らはマウス心筋細胞を作り出すために必要な「心筋誘導遺伝子」(iPS細胞を樹立するときの細胞の初期化に必要な4因子である「山中ファクター」にあたる)として、Gata4、Mef2c、Tbx5を見出しました(Ieda et al, Cell, 2010)。また、マウス生体内の線維芽細胞に、3つの心筋誘導遺伝子を導入して、心臓内の線維芽細胞を心臓内で心筋細胞へと転換できることを報告しています(Inagawa et al, Circ Res, 2012)。さらには、最近の研究では遺伝子導入の方法を改良して、細胞のゲノムを損傷することなく、短期間で効率よく心筋を誘導する心臓再生法の確立に成功しています(Miyamoto et al, Cell Stem Cell, 2018)。しかしながらこの方法で作製する心筋細胞は増殖能力がないこと、また心臓の再生に心筋と共に必要である血管などの細胞を作製できないという課題がありました。
研究内容と成果
1.線維芽細胞からの心臓中胚葉誘導因子のスクリーニング
産業技術総合研究所が所有するcDNAライブラリー(HuPEX,Goshima et al. Nature Methods, 2008)を用いて、心臓中胚葉を誘導する遺伝子のスクリーニングを行いました。心臓中胚葉のDNAマイクロアレイ(注4)データを用いて、心臓中胚葉で特異的に発現する候補遺伝子58個を選択し、これらの遺伝子を一種類ずつマウス線維芽細胞に導入したところ、発生を制御する転写因子Tbx6を導入した細胞からのみ、心臓中胚葉特異的な遺伝子であるMesp1を発現する細胞群が誘導されました(図1)。このTbx6により誘導された細胞は、心臓中胚葉の状態を長期にわたって維持し、自然に心筋まで分化することはなかったことから、Tbx6が心臓中胚葉を誘導する遺伝子であることが示唆されました。
これまで心臓中胚葉との関連が知られていなかったTbx6ですが、マウス生体内の中胚葉細胞のsingle cell-RNA seqデータ(注5)を解析したところ、Tbx6を発現する細胞が心臓中胚葉や心臓前駆細胞の遺伝子を発現していることが明らかとなりました。そこで心臓発生におけるTbx6の役割を検討するため、液性因子を用いたマウスES細胞からの心筋誘導の過程でTbx6の役割を解析することにしました。
その結果、ES細胞から誘導された心臓中胚葉でTbx6遺伝子が発現することを確認しました。さらにCRISPR-Cas9(注6)を用いてES細胞でTbx6遺伝子を欠損させたところ、心臓中胚葉や心筋への誘導が著明に抑制され、Tbx6が生体での心臓発生や多能性幹細胞からの心筋誘導において重要な因子であることがわかりました。
2.Tbx6発現制御マウスES細胞を用いた心臓中胚葉・心筋誘導法の確立
次にTbx6をTet-Onレンチウイルスシステム(注7)でマウスES細胞に導入し、Tbx6遺伝子発現を自由に制御できる実験系を確立しました。Tbx6発現のみで中胚葉・心臓中胚葉、心筋細胞への誘導が可能かを検討したところ、液性因子を使用せずに、約88%のES細胞が中胚葉細胞に誘導されました。一方、液性因子を使用せずにTbx6を発現させないと、中胚葉細胞は全く作製できませんでした。Tbx6発現下で誘導された中胚葉細胞の多くは心臓中胚葉細胞であり、これらの約67%が心筋細胞に誘導されました。この誘導効率は、液性因子による心筋誘導効率と同等以上の結果でした(図2)。さらに心筋細胞以外に、血管平滑筋細胞や血管内皮細胞への分化を確認し、心臓を構成する全ての細胞への分化を確認しました。
3. Tbx6発現による心臓中胚葉誘導のメカニズムの解明
マイクロアレイによる網羅的な遺伝子解析では、Tbx6により中胚葉・心臓発生と関連する遺伝子群が上昇し、神経発生と関連する遺伝子が抑制されていました。クロマチン免疫沈降法(注8)による解析では、Tbx6が心臓分化に重要な遺伝子Mesp1やBMP4、中胚葉への分化を阻害する遺伝子であるSox2と直接結合し、Mesp1・BMP4発現を誘導する一方で、Sox2の発現を抑制していることが明らかとなりました。さらにTbx6が中胚葉や心筋誘導に重要なシグナルであるBMP4、Nodal、Wnt3を誘導し、パラクライン作用(注9)的に心筋誘導を促進することを確認しました。以上の結果より、Tbx6が直接的・間接的両方の作用により心臓中胚葉を誘導することを明らかにしました。
4. Tbx6発現によるマウスES細胞からの骨格筋・軟骨への誘導の確認
本研究で明らかになった中胚葉の発生初期における機能のほかに、Tbx6は骨格筋・軟骨のもととなる沿軸中胚葉の発生との関連が知られていました。発達過程において、これらの臓器は心臓の後に発生するため、Tbx6の発現期間を心臓中胚葉の誘導に必要な期間よりも延長したところ、沿軸中胚葉細胞を作製できました。さらに培養条件を調整する事で、誘導された沿軸中胚葉から骨格筋と軟骨細胞がそれぞれ誘導されました。
同じ遺伝子であるTbx6の発現期間により心筋、または骨格筋への分化が制御される仕組みについても検討し、Tbx6の発現期間を延長すると心筋分化を阻害する遺伝子群が誘導されることを明らかにしました。以上より、Tbx6が心血管系と筋骨格系への分化を制御する重要な中胚葉誘導制御因子であることを発見しました(図3)。
5. Tbx6発現制御ヒトiPS細胞を用いた心臓中胚葉・心筋誘導法の確立
次に、ヒトiPS細胞で同様にTet-OnレンチウイルスシステムでTbx6遺伝子を導入して、Tbx6遺伝子の発現を自由に制御できる実験系を確立しました。その結果、マウスES細胞と同様に、ヒトiPS細胞においてもTbx6遺伝子の発現だけで、液性因子を使用せずに心臓中胚葉を作製でき、さらに心筋細胞や血管細胞への分化誘導が可能であることを確認しました。
今後の展開
ES細胞、iPS細胞をはじめとする多能性幹細胞から誘導した心筋細胞は、心臓再生医療や薬剤スクリーニングへの活用が期待されます。本研究で開発した手法は高額な液性因子を使用しないため、心筋誘導法における問題点であったコストを約80%削減でき、再生医療や心筋細胞作製に大きく貢献すると予想されます。特に薬剤開発のスクリーニングにおいては、安価なヒト心筋細胞の作製法が熱望されています。今後は本研究成果によって得られたTbx6遺伝子によるマウス・ヒト多能性幹細胞からの心筋誘導を応用して、創薬や心毒性スクリーニングで使用可能な心筋細胞キットの実用化に向けて研究を進めていきます。これらの研究を進めていくことで、安価かつ安定したヒト心筋細胞の供給が可能になれば、心臓再生医療実現に向けた大きな一歩になると考えます。
※本研究は、国立研究開発法人日本医療研究開発機構(AMED)の再生医療実現拠点ネットワークプログラム「幹細胞・再生医学イノベーション創出プログラム」および「技術開発個別課題」、 公益財団法人先進医薬研究振興財団、 公益財団法人武田科学振興財団、公益財団法人第一三共生命科学研究振興財団、 JSPS 科研費JP17H04179、JP16K19426、JP18K08114、 公益財団法人中冨健康科学振興財団、 公益財団法人宮田心臓病研究振興基金、 慶應義塾大学博士課程学生研究支援プログラム、 慶應義塾大学医学部研究奨励費、 公益財団法人日本心臓財団の支援によって行われました。
参考図
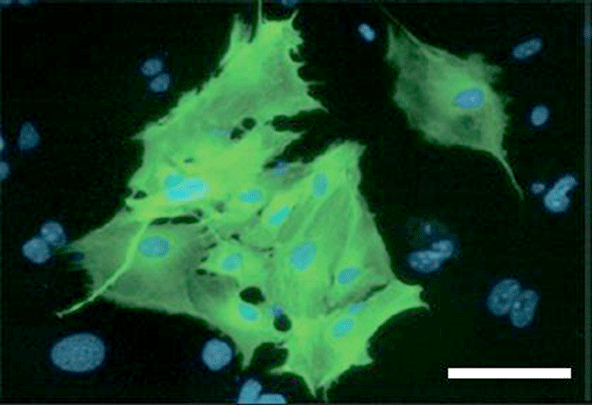
図1:Tbx6によって線維芽細胞から誘導された心臓中胚葉細胞
Tbx6遺伝子によりマウス線維芽細胞からMesp1陽性の心臓中胚葉細胞(緑の蛍光タンパク質を発現。青色で細胞核を染色した。)が誘導された。スケールバーは100㎛
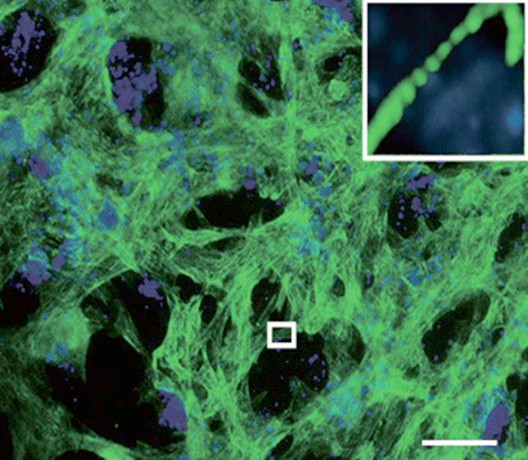
図2:Tbx6によってマウスES細胞から誘導された心筋細胞
Tbx6遺伝子によりマウスES細胞から心筋細胞(心筋構造タンパク質トロポニンTを緑色で染色。青色で細胞核を染色)が誘導された。強拡大(右上)では心筋横紋構造が認められた。スケールバーは100㎛
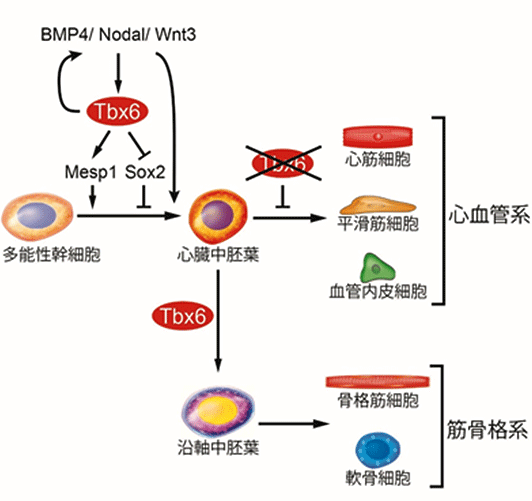
図3:Tbx6は幹細胞からの中胚葉や心筋誘導を制御
Tbx6発現により多能性幹細胞から心臓中胚葉が誘導される。誘導後にTbx6発現が消失した場合に、心臓中胚葉は心血管系細胞に分化するが、発現が持続すると沿軸中胚葉が誘導され筋骨格系細胞に分化する。
用語解説
- 注1)心臓中胚葉
- 発生の初期過程において形成される細胞集団の一つである中胚葉は循環器系、骨格系などのもととなり、心臓や骨格筋、軟骨などに分化する。特に心臓中胚葉は増殖可能であり、心筋・血管内皮・血管平滑筋など、ほぼすべての心臓構成細胞に分化する。
- 注2)多能性幹細胞
- 自己複製能と、体を構成するさまざまな細胞に分化する多分化能を持つ細胞のこと。胚性幹細胞 (Embryonic stem cells:ESCs)や人工多能性幹細胞(Induced pluripotent stem cells:iPSCs)がある。
- 注3)液性因子
- 細胞が放出する物質で、細胞間で分化や増殖に関わる情報を伝達して作用する。
- 注4)DNAマイクロアレイ
- DNAチップを用いて多くの遺伝子の網羅的な解析が可能な手法。
- 注5)Single cell-RNAseq
- 単一細胞内のmRNAの配列を解読して、発現量の定量などが可能な手法。
- 注6)CRISPR-Cas9
- ゲノムの特定の場所で、遺伝子配列の削除、置換、挿入が可能なゲノム編集技術。
- 注7)Tet-Onレンチウイルスシステム
- ドキシサイクリンの存在下でのみ目的遺伝子を発現させることが出来る機構を組み込んだレンチウイルスベクターを用いて、任意の時期に遺伝子発現の調整が可能となった細胞を作製するシステム。
- 注8)クロマチン免疫沈降
- タンパク質と遺伝子が直接結合しているかを解析する手法。本研究ではTbx6タンパク質が標的遺伝子と直接結合しているかを解析した。
- 注9)パラクライン作用
- 液性因子が近傍の細胞に作用すること。
参考文献
- Ieda M, Fu JD, Delgado-Olguin P, Vedantham V, Hayashi Y, Bruneau BG, Srivastava D. Direct Reprogramming of Fibroblasts into Functional Cardiomyocytes by Defined Factors. Cell.; 142(3): 375–386, 2010 Aug 6
- Inagawa K, Miyamoto K, Yamakawa H, Muraoka N, Sadahiro T, Umei T, Wada R, Katsumata Y, Kaneda R, Nakade K, Kurihara C, Obata Y, Miyake K, Fukuda K, Ieda M. Induction of Cardiomyocyte-like Cells in Infarct Hearts by Gene Transfer of Gata4, Mef2c, and Tbx5. Circ Res.;111(9):1147-56, 2012 Oct 12
- Wada R, Muraoka N, Inagawa K, Yamakawa H, Miyamoto K, Sadahiro T, Umei T, Kaneda R, Suzuki T, Kamiya K, Tohyama S, Yuasa S, Kokaji K, Aeba R, Yozu R, Yamagishi H, Kitamura T, Fukuda K, Ieda M. Induction of Human Cardiomyocyte-like Cells from Fibroblasts by Defined Factors. Pro Natl Acad Sci USA.;110(31):12667-72, 2013 Jul 30
- Muraoka N, Yamakawa H, Miyamoto K, Sadahiro T, Umei T, Isomi M, Nakashima H, Akiyama M, Wada R, Inagawa K, Nishiyama T, Kaneda R, Fukuda T, Takeda S, Tohyama S, Hashimoto H, Kawamura Y, Goshima N, Aeba R, Yamagishi H, Fukuda K, Ieda M. MiR-133 promotes cardiac reprogramming by directly repressing Snai1 and silencing fibroblast signatures. EMBO J.;33(14):1565-81, 2014 Jul 17
- Yamakawa H, Muraoka N, Miyamoto K, Sadahiro T, Isomi M, Haginiwa S, Kojima H, Umei T, Akiyama M, Kuishi Y, Kurokawa J, Furukawa T, Fukuda K, Ieda M. Fibroblast Growth Factors and Vascular Endothelial Growth Factor Promote Cardiac Reprogramming under Defined Conditions. Stem Cell Reports.;5(6):1128-42, 2015 Dec
- Miyamoto K, Akiyama M, Tamura F, Isomi M, Yamakawa H, Sadahiro T, Muraoka N, Kojima H, Haginiwa S, Kurotsu S, Tani H, Wang L, Qian L, Inoue M, Ide Y, Kurokawa J, Yamamoto T, Seki T, Aeba R, Yamagishi H, Fukuda K, Ieda M. Direct In Vivo Reprogramming with Sendai Virus Vectors Improves Cardiac Function after Myocardial Infarction. Cell Stem Cell.; 22(1):91-103.e5; 2018 Jan 4.
掲載論文
- 題名
- Tbx6 Induces Nascent Mesoderm from Pluripotent Stem Cells and Temporally Controls Cardiac versus Somite Lineage Diversification
(Tbx6は多能性幹細胞から中胚葉を誘導し、心血管系と筋骨格系への分化を制御する) - 著者名
- Taketaro Sadahiro, Mari Isomi, Naoto Muraoka, Hidenori Kojima, Sho Haginiwa, Shota Kurotsu, Fumiya Tamura, Hidenori Tani, Shugo Tohyama, Jun Fujita, Hiroyuki Miyoshi, Yoshifumi Kawamura, Naoki Goshima, Yuka W. Iwasaki, Kensaku Murano, Kuniaki Saito, Mayumi Oda, Peter Andersen, Chulan Kwon, Hideki Uosaki, Hirofumi Nishizono, Keiichi Fukuda, Masaki Ieda
- 掲載誌
- Cell Stem Cell
doi.org/10.1016/j.stem.2018.07.001
問合わせ先
本研究内容に関して
家田 真樹(いえだ まさき)
筑波大学 医学医療系循環器内科 教授
AMED事業に関して
戦略推進部 再生医療研究課