2023-05-31 理化学研究所
理化学研究所(理研)脳神経科学研究センター 神経幹細胞研究チームの前田 勇樹 リサーチアソシエイト、影山 龍一郎 チームリーダーらの共同研究チームは、マウスの神経幹細胞[1]において、転写抑制因子[2]Hes1による発現動態依存的な細胞増殖の制御機構を分子レベルで解明しました。
本研究成果は、アルツハイマー病や老化による認知力低下の治療や脳における学習・記憶の機能の理解の一助になり、また神経幹細胞だけでなく、骨格筋の衛星細胞[3]など他の成体の幹細胞の活性状態と休眠状態の制御機構の解明にも貢献すると期待できます。
今回、共同研究チームは、活性状態の神経幹細胞ではHes1の発現振動がサイクリン依存性キナーゼ阻害因子(CKI)[4]p21の発現を抑制して細胞増殖を促進する一方、休眠状態の神経幹細胞ではHes1の持続的な高発現が間接的にp21の発現を活性化し、細胞増殖を抑制することを明らかにしました。この休眠状態におけるp21発現の活性化は、Hes1の持続的高発現が二重特異性ホスファターゼ[5]Dusp7の発現を抑制し、Dusp7の標的である細胞外シグナル制御キナーゼ[6]Erk1/2のリン酸化が誘導されることで起こります。
本研究は、科学雑誌『Cell Reports』オンライン版(5月17日付)に掲載されました。
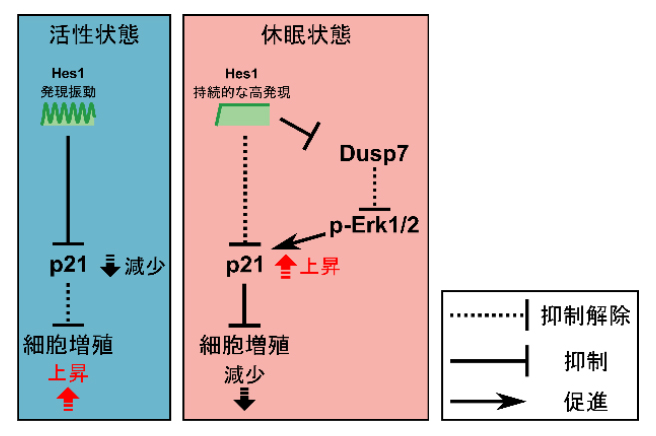
p21を介した転写抑制因子Hes1による発現動態依存的な細胞増殖の制御機構
背景
胎生期に神経幹細胞は活発に増殖し、神経細胞(ニューロン)を大量に産み出しますが、大人になると休眠状態になり、増殖せず、神経細胞も産み出さなくなります。ところが、休眠状態になった神経幹細胞がまれに活性化して増殖し、一定数の神経細胞を産み出して、学習・記憶の機能に貢献することが分かっています。しかし、この活性状態と休眠状態を制御する具体的な仕組みには、いまだ不明な点が多く残されています。
これまでに、Notchシグナル[7]の活性化がこの制御に重要なことが明らかにされてきました。Notch1は増殖する細胞を維持するのに必要ですが、Notch2は神経幹細胞の休眠を誘導します。Notchシグナルのエフェクター[8]である転写抑制因子Hes1は、神経幹細胞の活性状態と休眠状態の両方に必要です。興味深いことに、Hes1の発現動態は活性状態と休眠状態で異なることが分かっています。
増殖中の神経幹細胞ではHes1の発現は振動していますが、休眠状態ではHes1が持続的に高発現しています。これらのことより、Hes1の発現動態の違い(発現振動または持続的な高発現)が、神経幹細胞の状態の違い(活性状態または休眠状態)を決める重要な要素になっていると考えられます。しかし、Hes1の発現動態が神経幹細胞の増殖を制御する詳細な仕組みは明らかになっていませんでした。
研究手法と成果
共同研究チームはまず、神経幹細胞の増殖におけるHes1の必要性を確認するため、マウスを用いて、Hes1遺伝子を欠損させたHes1ノックアウト(KO)[9]神経幹細胞を作製することにしました。実際には、Hes1の機能はHes3、Hes5などのHesファミリー因子群によって補償されるため、Hes1、Hes3、Hes5、Hey1の四つ全てをKOしたHesKO神経幹細胞を作製し、細胞増殖を比較しました。その結果、HesKOによって神経幹細胞の増殖が減少することが分かりました(図1a上段)。
また、Hes1の持続的な高発現(OE)を誘導し、神経幹細胞における影響を調べたところ、Hes1OEは細胞増殖を抑制することが分かりました(図1a上段)。活発に増殖している野生型(WT)の神経幹細胞では、Hes1の発現が2~3時間周期で振動していることから、このHes1の発現振動が神経幹細胞の増殖を効率よく誘導することが示唆されました。
次に、Hes1が発現動態依存的に神経幹細胞の増殖を制御する仕組みを理解するために、RNA-seq解析[10]を用いて、2組の神経幹細胞(HesKOと野生型、Hes1OEと野生型)における遺伝子発現を網羅的に比較しました。その結果、細胞増殖を抑制する機能を持つサイクリン依存性キナーゼ阻害因子(CKI)p21の発現がHesKOとHes1OEでは上昇し、野生型では減少していることが分かりました(図1a下段)。また、ウェスタンブロッティング解析[11]から、Hes1OEによってp21の発現がタンパク質レベルでも上昇することも確認されました(図1b)。これらの結果は、Hes1の発現が振動しているときはp21の発現が抑制される一方で、Hes1が持続的に高発現しているときはp21の発現が促進されることを示唆しています。またHes1OEに加えて、p21の発現をノックダウン[12]によって抑制したところ、Hes1OEによる細胞増殖抑制が改善されました。この結果は、Hes1はp21を介して、発現動態依存的に神経幹細胞の増殖を制御することを示唆しています。
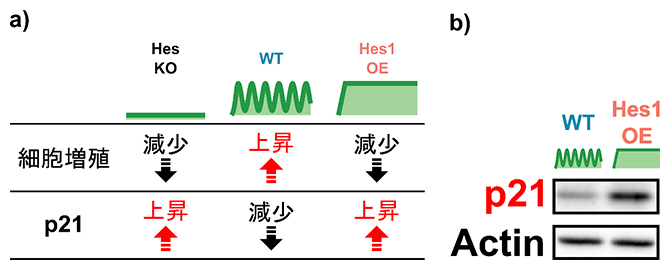
図1 Hes1の発現動態依存的な細胞増殖とp21の発現
a)HesKO(ノックアウト)またはHes1OE(持続的高発現)によって、神経幹細胞の増殖はWT(野生型)と比較して減少し(上段)、またRNA-seq解析によりp21の発現は上昇した(下段)。
b)ウェスタンブロッティング解析から、Hes1OEによってp21の発現はタンパク質レベルでも上昇することが分かった。
次に、p21の発現がHes1の発現振動によって抑制されるかどうかを調べるため、p21の発現をモニターできるp21プロモーター[13]レポーター[14]を持つ神経幹細胞を用意しました。Hes1の発現振動を誘導するため、光に応じて発現のオン・オフが可能なGAVPO/UASシステム[15]をその細胞に導入しました。このシステムでは青色光を当てると発現がオンになり、光を遮断すると発現がオフになるため、青色光を特定の頻度で照射することでHes1の発現振動を誘導できます(図2a)。この神経幹細胞を用いて、Hes1の発現振動を誘導したところ、p21プロモーターの活性が、光刺激のタイミングごとに減少していることが分かりました(図2b)。この結果は、p21の発現がHes1の発現振動によって抑制されることを示唆しています。
次に、Hes1OEがp21の発現を活性化するかどうかを調べました。p21プロモーターレポーターを持った神経幹細胞にHes1OEを誘導したところ、最初はp21の発現が減少しましたが、誘導を開始して約10時間後には、p21の発現が上昇し始め、継続的に上昇し続けることが確認できました(図2c)。この結果は、Hes1OEが最初p21の発現を抑制するが、ある一定期間、Hes1の発現が続くと今度は反対にp21の発現を活性化することを示唆しています。
さらに、クロマチン免疫沈降(ChIP)アッセイ[16]により、Hes1が直接p21のプロモーターに結合することが分かりました。今までの結果を踏まえると、転写抑制因子Hes1はp21のプロモーターに直接作用して、転写を抑制し、Hes1OEは間接的にp21の発現を活性化すると考えられます。
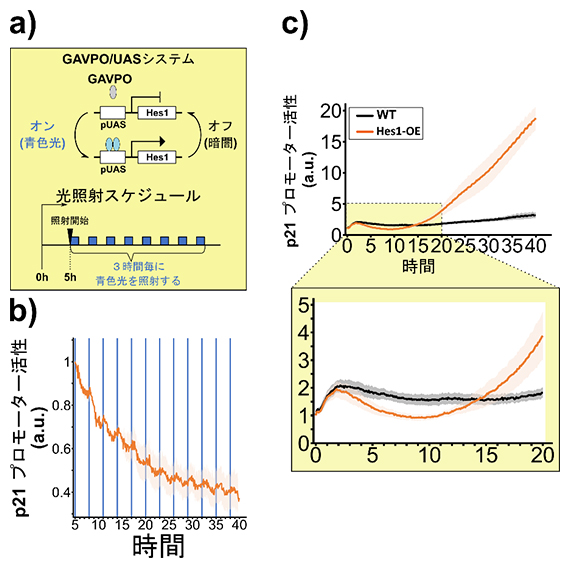
図2 Hes1の発現振動またはHes1OE(持続的高発現)によるp21の発現制御
a)GAVPO/UASシステムの模式図と光照射のスケジュール。
b)光照射(青線)によるHes1発現振動を伴ったp21の発現(オレンジ線)の時間変化を示したグラフ。光照射の少し後で、p21の発現が減少した。
c)WT(黒線)とHes1OE(オレンジ線)の神経幹細胞におけるp21の発現の時間変化を示したグラフ。右下の図は拡大表示している。Hes1OEによって誘導開始から約10時間まではp21の発現が減少しているが、その後、p21の発現が上昇し始め、継続的に上昇し続けた。
次に、Hes1OEが間接的にp21の発現を活性化する仕組みを明らかにするために、野生型とHes1OEの神経幹細胞のシグナル因子の発現を比較したところ、細胞外シグナル制御キナーゼErk1/2のリン酸化がHes1OEの神経幹細胞で上昇していることが分かりました。また、Hes1OEを誘導した神経幹細胞に、Erk1/2のリン酸化阻害剤(MEKi)を加えたところ、Hes1OEによって上昇していたp21の発現が抑制されました(図3a)。加えて、Hes1によって抑制されていた細胞増殖もこの阻害剤で回復しました。これらの結果は、Erk1/2のリン酸化がHes1OEによるp21の発現上昇に重要であることを示しています。
さらに、Hes1OEがErk1/2のリン酸化を誘導する仕組みを調べました。転写抑制因子Hes1は、Erk1/2のリン酸化を抑制する因子の発現を抑制していると仮定しました。二重特異性ホスファターゼ(Dusp)は有名なErk1/2リン酸化抑制因子です。野生型とHes1OEの神経幹細胞におけるDuspファミリーの発現を比較したところ、Dusp7の発現が抑制されていることが分かりました(図3b)。また、Hes1OEに加えてDusp7OEも誘導したところ、Hes1によって抑制されていた細胞増殖も回復しました。さらに、ChIPアッセイにより、Hes1が直接Dusp7の発現を制御している領域に結合することが分かりました。これらの結果は、Hes1OEがDusp7の発現を抑制し、Erk1/2のリン酸化が誘導されることでp21の発現上昇が起きることを示唆しています。
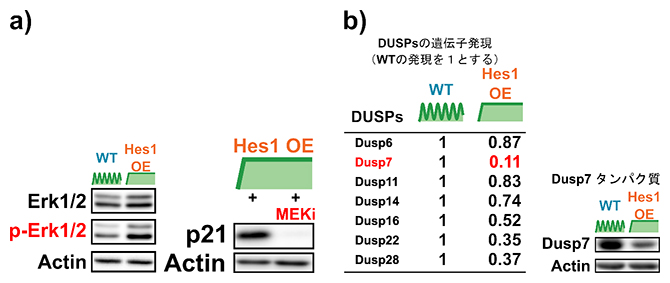
図3 Hes1OEが間接的にp21の発現を活性化させる仕組み
a)ウェスタンブロッティング解析の結果。WTとHes1OE神経幹細胞を比較すると、Erk1/2のリン酸化(p-Erk1/2)がHes1OEによって誘導された(左)。またErk1/2のリン酸化の阻害剤(MEKi)を加えると、Hes1OEによるp21の発現上昇が抑制された(右)。
b)Dusp7の発現の定量。Hes1OEによって発現が減少し、かつErk1/2のリン酸化を抑制可能なDuspを表にした(左)。この中で、Dusp7の発現が最もHes1OEで減少していた。また、Dusp7のタンパク質量も減少していた(右)。
以上の結果から、Hes1は直接p21の発現を抑制するが、ある一定期間Hes1の発現が続くとHes1がDusp7の発現を抑制し、Erk1/2のリン酸化が進み、その結果、p21の発現が活性化されることが明らかになりました。
今後の期待
成体脳における神経幹細胞は、一定の割合で神経細胞を産み出すことで、脳における学習や記憶の機能に貢献しています。アルツハイマー病や老化ではこの神経細胞の産出が減少することから、これらの機能が低下します。本研究では、Hes1の発現動態(発現振動または持続的な高発現)が神経幹細胞の状態(活性状態または休眠状態)を決める仕組みを明らかにし、成体脳における神経幹細胞の活性状態と休眠状態を制御する機構の理解を深めました。
本成果は、アルツハイマー病や老化による認知力低下の治療や脳における学習や記憶の機能の理解の一助になると期待できます。また、神経幹細胞だけでなく、骨格筋の衛星細胞などの他の成体幹細胞の活性状態と休眠状態の制御機構の解明にも貢献することが期待できます。
補足説明
1.神経幹細胞
神経細胞のもととなる細胞。胎生期には活発に増殖し、神経細胞を大量に産み出す。
2.転写抑制因子
プロモーターなどのDNAに結合し、遺伝子発現を制御するタンパク質を転写因子という。転写抑制因子は遺伝子発現を抑制するタンパク質のことを指す。
3.衛星細胞
骨格筋に存在する成体幹細胞。多くは休眠状態にあるが、筋肉が傷ついたとき、活性化して増殖し骨格筋の細胞を産み出す。
4.サイクリン依存性キナーゼ阻害因子(CKI)
サイクリン依存性キナーゼ(CDK)を阻害するタンパク質。CDKは細胞増殖に必須なタンパク質であり、CKIはCDKを阻害することで、細胞増殖を抑制する。
5.二重特異性ホスファターゼ
リン酸化されたタンパク質のリン酸を取り除くタンパク質の一つ。特定のタンパク質内にあるチロシンに結合されたリン酸と、スレオニンまたはセリンに結合されたリン酸を両方とも除くことができる。
6.細胞外シグナル制御キナーゼ
細胞内で情報を伝達するタンパク質。EGFなどの細胞外の情報伝達物質によって活性化され、特定のタンパク質をリン酸化する。
7.Notchシグナル
膜タンパク質NotchとDeltaによるシグナル伝達経路。隣の細胞の細胞膜に発現するDeltaが、自細胞の細胞膜に発現するNotchと結合することでシグナルを伝達する。
8.エフェクター
細胞の挙動に直接影響を与えるタンパク質。細胞は、細胞外または細胞内のシグナルに応じてエフェクターの活性が変化することで、伝達されたシグナルに対応することができる。
9.ノックアウト(KO)
遺伝子の機能を損なわせるような変異やDNA配列の除去を誘導することにより、遺伝子の機能を欠損させる手法。
10.RNA-seq解析
遺伝子の発現を網羅的に解析する手法のこと。次世代シーケンサーという装置を使って、細胞内に存在するmRNAの塩基配列を明らかにすることで全遺伝子の発現量を定量できる。
11.ウェスタンブロッティング解析
タンパク質を検出する方法の一つ。検出したいタンパク質に特異的に結合する抗体を使うことで、特定のタンパク質の発現量を定量できる。
12.ノックダウン
特定の遺伝子の発現を抑制する方法のこと。特定のDNAの遺伝子情報を基に標的のRNAを分解し、発現を抑制する。
13.プロモーター
遺伝子の発現を制御する領域の一つ。RNAを合成する転写の開始に関与する近傍の上流領域のこと。
14.レポーター
特定の遺伝子の発現をモニターするための手法。遺伝子発現の変化に応じて、発光タンパク質や蛍光タンパク質などが増減することでモニターできる。
15.GAVPO/UASシステム
光感受性人工転写因子GAVPOとUASプロモーターを用いた発現誘導システムのこと。⻘色光を照射するとGAVPOが二量体を形成してUASプロモーターに結合し、遺伝子の発現を誘導する。
16.クロマチン免疫沈降(ChIP)アッセイ
タンパク質が結合しているDNAの領域を調べる方法。特定のタンパク質にのみ結合する抗体を使うことによって、標的のタンパク質が結合しているDNA領域のみを集めることができる。
共同研究チーム
理化学研究所 脳神経科学研究センター 神経幹細胞研究チーム
リサーチアソシエイト 前田 勇樹(マエダ・ユウキ)
研究パートタイマーⅡ 正木 大夢(マサキ・タイム)
チームリーダー 影山 龍一郎(カゲヤマ・リョウイチロウ)
京都大学 医生物学研究所 応答解析分野
特定准教授 磯村 彰宏(イソムラ・アキヒロ)
研究支援
本研究は、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)「成体脳神経幹細胞の機能低下メカニズムの解明と再活性化に向けた技術開発(研究代表者:影山龍一郎)」、日本学術振興会(JSPS)科学研究費助成事業特別推進研究「短周期振動する遺伝子発現の生理学的意義について(研究代表者:影山龍一郎)」、科学技術振興機構(JST)戦略的創造研究推進事業個人型研究(さきがけ)「遺伝子発現の光制御と光計測による生体分子の動的機能の解明(研究代表者:磯村彰宏)」による助成を受けて行われました。
原論文情報
Yuki Maeda, Akihiro Isomura, Taimu Masaki, Ryoichiro Kageyama, “Differential cell-cycle control by oscillatory versus sustained Hes1 expression via p21”, Cell Reports, 10.1016/j.celrep.2023.112520
発表者
理化学研究所
脳神経科学研究センター 神経幹細胞研究チーム
リサーチアソシエイト 前田 勇樹(マエダ・ユウキ)
チームリーダー 影山 龍一郎(カゲヤマ・リョウイチロウ)
報道担当
理化学研究所 広報室 報道担当