2024-08-08 東京大学
星薬科大学の眞鍋史乃教授らの研究グループは、東京大学、東北医科薬科大学、株式会社伏見製薬所との共同研究により、抗体がもつ1対の糖鎖構造を左右非対称な形で均一化した抗体を作製する技術を開発し、66種類からなる世界最大の糖鎖均一抗体ライブラリーを作製しました。抗体依存性細胞傷害活性、熱的安定性を評価した結果、1対の糖鎖構造が非対称のものの中に優れた抗体依存性細胞傷害活性、熱的安定性をもつものを見出しました。
8月7日(日本時間)にアメリカ化学会誌『ジャーナル・オブ・アメリカン・ケミカル・ソサイエティー (Journal of the American Chemical Society)』に発表されました。
【研究成果のポイント】
- 抗体医薬品はがん細胞などの細胞表面の目印となる特定の抗原をピンポイントで狙い撃ちするため、高い治療効果と副作用の軽減が期待されています。
- 抗体のFc 領域に存在する1対のN-結合型糖鎖注1)は、抗体の体内動態や抗体依存性細胞傷害活性注2)に影響を与えることが知られています。糖鎖構造を改変して抗体の機能を向上することが期待されます。
- 今回の研究では、FcγRIIIa注3)アフィニティーカラムクロマトグラフィーによる精製操作を加えることで、1対の糖鎖の左右非対称型を作製できる技術を開発し、作製できる糖鎖均一抗体の数を10倍以上に増大させました。
- 非対称型糖鎖抗体の中から優れた抗体依存性細胞傷害活性や熱的安定性をもつものが見出されました。今後、産業的にもバイオシミラー・バイオベター注4)の開発に貢献することが期待できます。
【概要】
星薬科大学薬学部・医薬品化学研究所/東北大学大学院薬学研究科医薬品開発研究センター(クロスアポイントメント)の眞鍋史乃教授(責任著者)は、津本浩平教授(東京大学大学院工学系研究科)、長門石曉准教授(東京大学大学院工学系研究科)、山口芳樹教授(東北医科薬科大学薬学部)、岩本将吾研究員、星野尾麻子研究員、三谷藍研究員、住吉渉研究員、木下崇司研究員(株式会社伏見製薬所)らとの共同研究で、抗体がもつ1対の糖鎖構造を左右非対称な形で均一化する技術を開発しました。この技術により作製できる糖鎖均一抗体の種類を10倍以上増大でき、その結果作製した糖鎖均一抗体ライブラリーは世界最大のものとなりました。
この技術により、治療用抗体の糖鎖構造を系統的に改変し、優れた抗体依存性細胞傷害活性および熱的安定性をもつ抗体を見出しました。この成果により、抗体の糖鎖を改変することで、抗体の機能を調節できることが示されました。今後、より効果的で安全な抗体医薬品の開発が期待されます。
研究成果は2024年8月7日(日本時間)にアメリカ化学会誌『ジャーナル・オブ・アメリカン・ケミカル・ソサイエティー (Journal of the American Chemical Society)』オンライン版に掲載されました。
【研究の背景】
抗体医薬品の利用が増加しています。抗体のFc領域には1対の糖鎖が普遍的に存在し、その構造が抗体の効果や安全性に影響を与えることがあります。本研究では、糖鎖均一抗体を系統的に作製し、糖鎖構造と抗体機能の関係を明確にする技術を開発しました。通常の抗体製造プロセスでは糖鎖の構造が多様であり(図1)、これが抗体の効果や安全性に影響を及ぼすことがあります。また、生産細胞由来の非ヒト型糖鎖をもつ抗体が生産されることがありますが、その非ヒト型糖鎖抗体は免疫原性をもつことがあります。
抗体の糖鎖構造はその生合成経路の複雑さから微細構造が少しずつ異なるものが混在していますが、それらを単離精製することが不可能で、糖鎖構造と抗体機能の関連は、曖昧でした。そのため、糖鎖構造をどのように改変して抗体機能を向上させるかについての戦略の立案には限界がありました。抗体糖鎖の均一化により得られる知見は抗体医薬品の品質向上に寄与するばかりか、抗体医薬品の品質管理を容易にし、製造コストの削減にも寄与します。

糖鎖構造と抗体機能の関係を明確にするために均一な糖鎖を用いて酵素により糖鎖を改変する抗体糖鎖リモデリング法が行われてきました。すなわち、1)抗体の糖鎖のうち、一つの糖ユニットを残して酵素 (Endo-b-N-acetylglucosaminidase: ENGase)で不均一な糖鎖を切断、2)均一な糖鎖を改変ENGase で付加するという二段階で抗体の糖鎖を均一なものに変換できます。二段階目で使用する改変ENGase は、ENGase の糖付加能力を保ったまま、糖鎖切断能力を抑えるようにENGase を改変したものです。しかし、この手法では、抗体のもつ1対の糖鎖のうち左右対称のものしか作製できない限界がありました。非対称型の糖鎖均一抗体を作製できれば、糖鎖均一化された抗体の種類を飛躍的に増加させることができます。
【本研究の成果】
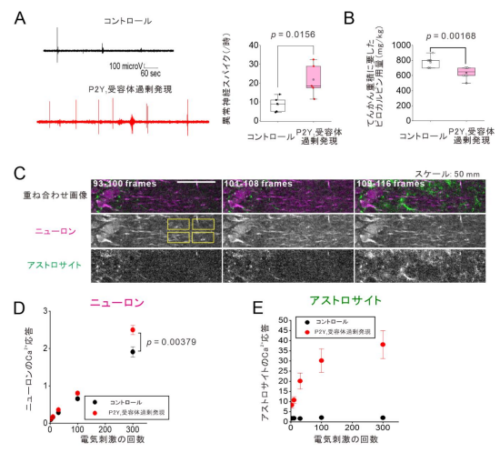
眞鍋教授のチームは、糖鎖付加の工程の糖鎖の量と改変ENGase の量を調節し、さらに1本の糖鎖をもつ抗体をFcγRIIIa アフィニティーカラムクロマトグラフィーを用いて未反応の0本糖鎖抗体と2本糖鎖が結合した抗体から単離する方法を見出しました。単離した1本鎖抗体に構造が異なる2本目の糖鎖を付加することにより、非対称型の糖鎖均一抗体が作製できます。作製した糖鎖均一抗体の均一性は質量分析により確認しました(図2)。
この方法を用いて、乳がんの治療抗体であるトラスツズマブに対して66種類の糖鎖均一抗体ライブラリーを作製しました。これは世界で最大の糖鎖均一抗体ライブラリーとなりました。

作製した糖鎖均一トラスツズマブの機能評価を行ったところ、非対称糖鎖均一抗体の中に優れた抗体依存性細胞傷害活性をもつもの、熱的安定性に優れたものが見出されました。
また、ある種の糖鎖構造の中には、熱的安定性の指標であるTm とΔH との間に正比例の関係があることを初めて見出しました。これは、数多くのライブラリーを測定した結果明らかになったことで、系統的合成の重要性を示しています。
【今後の展望および波及効果】
抗体医薬品は、医薬品の中で大きな割合を占めます。糖鎖構造を制御し、糖鎖構造と抗体機能を紐付けることは糖鎖のもつ多様性の意義の解明や理解にも役立ちます。系統的に糖鎖均一化された抗体の機能を評価することで、抗体の機能向上のための新たな戦略をたてることが可能となり、より効果の高い抗体医薬品を開発することが可能となります。
我々の新しい技術は、抗体の糖鎖を均一化することで、FcγRIIIaとの結合特性を調節し、抗体の治療効果を最大化することを目指しています。今後、生化学、構造生物学への波及効果に加え、産業的にもバイオシミラー・バイオベターの開発に貢献することが期待されます。
【論文タイトル】
Systematic Preparation of a 66-IgG Library with Symmetric and Asymmetric Homogeneous Glycans and Their Functional Evaluation
対称型および非対称型均一糖鎖66-抗体ライブラリーの系統的調製と機能評価
【著者】
Shino Manabe*, Shogo Iwamoto, Satoru Nagatoishi, Asako Hoshinoo, Ai Mitani, Wataru Sumiyoshi, Takashi Kinoshita, Yoshiki Yamaguchi, and Kouhei Tsumoto
眞鍋史乃(星薬科大学:責任著者)、岩本将吾、長門石曉、星野尾麻子、三谷藍、住吉渉、木下崇司、山口芳樹、津本浩平
【掲載誌】
アメリカ化学会誌『Journal of the American Chemical Society』
doi; 10.1021/jacs.4c06558
【研究資金】
本研究は日本学術振興会科学研究費補助金(基盤研究(B)19H03357 および 24K02157)、 JST A-STEP、(公財)アステラス病態代謝研究会、AMED-BINDS(JP22ama121033)、AMED-UTOPIA(JP223fa627001)、AMED-SCARDA(JP223fa727002)などの支援を受けて行われました。
【用語説明】
注1)N-結合型糖鎖
糖鎖は、タンパク質や脂質に結合した複雑な炭水化物であり、生体内で多くの重要な役割を果たしています。特に抗体に付随する糖鎖(N-結合型糖鎖)は、N-アセチルグルコサミン、マンノース、ガラクトース、N-アセチルノイラミン酸からなる複雑な構造をしています。タンパク質アスパラギンの側鎖アミド基に結合している糖鎖をN-結合型糖鎖といいます。複雑な生合成経路から構造は不均一です。N-結合型糖鎖は、抗体の安定性、効果、及び免疫応答を調節する上で重要です。
注2)抗体依存性細胞傷害活性 (Antibody-Dependent Cellular Cytotoxicity、ADCC)
モノクローナル抗体療法において、抗体依存性細胞傷害活性は治療効果を高める重要なメカニズムです。例えば、特定のがん治療薬はADCCを介してがん細胞を攻撃します。
特定の抗原に対する抗体が標的細胞の表面に結合し、抗体のFc領域(定常部)が、ナチュラルキラー(NK)細胞やマクロファージなどの免疫細胞のFc受容体に結合します。Fc受容体が抗体を介して標的細胞を認識した後、免疫細胞はシグナル伝達を通じて活性化され、細胞毒性物質を放出します。これにより、標的細胞が破壊され、アポトーシス(細胞死)が誘導されます。
注3)FcγRIIIa (Fcガンマ受容体IIIa)
免疫システムの重要なタンパク質であり、主にNK細胞に多く発現しています。FcγRIIIaが抗体のFc領域に結合すると、NK細胞が活性化され、標的細胞の破壊が促進されます。このプロセスは、がん細胞や感染細胞の排除において非常に重要です。FcγRIIIaとの結合は、抗体の効果を左右する重要な要因であり、特に抗体医薬品の開発において、その結合力や機能性を最適化することが求められています。FcγRIIIaとの結合をはかることができるFcγRIIIaを担持させたアフィニティーカラムは、抗体のカラム保持時間が長いほどADCC が高くなる傾向があります。
注4)バイオシミラー・バイオベター
バイオシミラーは主に医療費削減を目的とし、バイオベターは患者の治療効果や利便性を向上させるために開発されます。どちらもバイオ医薬品市場において重要な役割を果たしています。バイオシミラーは、既存のバイオ医薬品(参照製品)と非常に似ているが、同一ではない生物製剤です。参照製品と比較して、同等の品質、安全性、および有効性をもつことを示すために臨床試験を行います。バイオベターは、既存のバイオ医薬品を改良し、何らかの形で性能や利便性を向上させた生物製剤です。薬剤の安定性向上、投与頻度の減少、副作用の軽減、効果の持続時間の延長などの点が改良されます。
プレスリリース本文:PDFファイル
Journal of the American Chemical Society:https://pubs.acs.org/doi/10.1021/jacs.4c06558