2024-08-26 東京大学
発表のポイント
- イヌ膀胱癌の組織に浸潤する免疫細胞を調べ、ヒトの腫瘍組織と同様に、抗がん免疫を担うT細胞の浸潤の多い「Hot tumor (熱いがん)」とT細胞の浸潤の少ない「Cold tumor (冷たいがん)」に大別できることを発見し、イヌとヒトの腫瘍免疫微小環境の類似性を明らかにしました。
- ヒトおよびイヌの患者由来検体データを用いた腫瘍免疫微小環境の探索により、ヒトとイヌに共通した新規治療標的として、膜結合型プロスタグランジンE2合成酵素-2 (mPGES-2)を発見しました。
- 本成果は、がん免疫療法の治療選択や研究開発において重要なHot/Cold tumor分類が、イヌとヒトに共通して存在していることを明らかにし、さらに、mPGES-2と呼ばれる新たな治療標的を同定しました。これらの発見は、イヌの腫瘍がヒトの腫瘍と類似性を有し、医学・獣医学双方のがん研究において重要な位置付けを有すること明らかにした先進的な研究成果です。
発表概要
東京大学 大学院農学生命科学研究科の加藤大貴 特任講師、岡山理科大学 獣医学部 獣医学科 佐伯亘平 准教授らの研究グループは、イヌの膀胱癌(注1)の組織における免疫細胞浸潤を調べ、ヒト腫瘍と同様に、T細胞浸潤の多い「Hot tumor (Immune-Inflamed tumor; 熱いがん)」とT細胞浸潤の少ない「Cold tumor (冷たいがん)」に大別できることを明らかにしました。さらに、「Cold tumor」は腫瘍間質(注2)にT細胞がとどまっている「Immune-Excluded tumor」とT細胞浸潤が乏しい「Immune-Desert tumor」に分類できることを明らかにしました。これらは、様々なヒト腫瘍においても認められている腫瘍の免疫表現系であり、同様の分類をイヌの腫瘍においても使用できることを世界で初めて発見した成果です。本成果により、これまで遅れていたイヌの腫瘍に対するがん免疫研究が飛躍的に推進されるとともに、それら成果がヒトの腫瘍への還元性を有することも明らかになりました。
さらに、免疫細胞浸潤と関連する因子を探索したところ、非ステロイド系抗炎症薬であるシクロオキシゲナーゼ(COX)阻害薬による治療を受けたイヌ症例ではT細胞浸潤が多いことを見出しました。この知見をもとに、公開されたイヌとヒトの腫瘍患者由来検体の遺伝子発現データ解析を行い、COXカスケード下流の膜結合型プロスタグランジンE2合成酵素-2(mPGES-2)がイヌとヒトで共通する新たながん免疫療法の治療標的である可能性を見出しました。
悪性腫瘍(がん)はヒトだけでなく、イヌにおいても主要な死亡原因疾患です。医学領域では免疫チェックポイント阻害薬をはじめとしたがん免疫療法が標準療法となり、これまでにない治療成績を挙げています。がん免疫療法の発展により、腫瘍細胞を取り巻く免疫環境(腫瘍免疫微小環境)(注3)が、新たな治療選択や予後予測の因子として、重要な要素となってきました。しかし、イヌの腫瘍における腫瘍免疫微小環境の解析研究は乏しく、詳細は不明でした。本研究成果では、種を超えた新たながん治療の標的を明らかにするとともに、イヌの腫瘍がヒトの腫瘍に類似した腫瘍研究モデルとして、医学・獣医学双方のがん研究において重要な位置付けを有することを明らかにしました。
発表内容
近年のがん免疫療法の進展により、腫瘍細胞を取り巻く免疫環境、すなわち腫瘍免疫微小環境(TIME)が注目を集めています。TIMEは個々の患者で異なり、治療反応性や予後と密接に関連しています。例えば、細胞傷害性T細胞が多く浸潤する患者は予後が良好である一方、細胞傷害性T細胞浸潤の少ない患者や制御性T細胞などの免疫抑制性細胞が多い患者は予後不良であることが報告されています。このようなTIMEの多様性が生まれるのは、腫瘍のステージや治療、遺伝子変異、腫瘍細胞が産生する液性因子など、様々な影響によるものと考えられています。そのため、TIMEとその調節因子を包括的に理解することは、新たな治療標的の発見や個別化医療の確立に不可欠です。
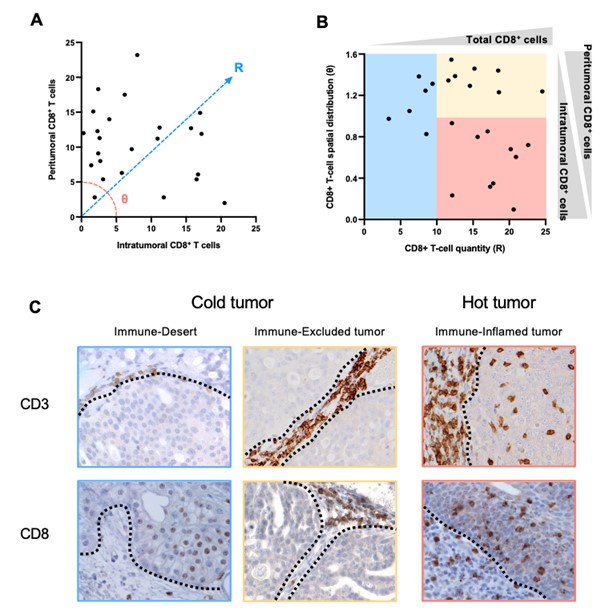
獣医学領域でもがん免疫療法の開発や臨床試験が進んでいますが、イヌの腫瘍におけるTIMEの複雑性や多様性、そしてそれらを規定する因子は明らかにされていませんでした。そこで、本研究グループはイヌの膀胱癌に着目し、腫瘍組織における様々な免疫細胞浸潤を詳細に調査しました。その結果、イヌの膀胱癌の組織におけるTIMEは、CD8+細胞傷害性T細胞の数と分布によって、Immune-Inflamed tumor、Immune-Excluded tumor、Immune-Desert tumorの 3タイプに分類できることを明らかにしました(図1)。Immune-Inflamed tumorはT細胞が豊富に浸潤することで免疫が活性化しており、ヒト腫瘍において「Hot tumor (熱いがん)」と呼ばれているタイプであると推測されました。一方、Immune-Excluded tumorではT細胞が腫瘍間質にとどまっており、がん細胞を見つけても攻撃できない状態、さらに、Immune-Desert tumor はT細胞ががん細胞を見つけられておらず、腫瘍組織内にほとんど存在していない状態であると考えられ、これらは、ヒト腫瘍において「Cold tumor (冷たいがん)」と呼ばれているタイプであると推測されました。つまり、ヒト腫瘍で報告されているTIMEの3分類(Immune-Inflamed tumor、Immune-Excluded tumor、Immune-Desert tumor)はイヌ腫瘍にも存在し、イヌとヒト間の腫瘍免疫学的な類似性が明らかになりました。
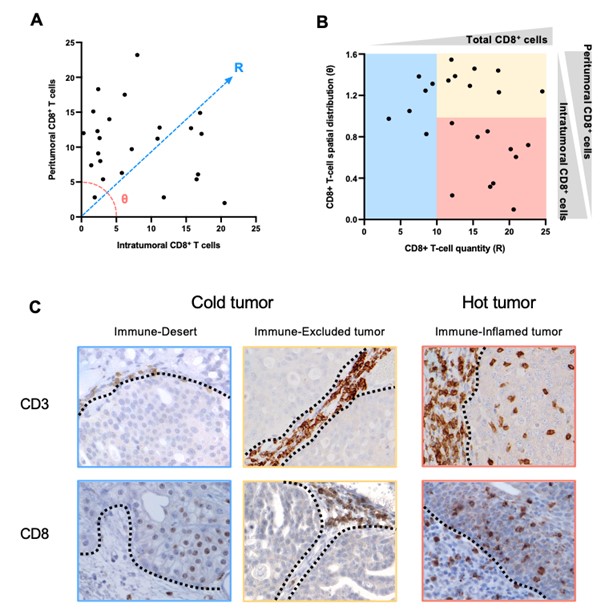
図1. イヌ膀胱癌の腫瘍免疫微小環境(TIME)解析の代表的像
A:腫瘍内および腫瘍間質におけるCD8+T細胞浸潤数を定量化し、浸潤様式を定量化した。Rスコアは平方根[(腫瘍内CD8)² + (腫瘍周囲CD8)²]、θスコアはatan(腫瘍周囲CD8/腫瘍内CD8)として定義した。
B:X軸にCD8+ T細胞の量を表すRスコア、Y軸にCD8+ T細胞の空間分布を表すθスコアを示し散布図を用いて、TIMEを3つのタイプ(Immune-Inflamed tumor、Immune-Excluded tumor、Immune-Desert tumor)に分類した。
C:TIMEの3タイプ(Immune-Inflamed tumor、Immune-Excluded tumor、Immune-Desert tumor)の組織の写真。
次に、TIMEを規定する因子を探索したところ、非ステロイド系抗炎症薬であるシクロオキシゲナーゼ(COX)阻害薬による治療を受けた症例では、受けていない症例と比較して、細胞傷害性T細胞の浸潤が有意に多いことがわかりました。イヌ膀胱癌はCOX阻害薬が比較的高い治療効果を示すこと、COXによって産生されるプロスタノイドは免疫調節機能を有することから、イヌ膀胱癌におけるTIMEの調節因子としてCOX-プロスタノイドカスケードに着目しました。イヌ膀胱癌組織のmRNAシークエンス遺伝子発現データ(注4)を解析したところ、イヌ膀胱癌組織ではCOX-2やCOX下流の膜結合型プロスタグランジンE2合成酵素-1(mPGES-1)および-2(mPGES-2)の発現が、正常膀胱組織と比較して、上昇していることがわかりました。そこで、COX-2、mPGES-1、mPGES-2の遺伝子発現量と細胞傷害性T細胞マーカーであるCD8AやGZMBの遺伝子発現量の相関を解析したところ、mPGES-2のみが負の相関を示すことがわかりました。大変興味深いことに、mPGES-2と細胞傷害性T細胞マーカーの遺伝子発現量の負の相関は、複数のヒト腫瘍においても観察されました(図2)。これらの結果は、mPGES-2がイヌ・ヒトに共通した、がん免疫療法の新しい治療標的分子である可能性を示しています。
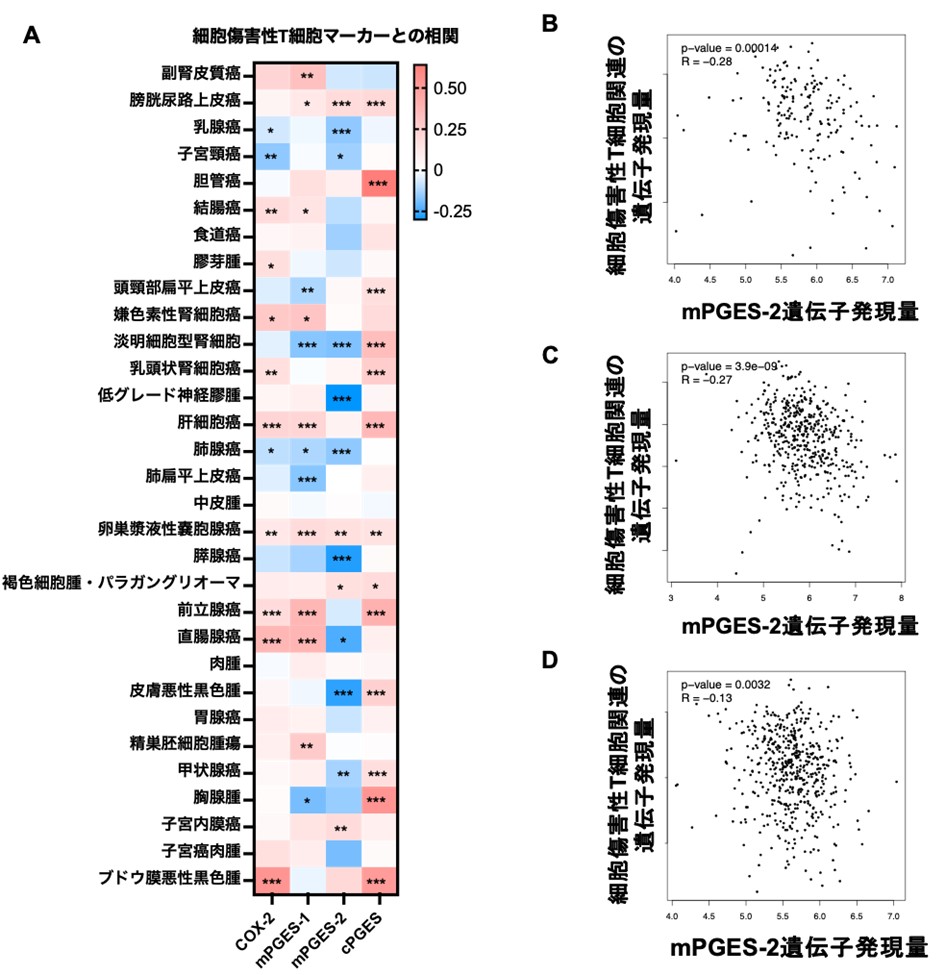
図2.ヒト腫瘍種(31種)の患者由来検体の遺伝子発現データを用いたCOX-プロスタノイドカスケード関連遺伝子と細胞傷害性T細胞関連遺伝子の発現解析結果
A:COX-プロスタノイドカスケード関連遺伝子と細胞傷害性T細胞関連遺伝子の発現の相関を解析したところ、ヒト乳癌や子宮頸癌、腎淡明細胞癌、神経膠腫、肺腺癌、膵癌、直腸癌、皮膚皮膚黒色腫、甲状腺癌で、mPGES-2の発現が高いほど、細胞傷害性T細胞の浸潤が低いことを明らかにした。青は正の相関、赤は負の相関を示し、統計値(* p<0.05, ** p < 0.01, *** p < 0.001)が小さいほど、関連が強いことを示す。
B:ヒト膵臓がんにおいて、mPGES-2の発現が高い患者ほど、細胞傷害性T細胞の浸潤が減少していた。各点は患者ごとの遺伝子発現量を示す。
C:ヒト皮膚悪性黒色腫において、mPGES-2の発現が高い患者ほど、細胞傷害性T細胞の浸潤が減少していた。各点は患者ごとの遺伝子発現量を示す。
D:ヒト甲状腺がんにおいて、mPGES-2の発現が高い患者ほど、細胞傷害性T細胞の浸潤が減少していた。各点は患者ごとの遺伝子発現量を示す。
本研究では、イヌの腫瘍はヒトの腫瘍と同様に、症例ごとに腫瘍内の免疫状態が大きく異なり多様性があること、そしてそれら免疫学的タイプを3つに分類できることを初めて明らかにし、mPGES-2と呼ばれる新たな治療標的候補を同定しました。このようなイヌ・ヒト間での腫瘍免疫学的な類似性は、イヌにおける免疫療法の開発研究のみならず、ヒトに適用可能なトランスレーショナルリサーチの確立においても極めて重要です。また、イヌの腫瘍は免疫が正常な状態で自然に発生するため、同種移植マウスモデルや免疫不全マウスを用いた腫瘍研究のモデル動物に比べて、宿主免疫を標的とした治療法の研究に適しており、本研究成果は今後の研究発展において重要な位置付けとなります。本研究では、伴侶犬は我々の日常生活の良きパートナーであると同時に、がん研究においても共に助け合える存在であることを示すことができました。
本研究成果は、米国獣医がん学会の機関誌である「Veterinary and Comparative Oncology誌」に掲載されました。
〇関連情報:
「プレスリリース①犬の尿路上皮癌に対する新規治療薬候補を発見!! ――HER2を標的とする抗体薬の効果が明らかに――」(2024/03/21)
https://www.a.u-tokyo.ac.jp/topics/topics_20240321-1.html
「プレスリリース②犬の膀胱癌の治療標的を発見!!―新たな免疫療法の臨床試験を開始―」(2021/10/22)
https://www.a.u-tokyo.ac.jp/topics/topics_20211022-1.html
発表者
東京大学大学院農学生命科学研究科 獣医学専攻
衞藤 翔太郎 博士課程(研究当時)
加藤 大貴 特任講師
チェンバーズ ジェームズ 助教
内田 和幸 教授
中川 貴之 准教授
西村 亮平 東京大学名誉教授
岡山理科大学 獣医学部 獣医学科
佐伯 亘平 准教授
論文情報
- 雑誌
- Veterinary and Comparative Oncology
- 題名
- Comprehensive analysis of the tumour immune microenvironment in canine urothelial carcinoma reveals immunosuppressive mechanisms induced by the COX-prostanoid cascade
- 著者
- Shotaro Eto, Daiki Kato*, Kohei Saeki*, Takaaki Iguchi, Qin shiyu, Satoshi Kamoto, Ryohei Yoshitake, Masahiro Shinada, Namiko Ikeda, Masaya Tsuboi, James Chambers, Kazuyuki Uchida, Ryohei Nishimura, Takayuki Nakagawa. (* 責任著者)
- DOI
- 10.1111/vco.12999
研究助成
本研究は、独立行政法人 日本学術振興会 科研費 (課題番号:18K14582, 20H03144, 23H00356, 24H00539)の支援により実施されました。
用語解説
注1 イヌの膀胱癌
イヌの下部尿路に発生する悪性腫瘍で最も頻度が多く、有効な治療法が乏しく転移性が高いため、予後1-2年のイヌの悪性腫瘍である。
注2 腫瘍間質
腫瘍組織内には、腫瘍細胞と正常細胞が混在して存在し、腫瘍細胞集塊は正常細胞に取り囲まれている。腫瘍間質は、腫瘍細胞集塊を取り囲む正常細胞の集団である。
注3 腫瘍免疫微小環境(TIME)
腫瘍組織内には、様々な種類の免疫細胞や血管や線維芽細胞など多くの正常細胞が、腫瘍細胞と共に混在して存在し、それら構成細胞の比率や種類は患者ごとに多様である。これらは患者の予後や治療反応性に大きく関連する重要な要素であり、腫瘍免疫微小環境(TIME)と呼ばれる。
注4 mRNAシークエンス遺伝子発現データ
次世代シークエンサーを用いた網羅的な遺伝子発現解析により、発現する全ての遺伝子の発現量を測定した大容量データ。
問い合わせ先
(研究内容については発表者にお問合せください)
東京大学大学院農学生命科学研究科 獣医学専攻 獣医外科学研究室 准教授
中川 貴之 (なかがわ たかゆき)
東京大学大学院農学生命科学研究科・農学部
事務部 総務課総務チーム 総務・広報情報担当(広報情報担当)