2024-12-18 国立長寿医療研究センター
国立研究開発法人国立長寿医療研究センター(理事長:荒井秀典。以下 国立長寿医療研究センター)研究所・研究推進基盤センター・実験動物管理室の由利俊祐室長(奈良先端科学技術大学院・客員准教授兼任)、有澤範恵(研究当時:奈良先端科学技術大学院・修士課程学生)、北室皓平(奈良先端科学技術大学院・修士課程学生)、磯谷綾子准教授(奈良先端科学技術大学院・器官発生工学研究室)の研究グループは、胚盤胞補完法[1]と呼ばれる技術を用いて、心臓を欠損するマウスの体内でラットの多能性幹細胞[2]由来の心臓を作り出すことに成功しました。
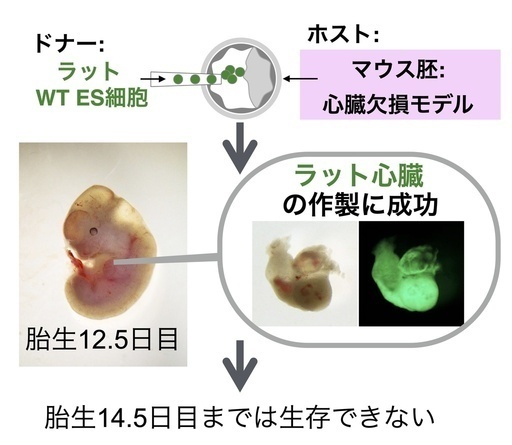
今回の研究では、心臓の発生に重要な遺伝子を欠損させ、心臓を作ることができなくなったマウスの初期胚を用いました。そして、その初期胚へラット多能性幹細胞を注入した後に、マウス子宮へ移植し、マウス体内で発生させました。その結果、マウス体内にラットの多能性幹細胞に由来する細胞が心臓の大部分を構成するキメラ動物[3]を作り出すことに成功しました。一方で、ラットの心臓を持つキメラマウスは、発生期のある時点以降で生存できなかったことから、作製された心臓は発生途中で生存に必要な機能を果たせなくなることを示唆しています(下図)。
本研究成果により、胚盤胞補完法により、異種の多能性幹細胞由来の心臓を作製することができることが明らかとなりましたが、移植可能な心臓を作製する研究を進展させるためには解決するべき問題がまだあり、この障壁を乗り越えることで、最終的には機能的な心臓ドナーの作製につながることが期待されます。
本研究は、主に、日本学術振興会(JSPS)科学研究費補助金、基盤研究 B、基盤研究 C、挑戦的研究(萌芽)、ノバルティス科学振興財団、奈良先端科学技術財団の支援を受けて行いました。この研究成果は、Cell Pressが発行する国際学術誌iScience誌に2024年11月17 日にオンライン公開され、Volume 27, Issue 12(2024 年12月20日)に掲載されます。
(DOI:10.1016/j.isci.2024.111414)
掲載論文
タイトル
Blastocyst Complementation-based Rat-derived Heart Generation Reveals Cardiac Anomaly Barriers to Interspecies Chimera Development
著者
由利俊祐1,2*,#、有澤範恵1,*、北室皓平1、磯谷綾子1,#
- 奈良先端科学技術大学院大学 先端科学技術研究科 器官発生工学研究室
- 国立長寿医療研究センター研究所 研究推進基盤センター 実験動物管理室(現所属)
*共筆頭著者 #責任著者
掲載誌
iScience (2024) DOI:10.1016/j.isci.2024.111414
背景と目的
哺乳類の心臓は、血液と酸素を全身に循環させるポンプとして機能し、生命維持に必要不可欠な臓器です。しかし、成人の心筋細胞は再生能力が乏しく、虚血性心疾患は世界中でも主要な死因となっています。心臓移植は、高齢者でもよく見られる末期心不全に対する究極の治療法ですが、臓器の提供が限られており、年間約4,000~5,000件の移植しか行われていません。そこで、ドナー不足を解決するために、動物体内でその動物の持つ発生システムを利用することで、多能性幹細胞由来の臓器を作る手法である「胚盤胞補完法」を用いた臓器作製が注目されています。過去に報告された心臓欠損モデルを用いた胚盤胞補完法では、心血管が多能性幹細胞由来ではない心臓が作製されました。そのため、主に多能性幹細胞由来の細胞が構成する心臓を作製するためには、新たな心臓欠損モデルが必要とされてきました。そこで、本研究では、新たな心臓欠損モデルを樹立することにより、異種であるラット多能性幹細胞が主に構成する心臓をマウスとラットの異種間キメラ動物体内で作製する事を目的とし、研究を始めました。
研究成果
まず、キメラ動物体内で野生型の細胞が心臓を構築するモデルを探索するために、心臓中胚葉の形成に関わる転写因子(Mesp1)とそのファミリー遺伝子(Mesp2)に着目し、Mesp1遺伝子欠損モデルとMesp1/Mesp2遺伝子の二重欠損モデルを評価しました。その結果、Mesp1遺伝子欠損モデル内において、心臓はMesp1欠損細胞と野生型の細胞が入り混じる状態となったことから、Mesp1遺伝子欠損モデルは野生型細胞が心臓を置換するモデルとして適さないことがわかりました。一方で、Mesp1/Mesp2遺伝子の二重欠損細胞は心房の一部に寄与しましたが、心血管を含め心室にはほとんど寄与できず、心臓の大部分が野生型細胞により構成されていることがわかりました。また、このキメラ動物は生後56日目間にわたり通常のマウスと同様に生存することができたことから、Mesp1/2遺伝子欠損細胞が心房に存在していても、心臓の機能には影響がないことが考えられました。
次に、Mesp1/2遺伝子欠損マウスを作製し、その初期胚へラットES細胞を注入し、ラット由来の心臓をマウス体内で作製できるかを調べました。その結果、Mesp1/2遺伝子欠損マウスは心臓を持たないため胎生8.5日目までに致死となりましたが、ラットES細胞を注入したMesp1/2遺伝子欠損胚は、胎生8.5日目を超え、胎生12.5日目でも確認することができることがわかりました。また、Mesp1/2欠損胚がもつ心臓を解析したところ、心房組織も含め心臓のほとんどがラット細胞に由来することがわかりました。この結果は、ラットの細胞は、マウスの細胞よりも心房組織に寄与する能力が高いことを示すと考えられます。以上の結果から、異種胚盤胞補完法により、マウスの体内でほとんどがラット多能性幹細胞由来の機能を持つ心臓を作り出すことができることがわかりました。一方で、このラット由来の心臓を持つ異種間キメラ動物は、胎生14.5日目までは生存しないことがわかりました。このことから、異種胚盤胞補完法で作り出されたラットの心臓は胎生8.5日目から12.5日目までは機能を持つ一方で、胎生12.5日目から14.5日目の間で生存に必要な機能を失う可能性が考えられました。
今後の展開
今回の研究では、異種胚盤胞補完法により、心臓欠損モデルマウスの体内でラット多能性幹細胞由来の心臓を作り出せることを明らかにしました。しかしながら、作り出された心臓は発生の過程で機能を失うことが明らかとなりました。このことから、胚盤胞補完法により、機能的な異種の心臓を作製するためには、種特異的な心臓の機能を考慮する必要性があると考えられます。機能的な心臓の作製にはさらなる研究が必要ですが、マウスとラットの異種間キメラ体内でラット多能性幹細胞由来の心臓を作れることを示せたことは、将来的に、ヒトと動物間での胚盤胞補完法による心臓作製の可能性を示すものであり、再生臓器の移植医療の発展に貢献するものと期待されます。
用語解説
[1] 胚盤胞補完法
臓器が欠損する初期胚(胚盤胞期胚)へ多能性幹細胞を注入し、代理母の子宮へ移植することで、多能性幹細胞が、本来欠損するはずの臓器を作り出す方法。動物の発生システムを利用し、動物体内で臓器を作製するため、三次元構造を持つ多能性幹細胞由来の臓器を作製することができる。
[2] 多能性幹細胞
胎盤以外の生体のどの組織にもなる能力(多能性)を持つ細胞のこと。胚性幹細胞(ES細胞)や人工多能性幹細胞(iPS細胞)などがある。
[3] キメラ動物
1つの個体中に2つ以上の異なる遺伝型を持つ細胞が含まれる動物のこと。
リリースの内容に関するお問い合わせ
研究に関すること
国立長寿医療研究センター研究所 研究推進基盤センター 実験動物管理室 室長 由利俊祐
奈良先端科学技術大学院大学 先端科学技術研究科 バイオサイエンス領域 器官発生工学研究室 准教授 磯谷綾子
報道に関すること
国立長寿医療研究センター総務部総務課 総務係長(広報担当)