DNA修復メカニズムを標的にした抗がん剤開発への応用に期待
2018-05-08 国立研究開発法人量子科学技術研究開発機構
発表のポイント
- 放射線などにより生じ、細胞死やがん化を引き起こす恐れがある、DNA二重鎖切断の傷を修復するDNA相同組換え1)には、RAD52タンパク質のアセチル化修飾2)が必要なことを解明した
- 特定の遺伝子発現を抑制して乳がんの状態を再現した細胞でRAD52アセチル化修飾を阻害すると細胞増殖が抑制された
- RAD52のアセチル化修飾を阻害する作用をもつ、新たな抗がん剤開発への応用が期待される
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)放射線医学総合研究所の安田武嗣主任研究員と田嶋克史客員協力研究員(同研究所 元被ばく医療研究部長)らは、明星大学理工学部香川亘准教授らのグループ等との共同研究で、DNA二重鎖切断の傷を修復するためには、タンパク質のアセチル化修飾が重要であるという、DNA修復3)の新たなメカニズムを明らかにしました。
生命の設計図であるDNAは、二つの糸がらせん状に絡まり合った二重鎖構造をしています。DNAは、紫外線や放射線、抗がん剤などの外的要因や、生物の代謝によって生じる活性酸素などの内的要因により日常的にも様々な損傷を受けていますが、中でも、二つの鎖が同時に切れるDNA二重鎖切断は、生物にとって重篤な障害で、細胞死やその修復過程で細胞のがん化を引き起こす恐れがあります。
そのため、生物は傷ついたDNAを修復するための機能を備えており、その機能はDNA修復タンパク質がリン酸化などの修飾をされることで制御されることがわかっています。しかし、アセチル化修飾については、どのDNA修復タンパク質が修飾されるのかや、DNA修復における機能については十分に解明されていませんでした。
今回の研究では、ヒストンアセチル化修飾酵素によりアセチル化されるDNA修復タンパク質を探索し、DNA二重鎖切断を修復する方法の一つであるDNA相同組換えにおける役割を解析しました。
その結果、RAD52がアセチル化修飾されることと、それによりDNA相同組換えが進むメカニズムを明らかにしました。さらに、乳がんの原因の一つとして知られているBRCA2遺伝子の発現を抑制した細胞では、RAD52がアセチル化修飾されないと細胞の増殖が抑制されることもわかりました。
これらの発見は、ヒトのDNA二重鎖切断の修復メカニズムに新たな知見を与えるとともに、抗がん剤開発といった将来的ながん治療にも有益な情報となる成果です。
本成果は、2018年3月28日に米国科学誌「PLOS Genetics」で公開されました。
本研究は、文部科学省科学研究費補助金、双葉電子記念財団自然科学研究助成、長崎大学原爆後障害医療研究所共同利用・共同研究、放射線災害・医科学研究拠点 共同利用・共同研究、神戸大学バイオシグナル総合研究センター共同利用・共同研究などの支援を受けて行われました。
補足説明資料
研究開発の背景と目的
細胞内のDNAは、ヒストンタンパク質4)の周りに巻き付いて折り畳まれたクロマチン構造を形成しています。DNAからタンパク質が作られる際には、ヒストンアセチル化酵素によりヒストンタンパク質がアセチル化修飾され、ヒストン構造が変化してDNAの巻き付きが緩むことが知られています。
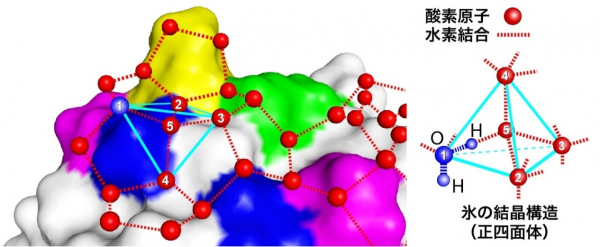
また、DNAが損傷した際にも、ヒストンタンパク質がアセチル化修飾されて損傷部位のDNAの巻き付きが緩められ、DNAの損傷に応答する様々なタンパク質が集まり、リン酸化やユビキチン化、SUMO化などの修飾をされます。これまでに、これらの修飾経路上で働くタンパク質や、DNA修復などの働きについては多くの知見が得られています(図1)。
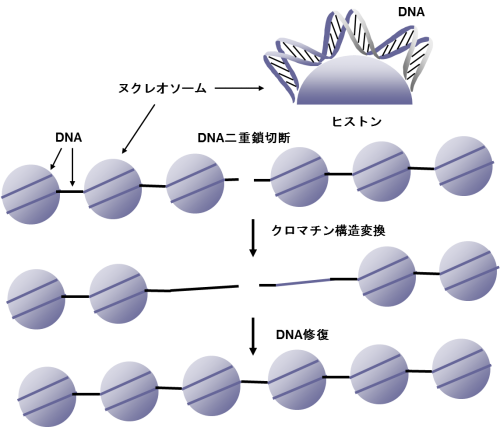
図1 クロマチンレベルで見たDNA修復メカニズム
一方、アセチル化については、一部のDNA損傷応答タンパク質が修飾されることはわかっているものの、リン酸化修飾などの他の修飾経路ほどには十分に解明されていませんでした。そこで、本研究では、ヒストンアセチル化酵素によりアセチル化される新たなDNA修復タンパク質を探索し、DNA損傷応答における役割を解析しました。
研究の手法と成果
(1) アセチル化される非ヒストン性DNA修復タンパク質の同定
精製したヒストンアセチル化酵素のp300とCPBを用いて、ヒトDNA修復タンパク質に対するタンパク質修飾実験を行いました。その結果、RAD52がアセチル化修飾されることを明らかにしました。
(2) RAD52のアセチル化修飾部位の同定とDNA相同組換えにおける役割の解析
アセチル化修飾は、タンパク質を構成するアミノ酸の中でリジン(K)の場所で起こります。そこで、RAD52のアセチル化修飾がどのリジンで起きているのかを質量分析法を用いて調べた結果、13箇所のリジンが、アセチル化修飾されており、そのうちカルボキシル末端側(C末側)の3つのリジンは、RAD52が核の中に移動するのに必要なアミノ酸配列(核移行シグナル配列)の中に存在していることがわかりました(図2A)。
RAD52には、DNA二重鎖切断を修復する方法の一つである、DNA相同組換えにおいて、切断部位に生じた一本鎖DNAに結合する役割があることが知られています。そこで、RAD52の核移行シグナル配列以外の10箇所のリジンをアセチル化修飾されないアルギニン(R)に置き換えたタンパク質(10xR変異タンパク質、図2B)とアセチル化修飾される野生型RAD52タンパク質を用いたタンパク質修飾実験や、これらのタンパク質が作られる培養細胞(10xR変異細胞および野生型細胞)を用いたDNA二重鎖切断実験を行いDNA相同組換えにおけるRAD52のアセチル化の影響を調べました(図2C)
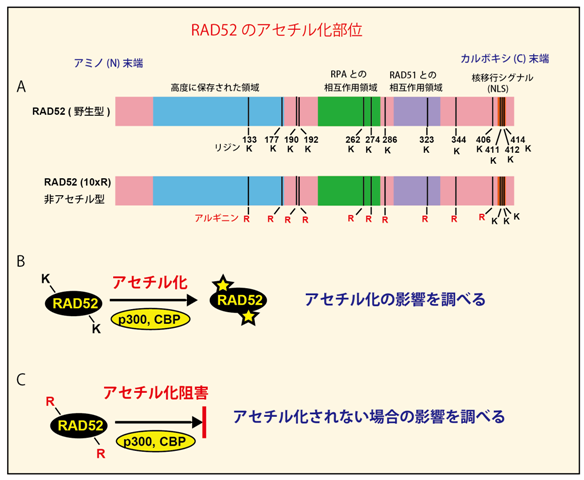
図2 RAD52のアセチル化修飾部位の同定とアセチル化修飾の影響を調べるための手法
その結果、RAD52がアセチル化される場合では、損傷部位に集まったRAD52がp300とCPBによってアセチル化修飾されることにより、DNA相同組換えに必要なRAD51タンパク質や一本鎖DNAとの相互作用が強まることで、RAD51とRAD52が損傷部位から離れずにDNA修復が進み、その過程で脱アセチル化酵素のSIRT2とSIRT3によりRAD52が脱アセチル化されてDNA相同組換えが進むメカニズムが示唆されました(図3A)。これに対してRAD52がアセチル化されない場合では、RAD51、RAD52、p300、CBPが損傷部位に一旦は集まるものの、時間の経過とともにRAD51とRAD52が損傷部位から離れてしまいDNA相同組換えが阻害されることがわかりました(図3B)。
これらのことは、RAD52のアセチル化がDNA相同組換えによるDNA二重鎖切断の修復に必要であることを示しています。
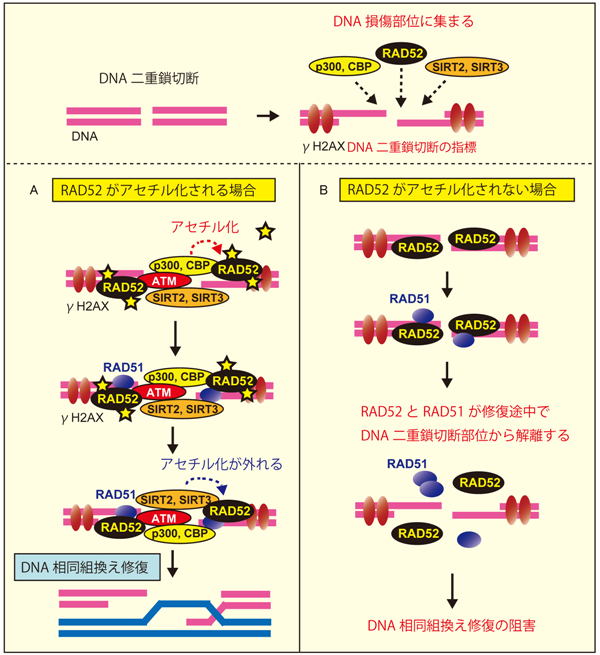
図3 RAD52のアセチル化修飾とDNA相同組換えのメカニズム
(3) RAD52のアセチル化阻害による細胞増殖への影響
最近、RAD52は抗がん剤の標的として注目されつつあることから、RAD52のアセチル化修飾の有無が細胞増殖に与える影響を、乳がんの原因遺伝子の一つであるBRCA2遺伝子の発現を阻害することにより、遺伝子的に乳がん細胞と同じ状態の細胞で調べました。その結果、BRCA2の発現とRAD52のアセチル化修飾の両方を阻害することにより、細胞増殖が抑制されることがわかりました(図4)。
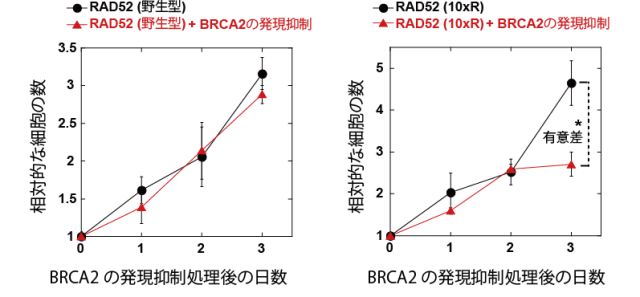
図4 RAD52のアセチル化阻害とBRCA2の発現抑制による細胞増殖阻害
今後の展開
DNA相同組換えについては、それに関わるいくつものタンパク質が明らかになってきていますが、それらのタンパク質がどのように働いてDNAが修復されるのかについては、まだほとんどわかっていません。ゲノム5)情報の安定維持に必要なDNA相同組換えは、発がんやがん抑制のメカニズムと密接に関係しているため、その仕組みを明らかにすることが必要です。このことは、DNA相同組換えを利用した高精度なゲノム編集6)技術による品種改良や遺伝子治療への応用が期待されます。
また、乳がんの原因遺伝子の一つとして知られているBRCA2遺伝子の発現が阻害された細胞で、RAD52のアセチル化修飾も阻害されると、細胞増殖が抑制されたことから、BRCA2遺伝子変異が原因のがんに対して、RAD52のアセチル化修飾を阻害するという新たなコンセプトの抗がん剤の開発への応用が期待されます。
用語解説
1)DNA相同組換え
DNAの塩基配列がよく似た相同な部位で起こる、DNAの組換え反応であり(図5)、DNAの二本鎖が切断された場合の修復機構の一つです。DNA相同組換えでは、最初に切断されたDNA末端が削られて突出した一本鎖DNAが生じる反応が起こります。次に、突出した一本鎖DNAが、損傷を受けていない相同なDNA鎖と付合する反応が起こります。それと同時に、相同なDNAの情報を鋳型として、DNAを合成する反応が起こります。最後に、組換え反応によって交わったDNAが切り離されます。
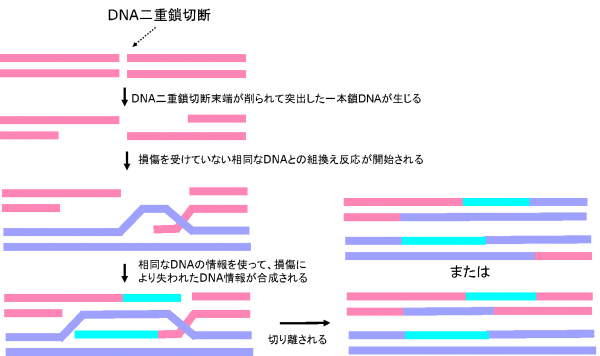
図5 DNA相同組換によるDNA二重鎖切断の修復
相同鎖の交換反応には、RAD51タンパク質が中心的な役割を担っています。酵母では、Rad52が酵母のRad51を突出した一本鎖DNAに呼び込むための役割を担っています。一方、ヒトでは、酵母には存在しないBRCA2が同様の役割をしていると考えられおり、ヒトのRAD52の相同組換えにおける役割は十分には明らかになっていませんでした。
2)アセチル化修飾
細胞内のタンパク質は、様々な修飾を受けています。タンパク質修飾は、タンパク質の活性や細胞内の安定性などの調節に重要な役割を果たしています。アセチル化は、タンパク質のリジンのアミノ酸にアセチル基(CH3CO-)が付加するタンパク質修飾の一つです(図6)。ヒストンアセチル化酵素によってアセチル化が起こり、ヒストン脱アセチル化酵素によりアセチル基が除去される脱アセチル化が起こります。

図6 アセチル化と脱アセチル化
3)DNA修復
DNAは、電離放射線、紫外線、活性酸素、化学物質などにより、様々な損傷を受けます。生物には、DNAの損傷に応じて、適切に損傷を直すために、複数のDNA修復の機構が備わっています。
4)ヒストンタンパク質
ヒトや酵母などの真核生物で、細胞内の長いDNAを巻きつけて、コンパクトに核内に収容する役割を担っています。ヒストンは、アセチル化などの修飾を受けます。ヒストン修飾は、遺伝子発現の制御などに関わっています。
5)ゲノム
染色体に含まれる遺伝情報全体のことです。
6)ゲノム編集
細胞中のDNA配列の特定の場所を切ることによって、ゲノムを思い通りに改変することができる技術です。ゲノム編集では、DNA切断部位の両端と相同な配列を末端に含むDNA断片を外から細胞に導入することによって、このDNA断片(ドナーDNA)をDNA切断部位に導入することができます。この技術(ノックイン)により、ゲノム中の特定の遺伝子を外から導入されたドナーDNAと置き換えて改変することができます。細胞内では、この置き換え反応に、DNA相同組換え修復が使われています。そのため、ゲノム編集によるノックイン効率を上げるためには、DNA相同組換えによる修復効率を上げるための工夫が必要であると考えられています。