新しい男性不妊治療法の開発に向けて
2018-10-15 京都大学
坂本智子 iPS細胞研究所特定研究員、タムケオ・ディーン 医学研究科特定准教授、成宮周 名誉教授(医学研究科特任教授)らの研究グループは、精巣内のセルトリ細胞表層にある細胞骨格アクチンの網目状構造によって、正常な精子の形態が形成される分子メカニズムを解明しました。
本研究成果は、2018年9月26日に米国の国際学術雑誌「PLOS Biology」のオンライン版に掲載されました。
研究者からのコメント
近年、少子化が社会的な問題になっており、不妊の診断及び治療が喫緊の課題です。これまでの研究により、不妊の約半分は男性不妊であることが明らかになりましたが、その多くは原因がまだ不明のままです。本研究によって明らかになったセルトリ細胞におけるmDia1/3機能の知見は、今後の男性不妊の診断及び治療開発に応用されることが期待されます。
概要
不妊の原因の約半数を占める男性不妊の原因の多くは精子形成障害ですが、その原因が不明なため、根本的な治療法はないのが現状です。しかし、正常な精子の形成には、精子細胞と、精巣内に存在する支持細胞であるセルトリ細胞との密接な相互作用が重要であることが分かっていました。
本研究グループは、この精子細胞とセルトリ細胞の細胞間接着を強化する細胞骨格アクチンの構造が、アクチンの重合を促進するmDia1およびmDia3タンパクによって作られ、正常な精子の形態形成に寄与していることを見出しました。このmDia1およびmDia3を二つとも欠損すると、精子細胞とセルトリ細胞の接着形成・維持に障害をきたし、精子の形成不全が起きることも確認しました。
本研究成果は、セルトリ細胞内のアクチン細胞骨格系の異常が男性不妊の原因の一つとなることを示唆するものであり、新しい男性不妊の治療法の開発につながる可能性を提示するものです。
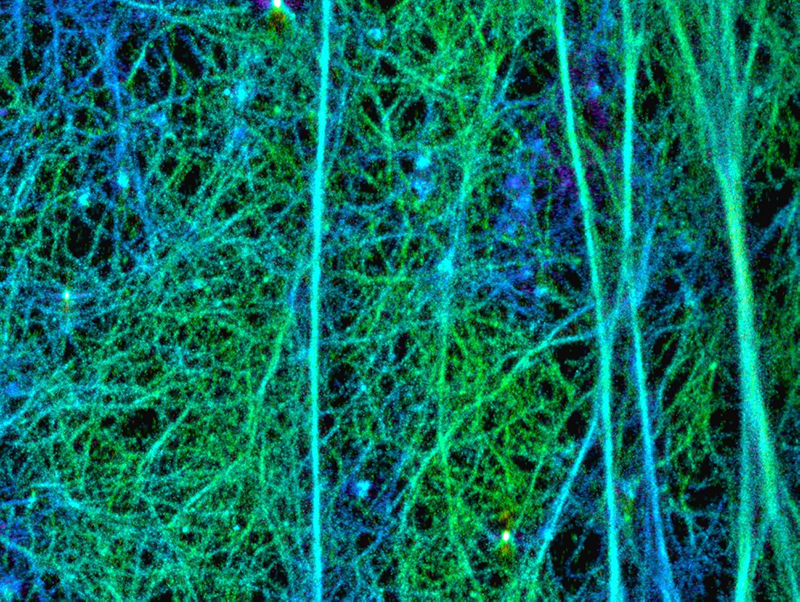
図:セルトリ細胞皮質下アクチン繊維構造の超解像度イメージング
詳しい研究内容について
精子形態形成の分子メカニズムを 超解像度顕微鏡と一分子イメージングで解明 ―新しい男性不妊治療法の開発に向けて―
概要
京都大学大学院医学研究科創薬医学講座の坂本智子 特定研究員(研究当時、現:iPS 細胞研究所特定研究 員)、タムケオ・ディーン 同特定准教授、成宮周 同特任教授らの研究グループは、精巣内に存在するセルト リ細胞の表層にある網目状の細胞骨格アクチンの構造が、アクチン重合活性を持つ mDia1 及び mDia3 タンパ クによって作られ、セルトリ細胞と精子細胞の細胞間接着を形成 ・維持することで、正常な精子の形態形成に 寄与していることを見出しました。本研究成果は、セルトリ細胞内のアクチン細胞骨格系の異常が男性不妊の 原因の一つとなることを示唆するものであり、新しい男性不妊の治療法の開発につながる可能性を提示してい ます。
本研究成果は、2018 年 9 月 26 日に米国の国際学術雑誌「PLOS Biology」にオンライン掲載されました。
1.背景
妊娠を望むカップルのうち約 10〜15%が不妊であり、その約半数は男性側に原因があると考えられていま す。男性不妊の原因の多くは精子形成障害ですが、その半数は原因が分からないため、根本的な治療法がない のが現状です。
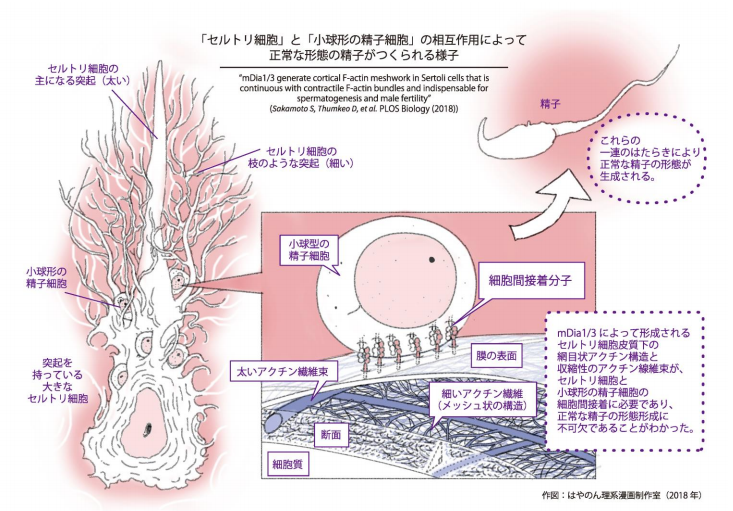
独特の形をしている精子は精巣で小球形の精子細胞から作られていることが知られています。これまでの研 究報告から、正常な精子の形成には精子細胞と精巣内に存在している支持細胞であるセルトリ細胞の密接な相 互作用が重要であることが分かっていました。その際、形成される精子細胞〜セルトリ細胞間接着は、細胞間 接着分子と裏打ちの細胞骨格アクチンから構成されていますが、生体内においてこの裏打ちアクチンがどのよ うな構造をしているのか、そして、どのように形成 ・維持されるのかについてはほとんど分かっていませんで した。また、生理的な意義についてもその全容は明らかではありませんでした。
mDia は細胞骨格アクチンの重合促進分子で、ヒトにおいて mDia1, 2, 3 の 3 つのアイソフォーム(構造は 異なるものの同じ機能を持つタンパク質)が存在していますが、生体内における機能は不明でした。当研究室 の過去の研究から、mDia1, 3 が重複的に働くことが分かっていたので、mDia1/3 二重欠損マウスの解析を行 ったところ、雄性不妊を呈することを見出しました。そこで、本研究では、mDia1/3 のアクチン重合活性によ って形成されるアクチン構造を明らかにし、雄性不妊との関連を解明することを目的に研究を行いました。
2.研究手法・成果
まず、mDia1/3 二重欠損マウスの精子と精巣の観察から、雄性不妊の原因が精子形成不全にあることが分か りました。精子形成には精子細胞とセルトリ細胞間の密接な相互作用が重要であると考えられています。 mDia1/3 は主にセルトリ細胞に発現していることが分かったため、精原細胞移植実験を行い、精子細胞側では なく、セルトリ細胞内の mDia1/3 欠損が精子形成不全の原因であることを確認しました。
次に、セルトリ細胞内の mDia1/3 の働きを明らかにするために、超解像度顕微鏡を用いて、初代培養セル トリ細胞のアクチン線維をナノメートル(10 億分の 1 メートル)単位の解像度で観察しました。その結果、 セルトリ細胞膜直下にメッシュの孔のサイズが約 100 ナノメートルの網目状アクチンの構造が存在し、この アクチン構造は、mDia1/3 の二重欠損や薬剤による mDia の不活性化により破綻することが分かりました。次 に、網目状アクチンの動態を観察するため、初代培養セルトリ細胞内のアクチン線維を蛍光標識し、スピニン グディスク共焦点顕微鏡で高速ライブイメージングを行いました。その結果、網目状アクチン構造を構成する アクチン繊維の重合速度には、平均 0.4μm/s と 1.3μm/s の 2 種類が混在し、mDia1/3 欠損細胞では速い重 合速度 (1.3μm/s)を示すアクチン繊維だけが消失していることが分かりました。この速度は、一分子イメー ジングから計算した mDia3 のアクチン重合速度とほぼ同じでした。これらのことから、mDia1/3 は網目状ア クチン構造の形成・維持に寄与していると考えられます。
これまでの培養細胞を用いた研究では、収縮性のあるアクトミオシン線維束は細胞間接着の形成 ・維持に重 要であることが知られていました。本研究では、超解像度顕微鏡を用いた解析により、初代培養セルトリ細胞 において mDia 依存的な網目状アクチン構造を構成するアクチン繊維は、収縮性のあるアクトミオシン線維束 とつながっていることを見出しました。さらに、mDia1/3 二重欠損セルトリ細胞ではアクトミオシン線維束が 有意に減少し、収縮性のない Espin 結合アクチン線維束が増加していることを突き止めました。これらの結果 は、mDia1/3 二重欠損セルトリ細胞と精子細胞の細胞間接着の障害を示唆していますが、in vitro(人工的環 境下)再構築系を用いて、セルトリ細胞〜精子細胞間接着の評価を行ったところ、mDia1/3 二重欠損セルトリ 細胞は精子細胞と正常な細胞間接着をほとんど形成していないことが確かめられました。これらのことから、 mDia1/3 二重欠損は、収縮性アクトミオシン線維束の減少と非収縮性の Espin 結合性アクチン線維の増加を きたし、セルトリ細胞〜精子細胞の接着形成・維持に障害をきたすと考えられます。
以上、精子形成過程において、mDia1/3 はセルトリ細胞内で、網目状アクチンを重合させ、それに連続する 収縮性アクトミオシンを作り出し、セルトリ細胞〜精子細胞間接着を形成 ・維持することで、正常な精子の形 態形成に寄与していることが明らかになりました。
3.波及効果、今後の予定
本研究成果は、正常な精子の形態形成には、セルトリ細胞の表層にある mDia1/3 が重合する網目状アクチ ン構造とそれにつながっている収縮性のアクトミオシン線維束を介した、セルトリ細胞と精子細胞間接着の形 成 ・維持が重要であることを明らかにしました。このことは、セルトリ細胞内のアクチン細胞骨格系の異常が 男性不妊の原因の一つになりうることを示唆しています。男性不妊の原因の多くを占める精子形成障害のうち、 約半数は原因不明です。雄性不妊の原因の一端を解明した本研究は、一部の男性不妊の新しい治療法開発の糸 口になる可能性が期待されます。
4.研究プロジェクトについて
本研究は、下記機関より資金的支援を受けて実施されました。
●日本学術振興会 (JSPS) 基盤研究 S 「mDia が紡ぐアクチン細胞骨格の個体生理での役割と分子メカ ニズムの解析」(研究代表者:成宮周)
●小野医学研究財団研究奨励助成金(研究代表者:タムケオ ディーン)
なお、本研究は京都大学大学院医学研究科機能微細形態学分野(斎藤通紀教授)、京都大学大学院医学研究 科神経細胞薬理学分野 (渡邊直樹教授)、大阪大学微生物学研究所遺伝子機能解析分野 (伊川正人教授)、基礎 生物学研究所生殖細胞研究部門 (吉田松生教授)及び国立シンガポール大学メカノバイオロージー研究所 (カ ンチャナウォン・パコン准教授)との共同で行われました。
<論文タイトルと著者>
タイトル:mDia1/3 generate cortical F-actin meshwork in Sertoli cells that is continuous with contractile F-actin budles and indispensable for spermatogenesis and male fertility(mDia1/3 はセルトリ 細胞内において、細胞皮質下網目状アクチンとそれに連続する収縮性アクチン線維束を形成し、 精子形成と雄性生殖能に不可欠である)
著 者:Satoko Sakamoto, Dean Thumkeo, Hiroshi Ohta, Zhen Zhang, Shuangru Huang, Pakorn Kanchanawong, Takayoshi Fuu, Sadanori Watanabe, Kentaro Shimada, Yoshitaka Fujihara, Shosei Yoshida, Masahito Ikawa, Naoki Watanabe, Mitinori Saitou, Shuh Narumiya
掲 載 誌:PLOS Biology DOI:10.1371/journal.pbio.2004874
書誌情報
京都新聞(10月12日 29面)および毎日新聞(10月16日 26面)に掲載されました。