2018-10-19 理化学研究所
理化学研究所(理研)環境資源科学研究センターケミカルバイオロジー研究グループの大高潤之介基礎科学特別研究員、清水猛上級研究員、長田裕之グループディレクターと創発物性科学研究センター物質評価支援チームの橋爪大輔チームリーダーらの研究チーム※は、モデルキノコ[1]のウシグソヒトヨタケ(Coprinopsis cinerea)[2]が産生する新しい生理活性物質であるヒトヨポディン類の発見と合成に成功しました。
本研究成果は、キノコ由来天然物を活用した創薬研究に貢献すると期待できます。
菌類や植物が産生する種の特異的な代謝物質(二次代謝産物[3])は構造的に多様であり、有用な生理活性を持つものも多く、医薬創生に大きく貢献しています。ヒトヨタケ(一夜茸)属キノコは名前の通り、子実体[1]形成までの期間が短いことから分子生物学的研究に多く使用されていますが、化学的には未開拓な環境資源でした。
今回、研究チームは、ウシグソヒトヨタケの培養液抽出物から特徴的な骨格を持つ二次代謝物質の探索を行いました。その結果、目的化合物の取得に成功し、その絶対立体配置[4]を有機合成と単結晶X線結晶構造解析[5]により完全に決定し、「ヒトヨポディンA」と命名しました。さらに、生理活性試験の結果、ヒトヨポディンAは白血病細胞HL-60とマラリア原虫に対し、生育阻害活性を示すことが明らかになりました。
本研究は、米国の科学雑誌『Organic Letters』(10月5付け:日本時間10月6日)に掲載されました。

図 ウシグソヒトヨタケが一夜で子実体成熟するまで(左)とヒトヨポディンAの構造(右)
※研究チーム
理化学研究所
環境資源科学研究センター ケミカルバイオロジー研究グループ
基礎科学特別研究員 大高 潤之介(おおたか じゅんのすけ)
上級研究員 清水 猛(しみず たけし)
研究員 二村 友史(ふたむら ゆうし)
グループディレクター 長田 裕之(おさだ ひろゆき)
創発物性科学研究センター 物質評価支援チーム
チームリーダー 橋爪 大輔(はしづめ だいすけ)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金 基盤研究A「ケミカルバイオロジー研究が解き明かすテヌアゾン酸の3W1H(研究代表者:長田裕之)」、同 新学術領域研究(研究領域提案型)「化学コミュニケーションのフロンティア(領域代表:掛谷 秀昭)」「プロテオミクスをベースにした化学シグナル解析技術開発(研究代表者:長田裕之)」、生物系特定産業技術研究支援センター「イノベーション創出強化研究推進事業」の支援のもと行われました。
背景
菌類や植物が産生する二次代謝産物(天然物)は、多種多様な骨格や生理活性を持っています。こうした天然物の化学構造や作用機序を足がかりにして、これまで創薬研究が行なわれてきました。
天然物の大きなグループの一つであるセスキテルペノイド[6]のうちクパレン[6]型は、コケ、海藻、キノコ、ウミウシなど幅広い生物から見いだされています。クパレンは酸化的修飾を受けることで、構造多様性や新しい生理活性を獲得します。そのなかでも、エノキタケ(Flammulina velutipes)とヒトヨタケ属(Coprinopsis sp.)は形状、生態学的にも大きく離れていますが、構造的に関連したクパレン型セスキテルペノイドのエノキポディンBとラゴポディンAをそれぞれ産生することが知られています(図1上段左・右)。
2017年、大高基礎特別研究員らはウシグソヒトヨタケ(Coprinopsis cinerea)の培養液抽出物から、セスキテルペノイドよりも炭素数が1個少ないノルセスキテルペノイドのヒトヨールAとヒトヨールB(どちらも世界で初めて見いだされた骨格を持つ)を発見し(図1下段中・右)、両化合物はラゴポディンAを経由して生合成されると予想しています注1)。一方、エノキタケについては、エノキポディンBの予想前駆体であるエノキポディンA(ベンゾキサビシクロ[3.2.1]オクタン骨格を持つ;図1上段中)が抗菌物質として知られており、多くの有機合成が試みられてきました。
研究チームは、ヒトヨタケ類がラゴポディンAの親化合物である特異的なベンゾキサビシクロ[3.2.1]オクタン骨格を持つ化合物を産生する能力があると予測しました(図1下段左)。その化合物“X”を見つけることは、さらなる生理活性の調査、生合成研究にとって極めて重要です。
注1)Junnosuke Otaka, Daisuke Hashizume, Yui Masumoto, Atsuya Muranaka, Masanobu Uchiyama, Hiroyuki Koshino, Yushi Futamura, and Hiroyuki Osada (2017) Hitoyol A and B, Two Norsesquiterpenoids from the Basidiomycete Coprinopsis cinerea. Organic Letters 19: 4030-4033.
研究手法と成果
研究チームはまず、液体クロマトグラフィー・質量分析法(LC/MS)[7]を用いて、ウシグソヒトヨタケの培養液抽出物から化合物“X”を探索しました。その結果、3種の候補物質(1-3)がヘキサン相と酢酸エチル相に検出されたため、各種精製法により単離しました(図1下段左)。質量が目的化合物と合致した1(天然1)の化学構造は、各種スペクトル解析により決定しました。
さらに、天然1の絶対立体配置を決定し、詳しい生理活性を調査するために、原料の2,5-ジメトキシトルエンから出発し、得たエノキポディンBのシクロプロパノンのケトン位置を1,2-シフトさせる反応を開発し、全合成を達成しました(合成1)。合成1と天然1の比旋光度[8]が一致したため、その絶対立体配置を7S,9Sと決定し、「ヒトヨポディンA」と命名しました(図2)。また、その絶対立体配置は単結晶X線結晶構造解析の結果とも一致しました(図2)。化合物2と3の構造は、解明したヒトヨポディンAの構造と物理化学的データを比較することにより15位と13位のメチル基がそれぞれ水酸化された15-ヒドロキシ-ヒトヨポディンA、13-ヒドロキシ-ヒトヨポディンAと決定しました。
次に、得られた化合物群の生理活性を調べたところ、ヒトヨポディンAは白血病細胞HL-60(IC50[9]=3.7マイクロモーラー[μM]、1μMは100万分の1M)とマラリア原虫(IC50=6.7μM)に対し、生育阻害活性を示すことが明らかになりました。その一方で、それぞれ水酸基がさらに一つ導入された2と3は、ヒトヨポディンAに比べて生育阻害活性が著しく弱くなることも判明しました。
注目すべき現象に、同キノコ培養時にヒトヨポディンAの産生が確認できないときがあり、その際大量のラゴポディンBが産生されました。この理由について、研究チームはヒトヨポディンAが酸化酵素のフェノールオキシダーゼ[10]によって、迅速にラゴポディン類に変換されるのではないかと考えています(図3)。したがって、ヒトヨタケ類が放出するフェノールオキシダーゼの量により、蓄積するヒトヨポディン類、あるいはラゴポディン類の量が左右されると予想されます。また、今回の合成実験により、クパレンの酸化位置によりヒトヨポディンAになるかエノキポディンAになるかを左右することが間接的に証明されました(図3)。
今後の期待
本研究成果は、天然物骨格の多様化のメカニズムについての理解を深め、異なる生理活性を持つ化合物デザインの一助となります。さらに、使用したウシグソヒトヨタケの未利用資源としての役割が大いに期待できます。今後、私たちは創薬研究への貢献を目指して、ヒトヨポディン類やヒトヨール類の詳細な生理活性や生合成経路などを明らかにしていく予定です。
原論文情報
Junnosuke Otaka, Takeshi Shimizu, Yushi Futamura, Daisuke Hashizume, and Hiroyuki Osada, “Structures and Synthesis of Hitoyopodins: Bioactive Aromatic Sesquiterpenoids Produced by the Mushroom Coprinopsis cinerea“, Organic Letters, 10.1021/acs.orglett.8b02788
発表者
理化学研究所
環境資源科学研究センター ケミカルバイオロジー研究グループ
基礎科学特別研究員 大高 潤之介(おおたか じゅんのすけ)
上級研究員 清水 猛(しみず たけし)
グループディレクター 長田 裕之(おさだ ひろゆき)
創発物性科学研究センター 物質評価支援チーム
チームリーダー 橋爪 大輔(はしづめ だいすけ)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- キノコ、子実体
- キノコは、肉眼で確認可能な生殖器官である子実体を形成する糸状菌(カビ)の総称。子実体では胞子が作られ、生殖器官の構造の違いにより担子菌類(エノキタケ、シイタケなど)と子嚢(しのう)菌類(アミガサタケ、冬虫夏草など)に分類される。薬理活性を持つ二次代謝産物を産生する有用資源として期待される。
-
- ウシグソヒトヨタケ (Coprinopsis cinerea)
- 培養が容易で短期間で子実体を形成すること、子実体形成中に回収容易な黒色の胞子をつくり散布すること、子実体形成中から成熟後にかけて消化酵素による自己融解を伴うことなど、生物学的に個性的なライフサイクルを持つことから数多くの分子生物学的研究に用いられているモデルキノコ。全ゲノム情報は2010年に公開されている。
-
- 二次代謝産物
- 生命活動維持に必要なビタミン類、糖、アミノ酸、脂質などを一次代謝産物というのに対し、その一次代謝物質を材料に産生される、種に特異的な有機化合物のことを二次代謝産物という。テルペノイド、アルカロイド、ポリケタイドなどが例であり、薬理活性を伴うものも多く、天然物化学では主にこれらの有機化合物を扱う。
-
- 絶対立体配置
- 化合物の立体異性体は原子の数と種類は同じで、その空間的な配置が異なるため、重ね合わせることができない。この空間的な配置のことを絶対配置といい、RとS、EとZなどと表記し分類が可能である。化合物の絶対立体配置が異なると生理活性も異なることがあり、解明することは重要である。絶対立体配置を決定する手段には、化合物合成あるいは誘導体化、単結晶X線結晶構造解析、分光学的手法などが存在する。
-
- 単結晶X線結晶構造解析
- 物質の単結晶にX線を照射して得られる回折データを解析することで、結晶を構成している分子などの三次元構造を得る手法。化合物の立体構造を詳細に解明するための最も有力な方法の一つである。
-
- セスキテルペノイド、クパレン
- テルペノイドは、炭素5個のイソプレンを構成単位とする天然有機化合物。セスキテルペノイドは、三つのイソプレンユニットから構成される炭素数15の天然物を指す。クパレンはp-トリルシクロペンタンを基本骨格に持つセスキテルペノイドでファルネシル二リン酸から生合成される。
-
- 液体クロマトグラフィー・質量分析法(LC/MS)
- 液体クロマトグラフィーで分離したエキス成分を、質量分析部でイオン化して質量検出器で分析する方法。扱える化合物が豊富であり、UVスペクトルと質量の情報が得られる。
-
- 比旋光度
- 光学活性を持つ化合物に直線偏光を通過させたとき、偏光面が回転する。この回転する角度を旋光度という。温度、溶媒(濃度、種類)、試料セルの長さ、光の波長によって旋光度は変化する。したがって、化合物同士の旋光度を比較するために、これらの要素を標準化した比旋光度という値を用いる。
-
- IC50
- 50%阻害濃度。分子や細胞、個体に作用させた薬剤の量と反応の関係を表す指標に一つで、ある薬剤について、最大効果の半分(50%)の反応(阻害)を引き起こす用量のこと。
-
- フェノールオキシダーゼ
- フェノール類酸化酵素の総称。キノコ類(特にシイタケやエノキタケなどの白色腐朽菌)は、フェノールオキシダーゼを菌体外に放出することで、植物体内のリグニンという高分子フェノール性化合物を分解できる。
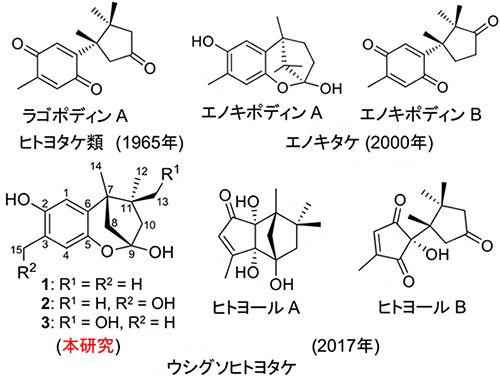
図1 ヒトヨポディン類(1-3)の構造と関連するセスキテルペノイドの構造
それぞれ発見された年を()に示す。上段のラゴポディンAとエノキポディンBは、構造的に関連したクパレン型セスキテルペノイドである。ラゴポディンAはヒトヨタケ類から、エノキポディンBはエノキタケから産生される。下段のヒトヨールAとヒトヨールBは、セスキテルペノイドよりも骨格の炭素数が1個少なく、ウシグソヒトヨタケから産生される。上段のエノキポディンAはベンゾキサビシクロ[3.2.1]オクタン骨格を持ち、エノキポディンBの前駆体と予想される。本研究では、ウシグソヒトヨタケがエノキポディンAと同じ骨格を持つ化合物を産生すると予測し、培養抽出物から探索を進めた。分離精製を進めた結果、図中の1-3を単離、構造決定した。
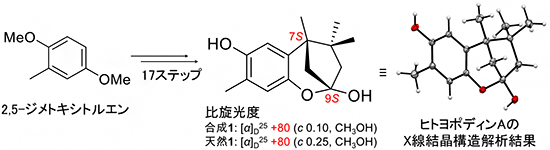
図2 ヒトヨポディンAの絶対立体配置決定
合成1とキノコ培養液から得た天然1の比旋光度が一致したことから、絶対立体配置を7S,9Sと決定した(中)。さらに、この7S,9Sの立体化学は単結晶X線結晶構造解析においても証明された(右)。
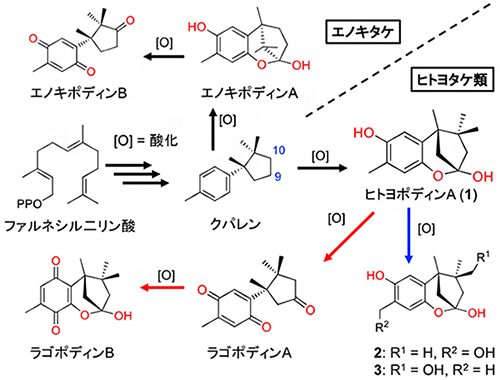
図3 クパレンからヒトヨポディン類とエノキポディン類までの予想される生合成経路
ラゴポディンB(ベンゾキノン型)は、ヒトヨポディンA(1、ヒドロキノン型)のフェノール酸化体であるラゴポディンAから生合成される(赤矢印)。化合物1は、酸化酵素のフェノールオキシダーゼにより迅速にラゴポディンAを経て、ラゴポディンBに変換されると考えられる。また、ヒトヨポディン類2-3は、蓄積した1のメチル基がそれぞれ水酸化されることにより生成する(青矢印)。クパレンの酸化位置が9位の場合はヒトヨポディンAに、10位の場合はエノキポディンAに生合成される。