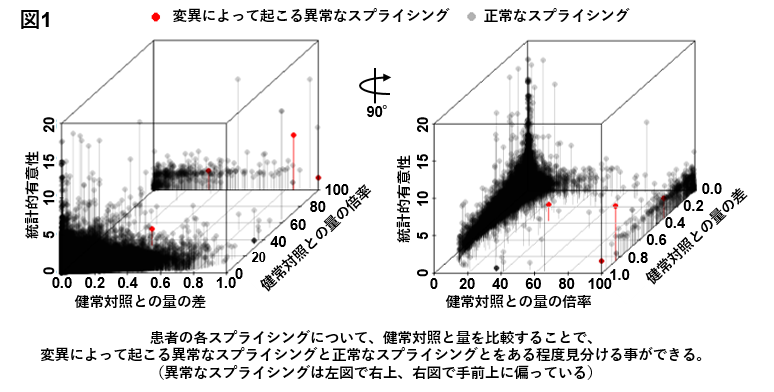
2018-11-30 慶應義塾大学,日本医療研究開発機構
慶應義塾大学医学部生理学教室の岡野栄之教授、整形外科学教室の中村雅也教授らの研究グループは、これまで細胞移植単独では治療効果を得ることができなかった慢性期の脊髄損傷(注1)モデルマウスに対して、Notchシグナル阻害剤(注2)で前処理したヒトiPS細胞から樹立した神経幹/前駆細胞(注3)を移植することのみで、運動機能を回復・維持させることに成功しました。
これまで、本研究グループの行ったヒトiPS細胞由来神経幹/前駆細胞移植単独では、亜急性期(受傷後数週間以内)における脊髄損傷に対しては有効性が確認できた一方、慢性期の脊髄損傷に対しては有効性が確認できませんでした。また、今日にいたるまで細胞移植治療単独では機能改善が得られたという報告は世界でも極めて少なく、慢性期の損傷脊髄における細胞移植単独は効果がなく、亜急性期を逃すと神経幹細胞移植は行えない、あるいは行っても効果が得られないとされてきました。
今回、本研究グループでは、細胞間の情報の伝達経路の一つであるNotchシグナルが働かないようにして神経幹/前駆細胞を前処理すると、有意にニューロンへと分化するだけでなく、軸索(注4)の再生を促す作用もあることに着目しました。そこで、Notchシグナル阻害剤で前処理したヒトiPS細胞由来神経幹/前駆細胞を、慢性期の損傷脊髄へ移植したところ、再生や運動機能回復が困難といわれる過酷な状況においても、軸索の再生・伸長が起こり、さらに再髄鞘化(注5)も誘導することを発見しました。
今回の研究成果は、受傷後長時間が経過した慢性期の脊髄損傷患者が、運動機能を回復・維持できる可能性を明らかにしました。ヒトiPS細胞由来神経幹/前駆細胞移植の臨床応用を実現させる上で、これまでにない非常に大きな成果であるといえます。
本研究成果は、2018年11月29日(米国東部時間)に、国際幹細胞学会(ISSCR)の公式ジャーナルである『Stem Cell Reports』のオンライン版に掲載されました。
研究の背景と概要
脊髄損傷は外傷などによる脊髄実質の損傷を契機に、損傷部以下の感覚・運動・自律神経系の麻痺が出現する病態であり、我が国の患者数は現在15万人以上に達し、さらに毎年約5000人の新規患者が発生しています。脊髄損傷後の病態は、急性期・亜急性期・慢性期と、損傷からの時間の経過に伴い大きく変化をするため、それぞれの病期に対する治療法が必要となります。
これまで、本研究グループは脊髄再生医療の実現に向けて、細胞移植の最適な時期が亜急性期(受傷数週間)であることを世界に先駆けて明らかにし、神経幹/前駆細胞移植によって良好な運動機能回復が得られることを報告してきました。しかし、脊髄損傷患者の多くは慢性期にあり、いかにして脊髄再生医療を慢性期の患者さんに結びつけるかということが、われわれ脊髄損傷研究に携わる者にとっての大きな課題でありました。
今回、本研究グループは神経幹/前駆細胞において、その多分化能(多様な組織へ分化する能力)や自己複製能(細胞自らが同じ性質のある細胞を作り出す能力)の維持にNotchシグナルが深く関与していることに着目しました。このNotchシグナルを阻害するGamma-secretase inhibitor (以下、GSI)は、元々はアルツハイマー病に対する治療薬として開発されましたが、神経幹/前駆細胞の増殖を抑えると共に、ニューロンへの分化を促すといわれています。これまで、GSIで前処理したヒトiPS細胞由来神経幹/前駆細胞を亜急性期の脊髄損傷モデル動物へ移植すると、損傷脊髄内で移植細胞由来のニューロンや軸索の再生が有意に増加し、脊髄神経回路の再構築が形成されることにより、運動機能が回復することを確認しています。そこで、再生や運動機能回復が困難といわれる過酷な状況である慢性期の損傷脊髄モデル動物にこの細胞を移植し、その有効性と安全性を確認するとともに、細胞移植単独での治療効果の検証を行いました。
研究の成果と意義・今後の展開
本研究グループは、重度脊髄損傷モデルマウスに対して、損傷後42日目(マウスで慢性期の脊髄損傷に相当)にGSIで前処理したヒトiPS細胞由来神経幹/前駆細胞(GSI群)を、対照群にはGSIで処理をしていないヒトiPS細胞由来神経幹/前駆細胞(Control群)、リン酸緩衝生理食塩水(PBS群)をそれぞれ損傷中心部に移植しました。治療効果を明らかにするために、これら3群を比較検討しました。その結果、以下のことが明らかとなりました。
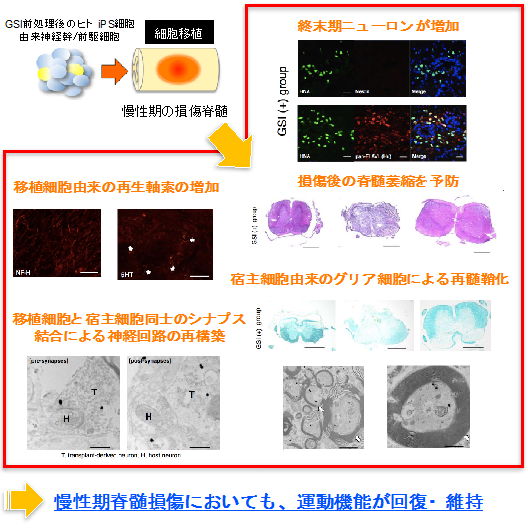
- GSIで前処理したヒトiPS細胞由来神経幹/前駆細胞は腫瘍様に増殖することなく損傷部に生着し、約75%がニューロンへと分化しました。移植後3ヶ月の時点で、脊髄の横断面積や髄鞘面積を比較すると、GSI+群では、損傷を加えた中心部分から尾側において面積が有意に大きくなっていることを確認しました。
- GSI+群では、対照群と比較し、移植細胞から約2~3倍もの軸索が再生し、そのほとんどが損傷部を越えて伸長していることを確認しました。また、これらを電子顕微鏡を用いてより細くミクロ単位で確認すると、GSI+群では移植細胞由来の再生された軸索に、マウス由来のグリア細胞が何層にも巻きつき、再髄鞘化が起きていることも確認できました。
- 損傷後低下したマウスの後肢運動機能は、対照群と比較し、GSI+群において移植後56日目から有意な機能回復が認められ、その後も回復した運動機能は維持されました。
以上の結果から、慢性期の損傷脊髄へGSIで前処理したヒトiPS細胞由来神経幹/前駆細胞を移植すると、腫瘍様に増殖することなく生着し、その大部分はニューロンへと分化したこと、また、慢性期損傷脊髄という極めて過酷な状況においても、GSI前処理後のヒトiPS細胞由来神経幹/前駆細胞移植単独で、多くの軸索が再生し、さらに移植を受けた側のマウス由来のグリア細胞により再髄鞘化も誘導されることで、運動機能の改善が得られたことが明らかになりました。
これまで神経幹/前駆細胞移植単独では治療困難と考えられてきた慢性期の脊髄損傷に対して、移植前に細胞へGSIによる前処理を加えるだけで、有意な機能回復が得られる可能性を示した本研究は、慢性期脊髄損傷治療に新たな光を与え、これらに苦しむ患者に対するヒトiPS細胞由来神経幹/前駆細胞移植の実現や臨床応用を目指す上で非常に大きな一歩であると考えられます。
特記事項
本研究は、国立研究開発法人日本医療研究開発機構(AMED)・再生医療実現拠点ネットワークプログラム 疾患・組織別実用化研究拠点(拠点A)「iPS細胞由来神経前駆細胞を用いた脊髄損傷・脳梗塞の再生医療」、および日本損害保険協会研究助成の支援によって行われました。
論文
- 英文タイトル:
- Treatment with a Gamma-Secretase Inhibitor Promotes Functional Recovery in Human iPSC-Derived Transplants for Chronic Spinal Cord Injury
- タイトル和訳:
- 慢性期脊髄損傷に対し、ガンマセクレターゼ阻害薬で前処理したヒトiPS細胞由来神経幹/前駆細胞移植は運動機能を改善させる
- 著者名:
- 大久保寿樹、名越慈人、神山淳、辻収彦、篠崎宗久、芝田晋介、加瀬義高、松本守雄、中村雅也**、岡野栄之*(* and ** Corresponding authors)
- 掲載誌:
- 「Stem Cell Reports」オンライン版
用語解説
- (注1)慢性期の脊髄損傷:
- 脊髄が損傷を受け長時間経過した時期。損傷部には非常に固い瘢痕組織が形成され、遺伝子発現パターンの変化なども相まって、細胞移植単独による運動機能改善が得られづらくなっている。ヒトでは受傷後およそ半年、マウスやラットなどのげっ歯類では受傷後6週目以降とされる。
- (注2)Notchシグナル阻害剤:
- Notchシグナルは、神経、造血、血管や体節といった様々な組織へ分化をする過程に関係する遺伝子調節(シグナル伝達)経路を指す。特に細胞同士の情報伝達において、発生や恒常性の維持、細胞分化に関する遺伝子制御において非常に重要な役割を担っている。このシグナル経路の中で、Gamma-secretase複合体の一部が切断され、その情報が細胞核へと移行し標的となる遺伝子が転写・発現するが、Gamma-secretase阻害薬はこの切断を阻害することでNotchシグナルの阻害剤として機能し、神経をはじめとする様々な組織への分化を促進させる。また、腫瘍細胞に対してはその過増殖や転移を抑制する効果もあり、現在抗癌剤としての臨床応用も進んでいる。
- (注3)神経幹/前駆細胞:
- 未分化な状態を保ったまま増殖することが可能な自己複製能と、中枢神経系を構成するニューロン、アストロサイト、オリゴデンドロサイトの3系統の細胞へと分化することができる多分化能を併せ持つ細胞。脊髄損傷や脳梗塞などへのヒトiPS細胞由来の神経幹/前駆細胞を用いた移植治療は今後の再生医療において有用な治療法として期待される。
- (注4)軸索:
- 神経細胞のもつ突起で、多くの場合、各神経細胞体の基部から1本ずつ出ている。長く伸びていくと、被膜に包まれて神経線維となるので、神経突起ともいう。末端は分枝して次の神経細胞などに接合し、神経の興奮を伝える作用がある。
- (注5)再髄鞘化:
- 細胞が再び髄鞘を形成すること。髄鞘とは、軸索の周囲を何重にも取り囲んでいる密な膜構造で、導線を覆うビニール管のような構造物である。しかし、軸索全体を覆っているのではなく、一定の間隔を開けている。髄鞘を形成しているのはグリア細胞(神経膠細胞)であり、中枢神経系ではオリゴデンドロサイト(希突起膠細胞)、末梢神経系ではシュワン細胞によって形成される。
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部生理学教室
教授 岡野 栄之(おかの ひでゆき)
慶應義塾大学医学部整形外科学教室
教授 中村 雅也(なかむら まさや)
本リリースの発信元
慶應義塾大学
信濃町キャンパス総務課:鈴木・山崎
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課