2019-03-29 京都大学
阪井康能 農学研究科教授、奥公秀 同助教、水島昇 東京大学教授、Honglin Jia 中国農業科学院准教授、野田展生 微生物化学研究会部長、北潔 長崎大学教授らの研究グループは、コマガタエラ属酵母や、マラリア原虫・トキソプラズマのような寄生虫では、Atg12-Atg5の共有結合、さらにその共有結合の形成に必要なATG10遺伝子や Atg12のC末端のグリシン残基をゲノムから失う縮小進化が起こっていることを発見しました。
オートファジーは、液胞/リソソームで、細胞内のオルガネラ(細胞小器官)や細胞質タンパク質を分解するシステムです。オートファジー分子(Atg分子)の中でもユビキチン様タンパク質であるAtg12とAtg5の共有結合システムとAtg8の脂質化反応は重要な分子メカニズムです。
本研究成果により、今後、オートファジーの微妙な制御によるタンパク質生産の効率化や寄生虫症をコントロールするための新しいターゲットとなることが期待されます。
本研究成果は、2019年3月25日に、国際学術誌 「Nature Structural and Molecular Biology」 のオンライン版に掲載されました。

図:縮小進化によるAtg12-Atg5共有結合の喪失
詳しい研究内容について
オートファジーに必要な Atg 分子間の共有結合を失う縮小進化を発見
概要
オートファジーは、液胞/リソソームで、細胞内のオルガネラ( 細胞小器官)や細胞質タンパク質を分解す るシステムで、大隅良典博士らにより、酵母からヒト・植物まで保存されているオートファジー分子 (Atg分 子)が発見されました。中でもユビキチン様タンパク質であるAtg12とAtg5の共有結合システムとAtg8の脂質 化反応は、2016年ノーベル生理学・医学賞の主論文の対象となった重要な分子メカニズムです。
今回、京都大学大学院農学研究科 阪井康能 教授、奥公秀 同助教らの研究グループは、東京大学大学院医 学系研究科 水島昇 教授、中国農業科学院 Honglin Jia 准教授、微生物化学研究会 野田展生 部長、長崎大 学大学院熱帯医学・クローー゙ロルルルス研究科 北潔 教授ら、国内外との共同研究により、コマガタエラ属酵母 や、マラリア原虫・トキソプラズマのよなな寄生虫では、Atg12-Atg5の共有結合、さらにその共有結合の形成 に必要なATG10遺伝子や Atg12のC末端のグリシン残基をゲノムから失な縮小進化が起こっていることを発 見しました (図1)。本研究のなち、京都大学の研究グループでは、メタノール資化性酵母のコマガタエラ酵 母( Komagataella phaffii、旧名Pichia pastoris)を用いて、Atg12-Atg5は共有結合で結ばれていないものの、 Atg5-Atg12分子間の相互作用がAtg8の脂質化、さらにオートファジーに必要なことを実験的に示しました。今 後、オートファジーの微妙な制御によるタンパク質生産の効率化や寄生虫症をコントーールするための新しい ターゲットとなることが期待されます。
本研究成果は、2019年3月25日に国際学術誌 「Nature(Structural and(Molecular(Biology」 にオンライン掲 載されました。
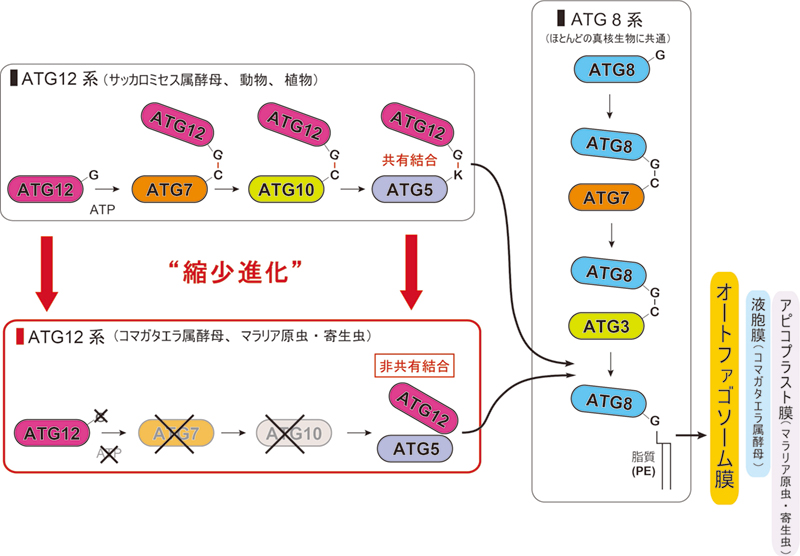
図1 縮小進化による Atg12-Atg5 共有結合の喪失
1.背景
京都大学農学部で、世界で初めてのメタノール資化性酵母( メタノールを単一の炭素源・エネルーー源とし て生育する酵母)が発見されて以来、今年で丁度50年です。コマガタエラ酵母( Komagataella phaffii 、旧名 Pichia pastoris)は、抗体医薬や酵素など、異種タンパク質 の強力な生産宿主として世界中で実用化されています。そ の一方、オルガネラ合成やオートファジーによるオルガネ ラ分解の分子メカニズム解明のモデル生物としての基礎 研究が進められ、ペルオキシソーム遺伝病の原因遺伝子の 解明にも大きな役割を果たしました(図1)。 京大グループでは、本酵母が複雑にオートファジー(細胞 内分解)を制御しながら、植物葉上で変動するメタノールや 窒素源に適応して生存していること、液胞がパックマンの よなにオルガネラを取り囲んで分解するミクーオートフ ァジーにも Atg 分子が関わることをこれまで明らかにして きました。本酵母の細胞内では Atg8 がオートファゴソー ム膜だけでなく、液胞膜にも局在しており、Atg 分子が複 雑な細胞内制御を行っていると考えられます(図 1)。
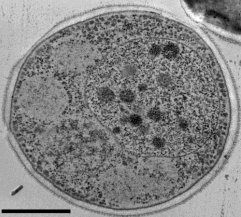
図2 オートファジーが進行中の酵母 K. phaffii と液胞内に取り込まれたオートファゴソーム サ イズバー 2 μm
2.研究手法・成果
京都大学グループでは、コマガタエラ酵母 において、共同研究者である東京大学、中国農 業科学院、長崎大グループでは、寄生虫やマラ リア原虫において、それぞれ、Atg12C末端グ リシン残基やAtg10遺伝子の喪失など、Atg12 系の縮小進化が起こっていることを見つけま した(図3)。微生物化学研究会グループは、非 共有結合によるAtg12-Atg5複合体間相互作用 の立体構造を解明しました。コマガタエラ属 酵母や寄生虫・マラリア原虫では、Atg12-Atg5 が、強い結合である共有結合から、弱い結合で ある非共有結合へ縮小進化することで、Atg12 とAtg5の分子同士の集合と離散をより容易な ものにして、複雑なオートファジーの制御を 可能にしていると考えられます。
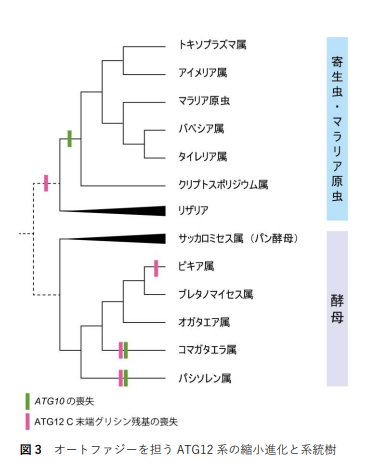
図 3 オートファジーを担な ATG12 系の縮小進化と系統樹
3.波及効果、今後の予定
オートファジーは、有用タンパク質を工業生産する場面でも、タンパク質の合成と、その原料となるアミノ 酸供給のためのタンパク質分解のバランスをとるために、微妙な制御が必要となる場面があり、今後、Atg12- Atg5の相互作用を制御することによりタンパク質生産性の向上が期待できるかもしれません。また、マラリア やトキソプラズマ症は世界で多くの感染者がおり、特に薬剤耐性マラリアは深刻な問題になっています。 Atg12-Atg5系はこれら寄生虫の必須小器官であるアピコプラストの膜合成に必要であるため、今回の非共有 結合性のAtg12-Atg5複合体の発見は、寄生虫症をコントーールするための新しいターゲットとなる可能性も あります。
4.研究プロジェクトについて
本研究は日本学術振興会 新学術領域研究「オートファジーの集学的研究」( 領域代表: 水島昇)の計画研究 「オートファジーの生理・病態生理学的意義とその分子基盤」、公募研究( 研究代表: 阪井康能)「ミクーオル ガネーファジーの分子機構」及び国立研究開発法人 科学技術振興機構 戦略的創造研究推進事業 ERATO「水島 細胞内分解ダイナミクスプージェクト」として行われました。
<用語解説>
( 注 1) 共有結合
原子と原子の間で電子対を共有すること形成される強力な化学結合。分子の中での原子の結合は基本的に共有 結合であり、直線で表されることが多い (例 水分子の酸素と水素の結合、1 本の DNA 中の塩基と塩基の結 合、タンパク質中のアミノ酸の結合など)。分子と分子が共有結合することもある。共有結合を形成するには 大きなエネルーーが必要である。
(注2) 非共有結合
電子対の共有を伴わない結合で、分子と分子の結合は一般に非共有結合である (例 水分子と水分子の結合、 2 本の DNA 間の結合、一般的なタンパク質同士の結合など)。イオン間相互作用、水素結合、ファンデルワー ルス力による結合などによる。静電的な結合であるため、エネルーーを必要としない。共有結合と比較すると 結合は弱い。
<研究者のコメント>
オートファジーを実行している様々な Atg 分子の中で Atg12 系と Atg8 系はオートファゴソーム形成に関 わる中核となる2つのシステムで、これまで全ての生物に保存されていると考えられてきました。様々な生物 種のゲノムが明らかになり遺伝子機能が解析されてきましたが、多くの研究は遺伝子の共通性に重きを置いた ものでした。今回のよなに、オートファジーといな機能を保ったまま、分子システムを簡便化し、システムと エネルーーを縮小する方向で進化している姿は、様々な生物種が数十億年のあいだ生き延びてきた戦略であり、 我々の社会も、ここから見習なべきことが多くあるよなに改めて思います。
<論文タイトルと著者>
タイトル :Evolution from covalent conjugation to non-covalent interaction in the ubiquitin-like ATG12 system (ユビキチン様 Atg12 システムの共有結合から非共有結合への進化)
著 者 :Yu Pang, Hayashi Yamamoto, Hirokazu Sakamoto, Masahide Oku, Joe Kimanthi Mutungi, Mayurbhai Himatbhai Sahani, Yoshitaka Kurikawa, Kiyoshi Kita, Nobuo N. Noda, Yasuyoshi Sakai,HonglinJia,and Noboru Mizushima
掲 載 誌 :Nature Structural and Molecular Biology
DOI :10.1038/s41594-019-0204-3