新しいRNAスプライシング産物Cbfb2の獲得が進化に寄与
2018-01-24 理化学研究所
要旨
理化学研究所(理研)統合生命医科学研究センター免疫転写制御研究グループの谷内一郎グループディレクターと天野麻理客員研究員らの国際共同研究チームは、マウスを用いて、Runx転写因子[1]のサブユニットである「Cbfb2」が、胎児期に肝臓で作られるT細胞[2]前駆細胞の分化と胸腺[3]への移動(遊走)を制御していることを発見しました。
免疫組織には、免疫細胞の初期発生を担う一次免疫組織と免疫細胞の情報交換の場となる二次免疫組織があります。胸腺はT細胞の初期発生を支持する臓器であり、ヒトと同じ形態の胸腺は、進化過程では軟骨魚類から硬骨魚類にかけて出現したと考えられています。一方、リンパ節[4]などの二次免疫組織は、爬虫類または鳥類から出現したと考えられています。このような免疫組織の発生には、血球系細胞と上皮系細胞の相互作用が必須であり、特定の分化能を持つ血球系細胞がその分化を支える特定の上皮系細胞が存在する場所に効率よく遊走することが必要です。例えば、T細胞になる前駆細胞は、胎児期に肝臓から胸腺に遊走しなければいけません。しかし、この胸腺への遊走のプログラムが進化過程でどのように構築されたかはよく分かっていませんでした。
今回、国際共同研究チームは、軟骨魚類から硬骨魚類への進化過程で起きた新しいRNAスプライシング[5]により、Runx転写因子の構成因子であるCbfbを産生するCbfb遺伝子がCbfb2という新たなCbfbを獲得したことでRunx転写因子の機能が拡充し、胸腺外T前駆細胞の分化と胸腺への遊走能を付与するプログラムが進化したことを突き止めました。また、のちの進化過程でCbfb2の機能を再び利用することで、二次免疫組織形成に必須の血球系細胞であるLTi細胞[6]の分化プログラムが進化したことも解明しました。本成果はRNAスプライシングによる転写因子の機能拡張が免疫組織の発生プログラムの進化につながったことを示すもので、生物進化の過程に新たな視点をもたらすものです。
Runx転写因子はさまざまな細胞種の分化に関与し、がんの発症にも深く関与しています。今後、Runx転写因子複合体の構成因子のC末端構造を介したRunx転写因子の機能制御機構の解明が進めば、Runx転写因子の機能を制御する新たな薬剤の開発が期待できます。
本研究は、米国の科学雑誌『The Journal of Experimental Medicine』(2月5日号)に掲載されるのに先立ち、オンライン版(1月17日付け)に掲載されました。
※国際共同研究チーム
理化学研究所 統合生命医科学研究センター 免疫転写制御研究グループ
グループディレクター 谷内 一郎 (たにうち いちろう)
客員研究員 天野 麻理 (てんの まり)
上級研究員 香城 諭 (こうじょう さとし)
マックスプランク研究所
シニアグループリーダー トーマス・ボエーム(Thomas Boehm)
背景
谷内グループディレクターらは、2002年にRunx転写因子がキラーT細胞[2]への分化に重要であることを発見するなど注1,2)、主に胸腺でのT細胞の分化に関するRunx転写因子の機能を解明する研究を進めてきました。Runx転写因子は、線虫のような下等生物から保存されている転写因子で、Runxとそのサブユニットである「Cbfb」のヘテロ二量体として機能します。RunxはRuntドメインを介して特異的にDNA配列に結合する活性を持ちますが、Cbfbはそれ自体ではDNAに直接結合することはできません。
しかし、RunxはCbfbとの結合なしには標的とする遺伝子の発現を制御できないことから、Cbfbの重要性は認識されていました。昆虫ではCbfbを産生する遺伝子は2種類ありますが、哺乳類は1種類のCbfb遺伝子しか持っていません。ところが、哺乳類はRNAスプライシングを利用して、一つのCbfb遺伝子から2種類のCbfb(Cbfb1とCbfb2)を作ることができます。Cbfb1とCbfb2はC末端のアミノ酸配列が異なりますが、Cbfb1とCbfb2が持つC末端のアミノ酸配列は、昆虫のCbfbにはみられません。
谷内グループディレクターらは比較ゲノム解析を行い、進化のどの時点でCbfb1とCbfb2が出現するのか調べたところ、初期の脊椎動物である無顎類や軟骨魚類はCbfb1タンパクを持っているが、Cbfb2タンパクは持っていないことを明らかにしました。一方、硬骨魚類ではCbfb2を産生するRNAスプライシングが起きていました。これは、硬骨魚類への進化過程でCbfb2が出現したことを意味しています。
今回、国際共同研究チームは硬骨魚類で獲得したCbfb2の機能を調べるために、遺伝子操作によってCbfb2を産生するRNAスプライシングが起きない変異マウス(Cbfb2欠損マウス)を作製し、解析を試みました。天野客員研究員らは2017年に、Cbfb2欠損マウスの解析によりCbfb2が表皮のランゲルハンス細胞[7]の分化に必要であることを発表しましたが注3)、本研究ではT細胞分化に焦点を当てた解析を行いました。
胸腺はT細胞の初期発生を支持することを唯一の機能とする臓器であり、「一次免疫組織」と呼ばれます。ヒトと同じ形態の胸腺は、軟骨魚類から硬骨魚類の進化過程で獲得したと考えられています。一方、リンパ節などは「二次免疫組織」と呼ばれ、爬虫類または鳥類から出現したと考えられています(図1)。
このような免疫組織の発生には、血球系細胞と上皮系細胞の相互作用が必須です。例えば、胸腺の形成には胸腺外で産生されるT細胞への分化能を持つ血球系細胞(胸腺外T細胞前駆細胞)が、胸腺上皮細胞の集積する胸腺原基に移動(遊走)し、互いの細胞が接触することが必須です。しかし進化過程で、胸腺外T細胞前駆細胞に胸腺原基への遊走能を付与するプログラムがどのようにして構築されたのかはよく分かっていませんでした。
注1)Taniuchi et al. “Differential requirements for Runx proteins in CD4 repression and epigenetic silencing during T lymphocyte development.” Cell 111, 621-633,2002
注2)2008年2月8日プレスリリース 「ヘルパーかキラーか? T リンパ球の分化運命決定のカギを発見」
注3)2017年8月28日プレスリリース 「ランゲルハンス細胞の分化機構を解明」
研究手法と成果
マウスでは、胎児期11.5日目頃に、胸腺上皮の集積により胸腺原基が形成され、そこに胎児肝臓で産生される胸腺外T前駆細胞が遊走し、定着、増殖することで胸腺が形成されていきます。
国際共同研究チームはまず、成獣のCbfb2欠損マウスでは胸腺のサイズが正常マウスよりも小さいことを発見しました。次に、胎児期での胸腺形成を調べると、例えば胎児期14.5日目でもCbfb2欠損マウスでは胸腺が小さく(図2)、免疫組織化学という方法で血球系細胞を可視化して顕微鏡下で観察すると、Cbfb2欠損マウスの胸腺内には血球系細胞が激減していることが分かりました。これは、Cbfb2欠損マウスでは、胎児期の胸腺外T前駆細胞の分化または胸腺への遊走能に問題があることを示しています。
これまでの研究から、胎児期12.5日頃に、胎児肝臓で産生されるPIRという細胞表面マーカーを発現している細胞群(PIR+細胞)が胸腺外T前駆細胞ではないかと考えられていました。そこで、フローサイトメトリー[8]と呼ばれる手法で胎児肝臓のPIR+細胞に着目した解析を行ったところ、Cbfb2欠損マウスではPIR+細胞の数が正常マウスよりも減少していることが分かりました(図3)。
さらに、デジタルRNA-seq解析[9]を用いて、残存するPIR+細胞で発現している遺伝子を網羅的に解析したところ、Cbfb2を欠損するPIR+細胞ではCCR9遺伝子の発現が激減し、CCR9の発現が消失していることが分かりました(図4)。CCR9はケモカイン[10]受容体と呼ばれるタンパクの一種で、胸腺上皮細胞から産生されるケモカインを感知し、胸腺外T前駆細胞の胸腺への遊走を導く機能を持つことが知られています。この結果はCbfb2が胸腺外T前駆細胞の分化のみならず、CCR9の発現を誘導することで、胸腺への遊走能の付与にも関与することを示しています。また、Cbfb2がCCR9遺伝子の発現を直接制御している可能性も示しています。
そこで、Cbfb2がどのようにCCR9遺伝子の発現を制御しているか調べるために、クロマチン免疫沈降(ChIP)法を次世代シークエンシングと組み合わせたChIP-Seq法[11]を行い、Cbfb1やCbfb2が結合しているゲノム領域を網羅的に解析しました。その結果、CCR9遺伝子が転写される部位から10kbおよび13kb上流にCbfb1やCbfb2が結合していました。面白いことに、マウス胎児の肝臓では、これら領域にCbfb2がより多く結合している結果が得られました(図5)。また、これらの領域は進化的に生物種間で保存されており、典型的なRunx転写因子認識配列を持っていました。
これらCbfb結合領域の機能を解析するために、CRISPR/Cas9[12]と呼ばれるゲノム編集技術を用い、マウスのゲノムからCCR9遺伝子上流のCbfb結合領域を除去した変異マウスを作製しました。その結果、これら二つの領域が欠失するとPIR+細胞でのCCR9の発現は完全に消失しましたが、PIRを発現していない細胞ではCCR9の発現に影響はありませんでした。このことから、これらCbfb結合領域はPIR+細胞(胸腺外T前駆細胞)特異的にCCR9の発現を誘導するために必須のゲノム領域であることが分かりました。
次に、Cbfb2の機能の進化的意義に興味を持ち、RNAスプライシングによりCbfb2が出現した硬骨魚類で、マウスと同じようにCbfb2が胸腺外T前駆細胞の胸腺原基への遊走に必須か調べることにしました。硬骨魚類の中で実験動物としてよく用いられているゼブラフィッシュを用い、Cbfb2を産生するRNAスプライシングを標的としたアンチセンスRNA[13]を受精卵に注入する手法で、Cbfb2をノックダウン[14]したゼブラフィッシュを作製しました。
その結果、Cbfb2の発現低下によりマウスと同じようにゼブラフィッシュでもCCR9aの発現が低下し、胸腺原基に遊走する血球系細胞数が減少しました(図6)。これは、硬骨魚類でも、胸腺への遊走能を付与するCbfb2の機能が使われていることを示すものです。進化過程で哺乳動物と同じような形態の胸腺という一次免疫組織が出現した時期は、Cbfb2を獲得した時期とよく合致することと併せると、“新しいスプライシングの産物としてCbfb2を獲得したことにより、Runx転写因子の機能の拡充が起こり、CCR9の発現を誘導する制御機構が洗練され、T細胞になる能力に富んだ血球系細胞が効率よく胸腺に遊走できるようになり、胸腺を形成する発生プログラムが頑強化された”と考えられます。
一方、国際共同研究チームは早くから、Cbfb2欠損マウスではリンパ節やパイエル板[15]といった二次免疫組織の形成が欠損していることに気づいていました。このような二次免疫組織の形成にはLTi細胞という血球系細胞が必要であること、LTi細胞の胎児期での発生・分化にはRorgt転写因子が必須であることが知られています。
そこで、Rorgt転写因子をコードするRorc遺伝子に着目し、CbfbのChIP-Seq法の結果を再解析しました。その結果、マウス胎児の肝臓細胞ではRorc遺伝子のイントロン[16]領域にCbfb2が優位に結合する単一のゲノム領域があることを発見しました。CRISPR/Cas9によりRorc遺伝子座内のCbfb2結合領域を除去すると、LTi細胞でのRorgtの発現が消失しました。
これらの結果は、胸腺という一次免疫組織の発生プログラムの進化に利用されたCbfb2が、のちの進化過程でRorc遺伝子の発現制御機構の獲得のために再活用され、二次免疫組織の形成プログラムが進化した可能性を示すものと考えられます。
今後の期待
本研究は、マウスやゼブラフィシュを用いて、胎児期の胸腺外T前駆細胞の分化や胸腺への遊走能の付与におけるCbfb2の機能を解明したものです。進化過程でCbfb2を産生するRNAスプライシングを獲得した時期と胸腺の発生プログラムの進化時期はよく合致することを併せて考えると、Cbfb1と異なるC末端構造を持つCbfb2の獲得によるRunx転写因子の機能拡充が、免疫組織形成プログラムの進化に大きく貢献したと考えられます。これは、RNAスプライシングによる転写因子の機能多様性の増大が、新たな細胞種の創造に使用されたよい例と捉えることができます。
また本成果は、Runx転写因子の構成因子のC末端構造の変化によって、Runx転写因子の機能が変化することも示しています。Runx転写因子はさまざまな細胞種の分化に関与し、がんの発症にも深く関与する転写因子です。今後、タンパクの構造解析などを通じ、Runx転写因子複合体の構成因子のC末端構造を介したRunx転写因子の機能制御機構の解明が進めば、Runx転写因子の機能を制御する新たな薬剤の開発が期待できます。
原論文情報
- Mari Tenno, Satoshi Kojo, Divine-Fondzenyuy Lawir, Isabell Hess, Katsuyuki Shiroguchi, Takashi Ebihara, Takaho A. Endo, Sawako, Muroi, Rumi Satoh, Hiroshi Kawamoto, Thomas Boehm and Ichiro Taniuchi, “Cbfb2 controls differentiation of and confers homing capacity to pre-thymic progenitors”, The Journal of Experimental Medicine, doi: 10.1084/jem.20171221
発表者
理化学研究所
統合生命医科学研究センター 免疫転写制御研究グループ
グループディレクター 谷内 一郎 (たにうち いちろう)
客員研究員 天野 麻理 (てんの まり)
谷内一郎グループディレクターと天野麻理客員研究員
報道担当
理化学研究所 広報室 報道担当
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
補足説明
-
- 転写因子
- 遺伝子の発現を調節するタンパク質。DNAと結合し、RNAへの転写を制御する。
-
- T細胞、キラーT細胞
- T細胞はリンパ球の一つで、さまざまなサイトカインを産生することなどにより、免疫反応を制御する司令塔的役割を持つ。キラーT細胞はT細胞の一種で、ウイルスに感染した細胞やがん細胞を殺すことができる。
-
- 胸腺
- T細胞が作られる臓器で、心臓の上に位置している。胎児肝臓や骨髄から移動してきたT細胞前駆細胞は、胸腺上皮細胞との相互作用によって胸腺内でT細胞へと分化・成熟する。
-
- リンパ節
- 体の鼠径部(そけいぶ)、気管支・肺、腋の下などにある。全身から組織液を回収して静脈に戻すリンパ管系の途中に位置する。種々の免疫細胞から構築され、免疫細胞間の情報交換の場として機能し、免疫応答を発動するため重要な組織であり二次免疫組織と呼ばれる。
-
- RNAスプライシング
- ゲノム上の遺伝子をメッセンジャーRNA(mRNA)に転写する過程の一つ。ゲノム上の遺伝子はエクソンとイントロンからなるが、mRNAが形成される過程でイントロン配列が削除され、エクソン配列のみがmRNAとして残る。同じ遺伝子からでも異なったエクソンの組み合わせのmRNAが作られることがあり、これをalternative splicingと称する。
-
- LTi細胞
- 胎児期に産生される血球系細胞の一種。リンパ節やパイエル板などの二次免疫組織の発生に必須である。LTiはLymphoid Tissue inducerの略。
-
- ランゲルハンス細胞
- 表皮に特異的に存在する樹状細胞の一種。
-
- フローサイトメトリー
- 単離した大量の細胞を一列に並ぶように高速で流しながら、その一つ一つの大きさやタンパク質の発現状態について解析する方法。
-
- デジタルRNA-seq解析
- 少ない数の細胞からより正確な定量性を持ってRNAの発現量を比較するために開発された、DNA配列を読み取るシークエンス技術の一種。読み取るDNA断片に特異的な短い配列を付加しておくことでDNAを予めマークしておくバーコード技術を使うことにより、RNAのコピー数を正確に測ることからデジタルという名称が使用されている。
-
- ケモカイン
- リンパ球などの細胞表面に発現するケモカイン受容体を介して、その作用を発現する塩基性タンパク質で、サイトカインの一群である。リンパ球などの遊走を引き起こし、炎症の形成に関与する。
-
- ChIP-Seq法
- ゲノムDNA領域とタンパク質との結合を調べるクロマチン免疫沈降法(ChIP)と、次世代シーケンサー(sequencing)を組み合わせた解析方法で、特定のタンパク質のゲノム結合領域を網羅的に解析できる。実施にはクロマチン免疫沈降で回収したDNA断片の配列を、次世代シーケンサーを用いて読み取りコンピューターでデータ解析を行う。
-
- CRISPR/Cas9
- ゲノム編集技術の一つ。Single guide RNA(sgRNA)と呼ばれるゲノム上の目的配列に特異的に結合する短いRNAとそれを認識するDNA切断酵素Cas9を、細胞内に導入することで、目的のDNA配列に変異を引き起こす。
-
- アンチセンスRNA
- ゲノムを構成する二本鎖DNAにおいて、片方の鎖から転写されるRNA(センスRNA)に対して、逆の鎖から転写されるRNAをアンチセンスRNAと呼ぶ。センスRNAに対して阻害したり、調節したりする役割を持つことが知られている。
-
- ノックダウン
- ノックアウトでは遺伝子そのものが破壊され、機能を持たないのに対して、遺伝子の機能が大きく減衰しているが、完全になくなっていない場合をノックダウンという。
-
- パイエル板
- 腸の粘膜下にリンパ球などの免疫細胞が集合して作られるリンパ組織。
-
- イントロン
- mRNA前駆体に存在するタンパク質に翻訳されない領域。スプライシングの結果、イントロン配列は、それぞれ投げ縄構造を形成し、mRNA前駆体から除去される。

図1 胸腺(一次免疫組織)とリンパ節(二次免疫組織)の進化模式図
進化的にヒトと同じ形態の胸腺は、軟骨魚類から硬骨魚類の進化過程で獲得され、リンパ節は爬虫類または鳥類から出現したと考えられている。哺乳類と同じ形態の胸腺とCbfb2の出現した時期は、硬骨魚類からでよく相関する。
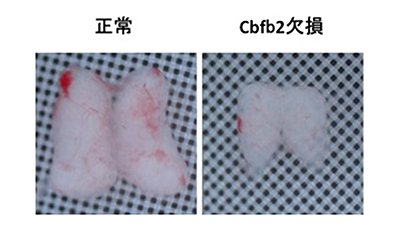
図2 マウス胎児期(14.5日)の胸腺画像
Cbfb2欠損マウスでは、胎児期14.5日ですでに胸腺が正常マウスに比べて小さく、その後、生涯にわたって胸腺は小さい。
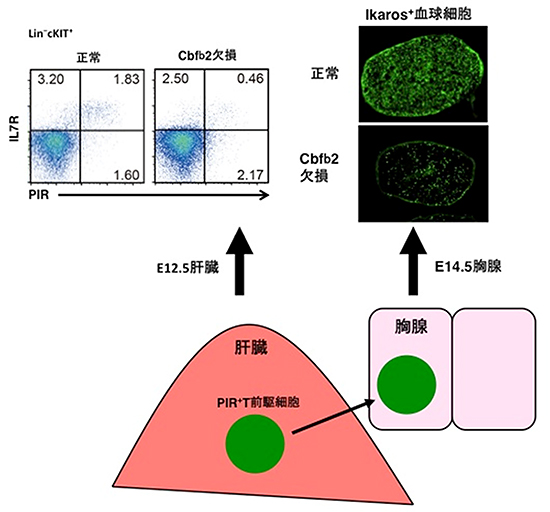
図3 Cbfb2欠損マウスと正常マウスの胎児期の肝臓と胸腺
Cbfb2欠損マウスの胎児期14.5日目の胸腺内には、血球細胞が少なかった(右上)。胎児期肝臓で作られるPIR+T前駆細胞が胸腺への遊走能を持ち、T細胞への分化能も持つが、Cbfb2欠損マウスの胎児期12.5日目の肝臓では、PIR+細胞の産生も少なかった(左上)。
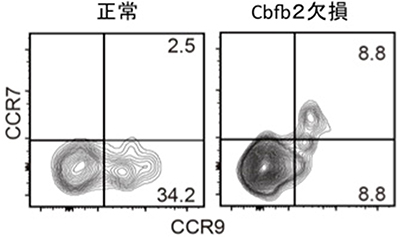
図4 Cbfb2欠損PIR+細胞におけるCCR9発現
Cbfb2欠損PIR+細胞上には、胎児期の胸腺への遊走能に必要なCCR9(ケモカイン受容体の一種)が減少していた。
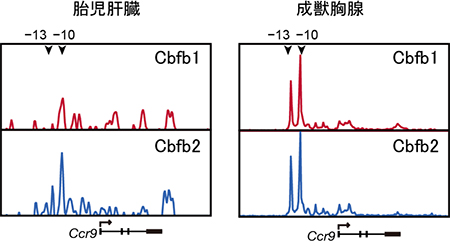
図5 マウス胎児肝臓とマウス成獣胸腺のChIP-Seq解析結果
ChIP-Seq解析結果からCcr9遺伝子の上流(-13と-10)にCbfb1やCbfb2が結合していることが分かる。成獣胸腺と比較すると、胎児肝臓ではCcr9遺伝子の上流にCbfb2が優位に結合していることが分かる。
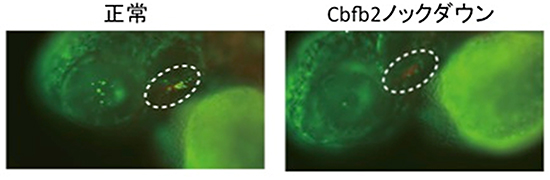
図6 Cbfb2をノックダウンしたゼブラフィッシュの胸腺原基
ゼブラフィッシュでCbfb2をノックダウンすると、マウス同様、胸腺原基へ遊走した血球系細胞(緑色)の数が低下する(白破線内)。