2019-12-19 慶應義塾大学医学部,日本医療研究開発機構
慶應義塾大学医学部坂口光洋記念講座(オルガノイド医学)の佐藤俊朗教授らの研究グループは、潰瘍性大腸炎の大腸組織において、特定の遺伝子変異が蓄積していることを発見しました。
ヒトの正常な大腸上皮は、加齢とともに遺伝子変異が蓄積し、大腸の発がんの原因となることがわかっています。また、食事の質や慢性炎症などのさまざまな腸内環境の変化によっても大腸の発がんリスクが高くなります。しかし、腸内環境の変化が大腸上皮の遺伝子変異の蓄積に影響を与えるかどうかは不明のままでした。
本研究では患者から得られた大腸上皮を培養し、大腸上皮細胞を増やすことによって効率的に遺伝子変異の解析を行いました。その結果、罹病期間が長い潰瘍性大腸炎の患者の大腸上皮細胞には、健常人の大腸上皮に比べて、より多くの遺伝子変異が検出されました。こうした遺伝子変異の多くは、大腸がんに認められる遺伝子変異ではなく、慢性炎症に関連した遺伝子変異であることがわかりました。
さらに、オルガノイドと呼ばれる培養皿の上で臓器を培養する技術によって、これらの遺伝子変異の役割を突き止めました。
潰瘍性大腸炎ではIL-17(インターロイキン17)と呼ばれる慢性炎症シグナルが活性化しており、その刺激は大腸上皮を傷害しますが、潰瘍性大腸炎の大腸上皮は、健常人では生じないIL-17に関連した遺伝子変異を獲得し、慢性炎症による細胞傷害から免れることが分かりました。つまり、潰瘍性大腸炎の患者の大腸では、炎症環境で生存しやすい遺伝子変異の上皮細胞が選択的に増え、正常な大腸上皮細胞を置き換えていくことが明らかになりました。
ヒトの大腸は遺伝子変異を蓄積することによって大腸がんを発生することが既に報告されていますが(Fearon ER, et al. Cell 1990)、本研究により慢性炎症などの腸内環境の変化に適応するための変異も蓄積していくことが判明しました。
遺伝子変異が生じた大腸上皮細胞の蓄積が潰瘍性大腸炎の病態やがん化にどのような影響を及ぼすか、今後の研究が期待されます。
この研究成果は、2019年12月18日(英国時間)に英科学誌『Nature』のオンライン版に掲載されます。
研究の背景
潰瘍性大腸炎は、大腸に原因不明の慢性炎症が生じる炎症性腸疾患の一つです。潰瘍性大腸炎の罹患者数は日本で約17万人以上存在し(2014年度厚生労働省衛生行政報告例の概況)増加の一途をたどっています。潰瘍性大腸炎の罹病期間が長くなると、大腸がんの発生が増加することが報告されていますが、なぜ潰瘍性大腸炎の患者では大腸がんが増えるのか、その明確な理由は解明されていませんでした。
多くのがんは加齢とともに増える遺伝子変異の蓄積によって生じます。そのため、炎症によって遺伝子変異の蓄積に影響が出ることが原因ではないかと予想されていました。この仮説を実証するためには、潰瘍性大腸炎で大腸組織の遺伝子変異の解析を行う必要がありますが、この証明には技術的な限界があり、現在まで解明が困難でした。
ヒトの組織の多くは、幹細胞(かんさいぼう)(注1)と呼ばれる細胞によって維持されています。幹細胞は多くの子孫細胞を生み出し、また自らが分裂することによってさまざまな臓器を維持しています。子孫細胞の多くは他の細胞を産み出すことができないため、仮に子孫細胞に遺伝子変異が生じても、細胞の寿命とともにその変異は除去されます。一方で、幹細胞に遺伝子変異が生じた場合、その変異は増えた幹細胞とともに子孫細胞にも受け継がれるため、発がんには幹細胞そのものに遺伝子変異が生じることが必要です。
大腸では10-20個の幹細胞が陰窩(いんか)(注2)と呼ばれるくぼみの中で、数か月の期間で、全て単一の幹細胞とその子孫細胞に置き換わることが知られています(この単一の幹細胞から産み出されたすべての細胞を“クローン”と呼びます)。
大腸では狭い領域に陰窩が無数に存在するため、従来の方法では、変異をもつ幹細胞と持たない幹細胞のクローンが混在したサンプルを用いることしかできず、個々の幹細胞にどのように遺伝子変異が蓄積されているのかを調べることができませんでした(図1)。
近年、オルガノイド培養技術(Sato T, et al. Nature 2009, Sato T, et al., Gastroenterology 2011)(注3)の応用によって、単一の幹細胞のクローンを培養して増殖し、各陰窩の幹細胞を個別に解析する手法が開発されました(図1)。その結果、正常な大腸上皮幹細胞では年齢に比例して遺伝子変異が蓄積していることが報告されました(Blokzijl F, et al. Nature 2016)。この報告において、遺伝子変異の蓄積には個人差があることが示されています。
今回研究グループは、この個人差に腸内環境が関与しているのではないかと考えました。そこで、右側大腸(大腸のうち口に近い側)に炎症がなく、左側大腸(大腸のうち肛門に近い側)にのみ炎症が生じている左側結腸炎型というタイプの潰瘍性大腸炎に着目し、その個別の幹細胞のクローンの詳細な遺伝子解析を行うことで、腸内環境の一つである慢性炎症が、幹細胞の遺伝子変異の蓄積にどのような影響を与えるかの解明に成功しました。
さらに、オルガノイドを用いて、潰瘍性大腸炎の炎症環境においてどのような遺伝子変異が生じているのか、また、その遺伝子変異が炎症の中でどのような役割を担っているのかを解明しました。
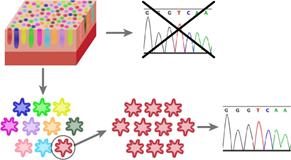
図1:クローン化技術の応用による幹細胞単位の遺伝子変異解析オルガノイド培養によるクローン化技術を応用することにより、個々の幹細胞クローンのみを増殖し、詳細なゲノム解析を行うことが可能となった。
研究の成果と意義・今後の展開
本研究では、オルガノイド培養技術を応用し、健常人と潰瘍性大腸炎の患者の大腸組織の体外培養を行い、それぞれの幹細胞でどのように遺伝子変異が生じているかを明らかにしました。
その結果、潰瘍性大腸炎の患者では、炎症によって、大腸上皮に蓄積している遺伝子変異の頻度が健常人と比較して増えていることが分かりました。しかし、炎症を原因とする遺伝子変異の頻度の増加は小さいものでした。
そこで、変異の量的な変化ではなく、どの遺伝子に変異が蓄積しているかの質的な変化に着目した結果、潰瘍性大腸炎の患者の大腸上皮幹細胞では、がんの発症に寄与する遺伝子変異は比較的少なく、一方で炎症を引き起こすサイトカインの一つであるIL-17(インターロイキン17)を介した炎症シグナルの経路上に、さまざまな遺伝子変異があることを発見しました(図2)。
この遺伝子変異のクローンの広がりを調べるため、生検鉗子(注8)で採取された領域に含まれる全ての大腸幹細胞に、どの程度これらの遺伝子変異が生じているか、より多くの患者由来のサンプルを用いて探索しました。
調査した潰瘍性大腸炎の患者45人のうち6割の27人でこれらの遺伝子変異が確認され、また、大腸がんを合併している患者では75%以上の症例でがんではない大腸上皮細胞に遺伝子変異が生じていました。さらに、これらの遺伝子変異をもつ幹細胞のクローンが増えていることを確認しました。
活動性潰瘍性大腸炎の患者の大腸上皮細胞は、炎症により慢性的に細胞傷害が生じており、IL-17はこのような炎症を引き起こす物質のうち重要な役割をもつことが知られています。これらの遺伝子変異が生じている細胞と正常な細胞においてこのIL-17により刺激した際の細胞傷害性について比較しました。
その結果、正常な大腸上皮細胞はプログラムされた細胞死(アポトーシス)(注9)を起こしますが、遺伝子変異が生じた大腸上皮細胞はアポトーシスに耐性を示し、IL-17の存在下(IL-17による炎症下)でも生存可能であることが確認されました。
このことから、生体内での炎症下において、正常な細胞は細胞傷害が生じ脱落するのに対し、今回同定した遺伝子変異が生じた細胞は細胞傷害を回避し生存し続けるため、徐々に変異細胞のクローンの領域が広がっていくことが考えられ(図3)、炎症によって特定の遺伝子変異が生じた大腸上皮細胞のクローンが増えていくメカニズムの実証に成功しました。
今回の研究で、多くの潰瘍性大腸炎患者の大腸上皮では、その炎症環境に適応するために幹細胞に炎症に対して耐性を獲得する遺伝子変異(=炎症耐性遺伝子変異)が蓄積し、さらにそのクローンの領域が拡大していくことが分かりました。これらの遺伝子変異は、大腸がんを合併した潰瘍性大腸炎の患者でより多く認められたため、潰瘍性大腸炎において大腸がんが発症するハイリスク患者のバイオマーカーとなることが期待されます。
一方で、がん自体にはこれらの炎症耐性遺伝子変異は認められないことから、がんは変異をもたない上皮から発生していると考えられ、炎症耐性遺伝子変異を持つことはその細胞のがん化には抑制的に働く可能性があります(図4)。
興味深いことに、これまでのマウスを用いた実験の報告から、今回発見した遺伝子変異が大腸粘膜に広がると、腸内環境が変化し、腸炎が悪化することが示されています。このことから、炎症耐性遺伝子変異はヒトの潰瘍性大腸炎においても、これを持つ細胞のがん化を抑制する一方、その作用により腸炎を悪化させ、周囲の変異を持たない細胞の発がん要因となっている可能性が考えられます。
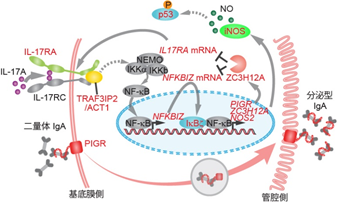
図2:潰瘍性大腸炎患者の大腸上皮幹細胞に蓄積する炎症耐性遺伝子変異今回見つかったIL-17シグナル上の遺伝子変異(赤字)。
IL-17Aが受容体に結合するとその下流のACT1(注4)やNFKBIZ(注5)が活性化し、最終的にiNOS(注6)を 介してp53(注7)が活性化し、細胞死に至る。

図3:炎症下で変異クローンが増加する仕組みIL-17による炎症下で、今回同定した遺伝子変異が生じた幹細胞クローン(青色)の領域は炎症による傷害への耐性をもち、長期の炎症過程でその遺伝子変異の領域が拡大する。
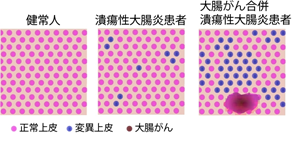
図4:炎症耐性遺伝子変異と大腸がん合併・発がんとの関係大腸がんを有する潰瘍性大腸炎の患者では、高い割合で遺伝子変異の幹細胞クローンの拡大を認める。
一方で、大腸がんは遺伝子変異を持たない大腸上皮を母地として発生する。
論文
- 英文タイトル:
- Somatic inflammatory gene mutations in human ulcerative colitis epithelium
- タイトル和訳:
- ヒト潰瘍性大腸炎患者大腸上皮における炎症関連遺伝子の体性変異
- 著者:
- 南木康作、藤井正幸、下川真理子、股野麻未、錦織伸吾、伊達昌一、高野愛、利光孝太、太田悠木、高橋シリラット、杉本真也、石丸和寛、川崎健太、永井陽子、石井亮太、吉田康祐、佐々木伸雄、日比紀文、石原聡一郎、金井隆典、佐藤俊朗
- 掲載誌:
- Nature
用語解説
- (注1)幹細胞:
- 自己複製能と多分化能を持つ細胞である。分化した細胞は子孫細胞を残さないため、自己複製能を持つ幹細胞に生じた遺伝子変異のみが排除されず蓄積する。
- (注2)陰窩:
- 大腸粘膜にある上皮細胞によって形成された無数のくぼみのことを指す。大腸の幹細胞は陰窩の底部に存在する。
- (注3)オルガノイド培養技術:
- 幹細胞を増殖の足場となるゲル中に包埋し、必要な細胞増殖因子を培養液中に加えて培養することによって、3次元構造体として長期間にわたって増殖可能にする培養技術である。本研究では、単一の幹細胞を増殖させることで、詳細なゲノム解析を可能とし、さらに遺伝子変異が生じたオルガノイドを用いてその遺伝子の機能を明らかにした。
- (注4)ACT1:
- IL-17Aのシグナル伝達に関与するアダプタータンパク質の一つであり、本研究において潰瘍性大腸炎の大腸で変異が検出された。同タンパク質をコードする遺伝子(TRAF3IP2)に変異が生じている細胞では、IL-17による炎症シグナルの伝達障害があり、アポトーシス(後述)が生じなかった。
- (注5)NFKBIZ:
- IL-17Aのシグナルの下流に存在する分子であり核内に局在する。本研究において潰瘍性大腸炎の大腸で変異が検出された。ACT1と同様に、変異が生じている細胞ではIL-17によるアポトーシス(後述)が生じなかった。
- (注6)iNOS:
- 窒素酸化物である一酸化窒素(NO)の産生に関与する酵素のうち炎症などによって誘導される分子である。NOはアポトーシス(後述)を引き起こす情報伝達物質の一つである。
- (注7)p53:
- アポトーシスを制御する因子であり、がん抑制遺伝子の一つ。潰瘍性大腸炎の発がんにも大きく関わっていることが知られている
- (注8)生検鉗子:
- 内視鏡検査の際に組織採取を目的として用いられる器具である。通常用いられるサイズの生検鉗子では約1-2mmの組織採取が可能である。
- (注9)アポトーシス:
- プログラムされた細胞死の一つ。何らかの異常が生じた細胞を個体や臓器の恒常性を維持するため、カスパーゼという酵素が働くことによって自死に導き排除する。
お問い合わせ先
慶應義塾大学医学部坂口光洋記念講座
(オルガノイド医学)
教授 佐藤 俊朗(さとう としろう)
AMED事業に関するお問い合わせ先
国立研究開発法人 日本医療研究開発機構
老化メカニズムの解明・制御プロジェクト
および革新的先端研究開発支援事業について
基盤研究事業部 研究企画課
次世代がん医療創生研究事業について
戦略推進部 がん研究課
【本リリースの発信元】
慶應義塾大学
信濃町キャンパス総務課:鈴木・山崎