新たながん治療薬開発の可能性を秘めたクロマチンリモデリング制御機構の理解へ
2019-12-18 分子科学研究所
KAIST(韓国科学技術院)のJi-Joon Song准教授、UNIST(蔚山科学技術大学校)のJa Yil Lee助教の研究グループは自然科学研究機構生命創成探究センター/分子科学研究所の加藤晃一教授および生命創成探究センター/名古屋大学の内橋貴之教授と共同で、ヌクレオソーム密度の調整を司るシャペロンタンパク質Abo1のクライオ電子顕微鏡による詳細な構造解析と、高速原子間力顕微鏡(高速AFM)[注1]による動態観察に初めて成功しました。
本研究成果は、日本時間2019年12月17日午後7時に、自然科学のあらゆる領域を対象としたオープンアクセス学術誌「Nature Communications」に公開されました。
研究の背景
真核生物において、DNAはヒストンタンパク質(H2A, H2B, H3,H4)各2分子ずつから構成されるヒストン八量体に巻き付いたヌクレオソーム構造を取ります。さらにそれらが数珠状に連なってクロマチン構造を形成することで、効率よくDNAを核内へと格納しています。限られた空間の中にコンパクトに詰め込まれたDNAは、転写・複製・修復反応の際に逐一引き出されて、再度詰め込まれる必要があり、すべての細胞はクロマチン構造を折りたたんだり、緩めたりを絶えず繰り返しています。すなわち、クロマチンを構成するヌクレオソームの状態(密度)の管理が生命機能の維持には必須です。ヌクレオソーム密度の管理にはATAD2(ATPase family AAA domain-containing protein 2)と呼ばれるタンパク質が関わっていますが、このATAD2は肺・膵臓をはじめとした様々ながん細胞において異常発現が見られ、がんの悪性化に密接に関連していることが知られています。これまでにATAD2を対象としたさまざまな研究が行われてきましたが、未だにその詳細な分子構造は明らかとなっていませんでした。
研究成果
本研究ではクライオ電子顕微鏡[注2]を用いて、ATAD2の酵母類縁分子であるAbo1の六量体構造を初めて明らかにしました。各ヌクレオチド状態における詳細な構造解析を行った結果、ATP(アデノシン三リン酸)結合時には非対称なスパイラル状(図1:緑)、ADP(アデノシン二リン酸)もしくは何も結合していない時(図1:ピンク及びグレー)には対称なリング構造を有しており、基質の結合によってダイナミックな構造変化が起こっていることが示唆されました。
また、DNAをガラス基板上にカーテン状に敷き詰め、同じ空間にヒストン, Abo1, ATPの混合溶液を流し入れたところ、蛍光標識されたヒストンがDNA上に特異的に吸着することが確認できました(図2:赤色で示された蛍光顕微鏡像)。これによりAbo1はATPのエネルギーを使ってヒストンをDNAへと導く機能を有することが示唆されました。
さらに高速AFMを用いて同分子を観察したところ、先のクライオ電子顕微鏡で得られた六量体構造を確認できただけではなく、ATP存在下において頻繁にその構造を変化させている様子を直接観察することに成功しました(図3)。このATP結合による構造変化は規則的なものではなく、ランダムに起こっていることも高速AFM解析から明らかになりました。
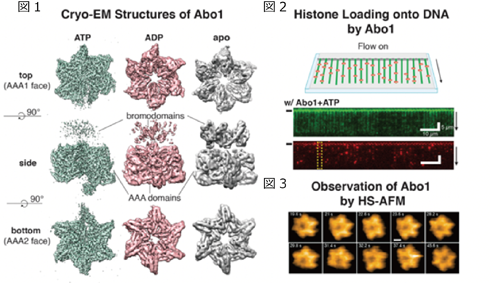
図1:クライオ電子顕微鏡により得られたATAD2の酵母類縁分子であるAbo1の構造
図2:DNA上に結合するヒストンの蛍光顕微鏡像
図3:高速AFMによって得られたAbo1の六量体構造及びその構造変化の様子
今後の展開
クロマチンリモデリング制御を理解するためには、ヌクレオソームの破壊や形成のメカニズムを分子レベルで知る必要がありますが、未だ解明されていない事が多いのが現状です。今回類縁分子であるAbo1の一分子レベルにおける構造が明らかとなりました。この成果がその他のヒストンシャペロンにおける構造や機能解明の足がかりとなり、クロマチンリモデリング制御のより深い理解へとつながることが期待できます。またATAD2が多くのがん細胞に発現していることから、今回の成果によって将来的に新たながん治療薬の開発に結びつくことが期待されます。
*本研究は、日本学術振興会(JSPS) 科学研究費補助金 若手研究(JP19K15412)、および生命創成探究センター(ExCELLS program No.18-403、No.19-402)等の サポートを受けて実施されました。*
掲載論文
雑誌名:Nature Communications
論文タイトル:Structural basis of nucleosome assembly by the Abo1 AAA+ ATPase histone chaperone.著者:Carol Cho*†, Juwon Jang†, Yujin Kang, Hiroki Watanabe, Takayuki Uchihashi, Seung Joong Kim, Koichi Kato, Ja Yil Lee*, and Ji-Joon Song*.
(†共同筆頭著者, *責任著者)
掲載予定日:2019年12月17日
DOI:10.1038/s41467-019-13743-9
発表者
Carol Cho(韓国科学技術院 助教)
Juwon Jang(韓国科学技術院 大学院生)
Yujin Kang(蔚山科学技術大学校 大学院生)
渡辺大輝(自然科学研究機構生命創成探究センター 特任助教)
内橋貴之(自然科学研究機構生命創成探究センター/名古屋大学 教授)
Seung Joong Kim(韓国科学技術院 教授)
加藤晃一(自然科学研究機構生命創成探究センター/分子科学研究所 教授)
Ja Yil Lee(蔚山科学技術大学校 助教)
Ji-Joon Song(韓国科学技術院 准教授)
用語解説
注1:高速原子間力顕微鏡(高速AFM)
走査型プローブ顕微鏡の一つであり、カンチレバー(片持ち梁)に取り付けられた非常に細い探針を用いて試料表面を高速に走査することによって、サンプルの構造や動態をリアルタイムで観察することが可能な顕微鏡。
注2:クライオ電子顕微鏡
電子顕微鏡によって生体分子の構造を、溶液中のような生理的な環境に近い状態で観察するために開発された手法。試料溶液を約-170℃中に落下させることで急速凍結させ、薄い氷の中に包埋する。この凍結させた試料を液体窒素冷却のもと電子顕微鏡観察する。このように冷却することで電子線照射による試料へのダメージを軽減させる。
本件に関するお問い合わせ先
(研究全般に関するお問い合わせ先)
自然科学研究機構 生命創成探究センター/分子科学研究所
教授 加藤 晃一
(報道に関するお問い合わせ先)
自然科学研究機構 生命創成探究センター
広報担当
自然科学研究機構・分子科学研究所
研究力強化戦略室 広報担当