2020-01-09 京都大学 アイセムス(物質-細胞統合システム拠点),科学技術振興機構
ポイント
- マウス胚のHes7遺伝子発現を1細胞レベルで計測できるライブイメージング系の構築。
- 脊椎動物の背骨などに見られる節目構造を作るために重要な細胞どうしの同期リズムをつかさどるメカニズムの一端を解明。
- Lunatic fringe遺伝子が機能しない組織では、細胞どうしの同期の乱れによってHes7遺伝子発現リズムが減弱することの発見。
- 隣接する細胞へのシグナル伝達が適切に遅れることが細胞どうしの同期に重要であることの発見。
京都大学 アイセムス連携PIの影山 龍一郎 教授(ウイルス・再生医科学研究所)、ウイルス・再生医科学研究所 吉岡 久美子 同 教務補佐員、同 松宮 舞奈 生命科学研究科博士課程学生(研究当時、現 欧州分子生物学研究所 研究員)、アイセムス 磯村 彰宏 特定助教らの研究グループは理化学研究所、東京大学の研究者と共同で、マウスの体節が形成される際にみられる細胞間で同期した遺伝子発現量の振動を生じさせるためには、細胞間シグナル伝達時間の適切な遅れが重要な役割を果たすことを明らかにしました。
脊椎動物では、受精卵から体が形づくられる発生の過程で、背骨・肋骨などの「節目」構造の元となる、体節と呼ばれる組織が周期的に形成されます。この体節形成の周期を制御するメカニズムは分節時計と呼ばれ、Hes7遺伝子の発現量がリズミカルに振動することがその中心的な役割を担っています。細胞内でのHes7遺伝子発現量の振動リズムが細胞間で同期することで、組織レベルのダイナミクスへつながります。この組織レベルでのHes7遺伝子発現量の同期が、規則正しい体節形成に重要であると考えられています。しかし、これまで、マウス胚において1細胞レベルでHes7遺伝子の振動を観察することが困難であり、細胞どうしの同期が生じる際の分子的なメカニズムは明らかにされていませんでした。
本研究では、新規の黄色蛍光タンパク質Achillesを用いたマウス胚のライブイメージングにより、Hes7遺伝子の発現量を1細胞レベルで計測し、個々の細胞での振動の様子を可視化することに成功しました。この系を用いて、糖転移酵素の1種であるLunatic fringe遺伝子が、細胞間のシグナルの伝達に適切な遅れを生み出し、これが同期を促進することを明らかにしました。この成果は、先天性脊柱側弯症などの遺伝疾患の発生メカニズムや、ホタルの集団発光やメトロノームの同期現象などといった自然界に普遍的にみられるリズム現象の同期メカニズムの理解につながると期待されます。
本成果は、2020年1月8日(英国時間)に国際学術誌「Nature」にオンライン掲載されます。
本研究成果は、科学技術振興機構(JST) 戦略的創造研究推進事業 CREST「生命動態の理解と制御のための基盤技術の創出」(研究総括:山本 雅 沖縄科学技術大学院大学 細胞シグナルユニット 教授)における「細胞増殖と分化における遺伝子発現振動の動態解明と制御」(研究代表者:影山 龍一郎)、さきがけ「光の極限制御・積極利用と新分野開拓」(研究総括:植田 憲一 電気通信大学 名誉教授)における「遺伝子発現の光制御と光計測による生体分子の動的機能の解明」(研究者:磯村 彰宏)、科研費、Brain/MINDSによる支援を受けて行われました。
脊椎動物では、受精卵から体が形づくられる発生の一時期に、背骨・肋骨などの「節目」構造の元となる、体節と呼ばれる組織が形成されます。体節は胚の後方にある未分節中胚葉(Presomitic mesoderm:PSM)より、一定の周期で生み出されます。体節の形成周期は動物種によりさまざまで、マウスでは2~3時間、ヒトの場合は約5時間となります。この体節の形成周期は、Hes7遺伝子の周期的な発現量の振動(オシレーション)により生じます。PSMにおいて、個々の細胞のHes7遺伝子発現量の振動は細胞間で同期し、組織レベルでの協調したリズムを生み出します。この振動により誘導される種々の遺伝子の働きにより、PSMの頭側部分が周期的にくびれ切れ、体節が形成されるのです。この細胞間の振動位相の調節の結果、同期が生じ、それが、秩序だった体節構造の形成に重要であると考えられています。この細胞どうしの同期が乱れると、体節の癒合や形態形成異常を引き起こします。このように、PSMにおけるHes7遺伝子発現量の振動の同期は正常な体節形成において非常に重要な要因です。しかしながら、個々の細胞の振る舞いを観察することが困難なため、その分子メカニズムの詳細は明らかにされていませんでした。
これまで、Notchシグナル経路がこの調節に重要であることがさまざまな生物種で報告されており、マウスでは、Notchシグナルの調節に関わる糖転移酵素Lunatic fringe(Lfng)遺伝子の発現量がHes7の下流で振動し、同期の調節を仲介していることが示唆されてきました。実際に、Lfng遺伝子を欠損したマウスでは、体節形成の周期性が乱れ、細胞間でHes7遺伝子の発現量が同期せずにばらつきがみられます。しかし、従来の解析は固定組織の観察に基づいており、個々の細胞における実際のHes7の動態は分かっていませんでした。Lfng遺伝子が同期メカニズムに果たす役割を明らかにするためには、個々の細胞におけるHes7遺伝子発現量の振動の位相を可視化し、定量する必要がありましたが、マウス胚においてそれを可能にする実験系は確立されていませんでした。
(1)1細胞レベルでHes7遺伝子発現を計測できるライブイメージング系の構築
本研究では、PSMの個々の細胞におけるHes7遺伝子発現量の振動位相を定量的に測定するために、Hes7遺伝子発現により蛍光を発するレポーターマウスの樹立と、ライブイメージングによる観察系を確立しました。半減期が約20分程度と非常に短命なHes7タンパク質の動態を追うためには、細胞内での蛍光タンパク質が持つ蛍光団の成熟に要する時間の短縮が鍵となります。そこで、既存の黄色蛍光タンパク質Venusを改良し、成熟速度を速めた新規の黄色蛍光タンパク質Achillesを開発しました。本研究ではPSMにおいてこのAchillesとHes7の融合タンパク質を発現することのできるレポーターマウスを樹立し、ライブイメージングを行うことで、1細胞レベルでHes7遺伝子の発現を定量できることを示しました。
(2)Lfng遺伝子が細胞どうしの同期調整に影響を与える
この系を用いて、野生型とLfng遺伝子が働かない変異型のPSMにおけるHes7遺伝子の動態を1細胞レベルで定量・比較しました。その結果、Lfng変異型PSMでは、個々の細胞におけるHes7の振動の振幅が弱まり、その周期が短くなること、また、振動位相の同期率が低くなることが明らかになりました。また、これらの細胞をばらばらにして分散培養することで、結果的にNotchシグナル経路を介した細胞間の同期調整のない状態で観察すると、同期はしないものの、振動周期や振幅の大きさにほとんど差がなかったことから、Lfngは主に細胞間の同期調整に影響を与えていると考えられます。
(3)Lfng遺伝子が隣接する細胞へのシグナル伝達時間を少し遅らせる働きをもつ
次に、Lfng遺伝子が細胞間の振動同期の調整に与える影響について明らかにするために、野生型とLfng遺伝子変異型のPSM細胞を混合培養した際の振動を調べました。細胞数比1:20の割合で野生型とLfng変異型の細胞を混ぜると、野生型の細胞は、約1/8周期進んだ位相ピークを示したことから、シグナルを送る細胞でLfngが失われると、受信側の位相を早めることが分かりました。また逆に、細胞数比20:1の割合で野生型とLfng変異型の細胞を混ぜると、変異型の細胞は野生型の細胞の振動位相に効率よく同期できなかったことから、Lfngはシグナルを受信する細胞でHes7遺伝子の振幅を調節することが示唆されました。さらに、近年確立したオプトジェネティクス注)によるNotchシグナル送信/受信細胞の計測系を用いた解析により、培養細胞において、Lfng遺伝子がシグナル送信細胞に発現していると、Notchシグナル伝達に要する時間が長くなることが明らかになりました。これは、Lfng遺伝子を発現する送信細胞で、Notchシグナル伝達に関わるDll1タンパク質の膜への輸送が遅れることに起因することが示唆されました。一方、Lfng遺伝子がシグナル受信細胞に発現していると、受信細胞での応答の振幅が大きくなることが分かりました。また、数理モデルによるシミュレーションから、適切な時間遅れが振動の同期に非常に重要であり、時間遅れを長く、あるいは短くすると、振動は減弱し、同期が低下することが示唆されました。このことから、LfngはNotchシグナル伝達の時間遅れを生じさせることにより、Hes7遺伝子による同期を調節していることが考えられました。
(4)シグナル伝達時間の遅れがもつ重要性について
最後に、同期の調節におけるシグナル伝達の時間遅れの重要性についてさらに検討するために、Lfng変異型遺伝子発現細胞において低分子化合物を加え、時間遅れを長くする効果のある化合物を探すレスキュー実験を試みました。ES細胞由来のPSM様組織を用いた薬剤スクリーニングでは、時間遅れに影響を与える複数の低分子化合物を見いだしました。その中で、Wntシグナル阻害剤として知られるKY02111が時間遅れを長くする効果を示し、Lfng変異型遺伝子発現細胞におけるHes7遺伝子の振動の振幅の大きさと同期率を部分的に回復させました。
以上の結果から、Lfng遺伝子がPSMにおいて細胞間のNotchシグナル経路を介し、伝達の時間遅れを延ばすことにより、振動の同期を調節していることが明らかになりました。
本研究は、細胞間のシグナル伝達の時間の調節が集団レベルのダイナミクスに及ぼす影響について明らかにしました。Lfng遺伝子はヒトにおける先天性側弯症の原因遺伝子として知られており、本成果は、病態の発生メカニズムの解明につながると考えられます。また、自然界に普遍的にみられるその他のリズム現象の同期メカニズムへの理解につながると期待されます。
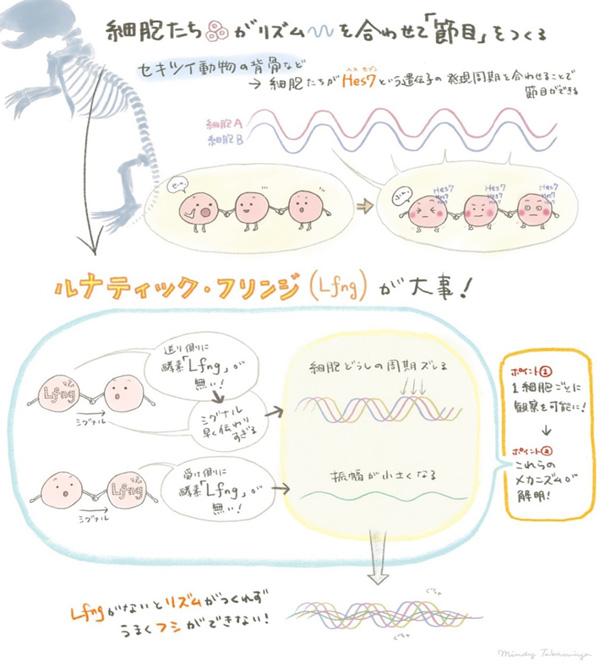
図1
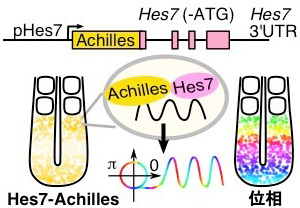
図2
- 注)オプトジェネティクス
- 光を細胞に照射し、光感受性タンパク質を利用して細胞の機能を操作する技術のこと。
- “Coupling delay controls synchronized oscillation in the segmentation clock”
(カップリングの時間遅れが分節時計における同期振動を制御する) - 著者:Kumiko Yoshioka-Kobayashi, Marina Matsumiya, Yusuke Niino, Akihiro Isomura, Hiroshi Kori, Atsushi Miyawaki, and Ryoichiro Kageyama
- DOI:10.1038/s41586-019-1882-z
影山 龍一郎(カゲヤマ リョウイチロウ)
京都大学 アイセムス連携PI/ウイルス・再生医科学研究所 教授
遠山 真理(トオヤマ マリ)
高宮 泉水(タカミヤ イズミ)
京都大学 高等研究院 物質-細胞統合システム拠点 パブリックエンゲージメントユニット
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
科学技術振興機構 広報課