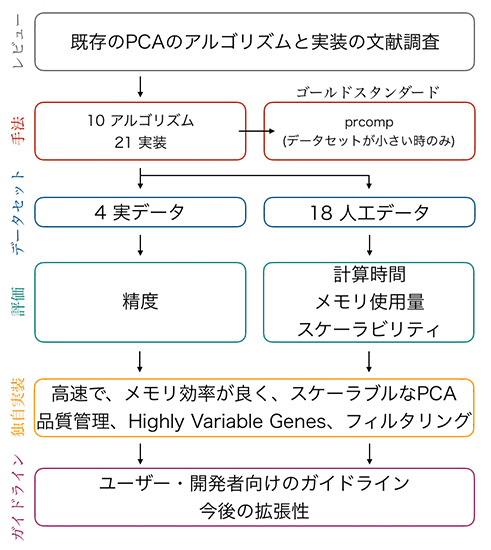
従来抗体がアプローチ出来なかった細胞内タンパク質の機能阻害が可能に
2020-01-17 東邦大学,日本獣医生命科学大学,理化学研究所,上海科技大学,自治医科大学,東北大学
東邦大学、日本獣医生命科学大学、理化学研究所、上海科技大学、自治医科大学、東北大学大学院生命科学研究科の研究グループは、従来の抗体では不可能であった細胞内のタンパク質の機能阻害を可能にする、安定細胞内抗体 (Stable cytoplasmic antibody: STAND)の汎用的作製技術の開発に世界で初めて成功し、神経活動の抑制や、undruggableなヒトがん遺伝子産物として知られるKrasの機能抑制に成功しました。
この開発は、細胞内タンパク質の機能操作による、生命現象の理解や疾患治療薬の開発につながるものです。
発表のポイント
- pH6.6でも強いネガティブチャージを持つペプチドタグの融合で細胞内抗体を安定化
- 細胞内で凝集する不安定な抗体も安定化することにin vitroと in vivoで成功
- 安定細胞内抗体STANDにより、神経活動の抑制や、ヒトがんの約25%に関わるrasファミリーの一つKrasの機能抑制にin vivoで成功
発表概要
基礎生物学において、抗体は標的タンパク質の局在や機能解析に利用されていますが、疾患治療薬としても副作用が低く有効性の高い医薬品として世界中で利用されています。生命現象の基礎となるシグナル伝達において、タンパク質間相互作用が重要な役割を果たしています。このタンパク質間相互作用の増減によりシグナル伝達が調節されますが、タンパク質間相互作用の異常増加が疾患の発症に繋がることが分かっています。
このタンパク質間相互作用は一般的に作用面積が広く浅いため、低分子化合物による阻害は著しく困難であるとされています。一方、抗体は標的分子の3次元構造に特異的に結合するため、タンパク質間相互作用の阻害が可能です。疾患の治療標的となり得るタンパク質間相互作用は細胞外だけでなく、細胞内にも多く存在しますが、現在の抗体は細胞内では不安定で、その使用は細胞外の標的に限定されていました。細胞内で抗体を使うことができれば、細胞内のタンパク質間相互作用の機能解明や未だ治療薬のない疾患の治療薬の開発につながりますが、細胞内の強い還元環境が抗体を不安定にするため、30年の間、汎用的な細胞内抗体の作製法の開発は成功していませんでした。
そこで、御子柴克彦チームリーダー(当時 理化学研究所 脳神経科学研究センター)、樺山博之研究員(同)、はこの問題に取り組み、安定に発現する細胞内抗体の作製法の開発に成功しました。今後は細胞内タンパク分子の機能解析にとどまらず、細胞内タンパク質間相互作用を標的とした疾患治療薬開発への応用が期待されます。
本研究成果は、東邦大学の御子柴克彦理学部特任教授(理化学研究所、上海科技大学)、日本獣医生命科学大学の樺山博之大学院特別研究生(STAND Therapeutics株式会社 代表取締役CEO、当時 理化学研究所)、自治医科大学の村松慎一特命教授、東北大学大学院生命科学研究科の福田光則教授らによるもので、英国科学雑誌『Nature Communications』(ネーチャー・コミュニケーションズ)(2020年1月17日)に掲載されました。
発表者名
御子柴 克彦 (東邦大学 理学部生物分子科学科 特任教授、
理化学研究所 生命機能科学研究センター 客員主管研究員、
上海科技大学 免疫化学研究所 教授)
樺山 博之 (日本獣医生命科学大学 獣医学部 獣医生化学研究室 大学院特別研究生、
STAND Therapeutics株式会社 代表取締役CEO、
当時 理化学研究所 研究員)
村松 慎一 (自治医科大学 オープンイノベーションセンター神経遺伝子治療部門 特命教授)
福田 光則 (東北大学大学院生命科学研究科 脳生命統御科学専攻膜輸送機構解析分野 教授)
発表内容
1、背景
疾患の発症に関与するタンパク質間相互作用は、細胞外に加え細胞内にも多く存在します。そのため、世界中で抗体医薬を細胞内へ届ける技術開発競争が行われてきました。しかし、抗体タンパクを細胞内へ送る効率が低いため、ヒトに投与するには非常に高すぎる濃度で投与する必要がある、あるいは標的細胞以外の細胞にも導入されるなど、克服できない技術的な壁が存在します。実際、2015年時点で認可・販売されている抗体医薬品は47種類ありますが、それらの標的はすべて細胞外分子であり、認可・販売された細胞内抗体はありません。今までに研究者が試みた手法の一つが、抗体タンパクの設計図である抗体遺伝子を細胞内へ送り込み、細胞内で抗体タンパクを作らせる、という戦略です。しかし、もともと抗体タンパクは、細胞内の小胞体の内腔で作られ、正しい構造にフォールディングされ、細胞外へと分泌されるタンパク質ですが、細胞質で作られると、強い還元環境下で抗体自身が正しくフォールディングできず、不安定で凝集してしまい、細胞へ障害を与えてしまうことが明らかとなっています。この細胞内の抗体が凝集してしまう問題は、1990年代から現在まで克服されていませんでした。
そこで御子柴克彦と樺山博之はこの問題に取り組みました。
2. 研究手法と成果
抗体タンパクは、2本の重鎖と2本の軽鎖がアセンブリしたYの字の形をした構造をしています(図1a)。重鎖と軽鎖、それぞれの先端の可変領域 (Fv)の中にアミノ酸配列がバラエティに富んだCDR (Complementary Determining Region)と呼ばれる領域があり、この領域を介して特異的に標的分子に結合することができます。柔軟なペプチドリンカー(注1)を介して重鎖と軽鎖のFvを一つのDNAにまとめた一本鎖抗体(single chain Fv: scFv) は特異的な抗原結合活性を維持した低分子化抗体遺伝子(約800塩基対)で、細胞内へ導入する抗体遺伝子として使われてきました(図1b)。しかし、scFv遺伝子を細胞質で発現させると、強く凝集してしまいます(図1c,矢印)。過去の研究では、ヒトscFvライブラリーでは安定発現成功率は0.1%以下との報告もあり、凝集することなく、安定にscFvを細胞質で発現させることは非常に困難でした。
先行研究から、scFvの持つ総電荷がネガティブチャージになると、凝集が低く抑えられる可能性が示唆されていました。一般に、タンパク質の総電荷は細胞質のpHが7.4であることを前提に計算されますが、pH 7.4におけるscFvの総電荷と凝集の相関は低いことが指摘されてきました。一方、最近の研究から、細胞質のpHは生体内では変動があり、細胞質内で局所的にpHの変動があることも示唆されています。タンパク質は固有の等電点(pI)を持ち、pHがそのpIを下回れば総電荷はポジティブチャージに、pHがpIを上回れば総電荷はネガティブチャージになります。これらのことから、細胞質のscFvは従来考えられてきたより低pHにさらされ、その環境下では、scFvのネガティブチャージが減少し凝集している可能性が考えられました。
そこで研究チームは、HeLa細胞(注2)を用いて、様々なscFvクローンの総電荷と細胞内凝集の関係を調べました。その結果、pH 6.6における総電荷と凝集には相関があり(図2a, 左)、pH 7.4における総電荷と凝集には相関が見られませんでした(図2a, 右)。また、scFvクローンのpIと凝集にも相関が見られました(図2b)。これらの結果は、低いpHにおいても強いネガティブチャージを持つことが細胞内抗体の安定発現に重要であることを示しています。緑色蛍光タンパク(GFP)タグは、pH 7.4においては、総電荷が-7.4で、GFPを融合したscFvを強いネガティブチャージにし、安定な細胞内発現が予想されますが、pIが5.95と比較的高く、pH 6.6においてはGFP融合scFvのネガティブチャージが激減し、実際には細胞内で強く凝集することが分かりました(図2a,左、右、矢印)。
このことは、安定細胞内抗体を作製する際に、pH 6.6においても強いネガティブチャージをscFvに持たせるようにペプチドタグを融合していくことが重要であり、pH 6.6でも強いネガティブチャージを持つ安定細胞内抗体をstable cytoplasmic antibody: STANDと名付けました。
本研究で作製されたSTAND-A36は、Synaptotagminに強く結合し(Kd: 12 nM)し、Synaptotagminとその結合タンパクSyntaxinとの細胞内結合を阻害することが分かりました。STAND-A36やその変異体STAND-M4をアデノ随伴ウイルス(AAV)ベクターに組み込み、マウス脳内の黒質ドーパミン神経細胞へ投与したところ、極めて安定な発現が観察されました(図3a-f)。マイクロダイアリシス法により(図3g)、このマウスの線条体でのドーパミン放出もコントロールSTAND-M4と比較し半減していることが分かりました(図3h)。しかし、線条体や黒質においてドーパミン総量には変化がありませんでした(図3i)。これは、STAND-A36が内因性のSynaptotagminに結合し、ドーパミンの放出過程を阻害していることを示しています。さらには、STAND-A36はロタロッド運動学習も阻害していることが分かりました。
次にこのSTAND法を、ヒトがんの約25%に関与するrasファミリーの一つであるKrasに結合するscFv-Y13-259に応用を試みました。scFv-Y13-259は1990年代に、細胞内で発現させると強く凝集することがすでに報告されていますが(図4a, 右、矢印)、STAND化(STAND-Y13-259)することで凝集することなく安定に発現します(図4a, 左、矢頭)。STAND-Y13-259は、Krasに強く結合し(Kd: 16 nM)、Krasとその結合タンパクRaf-1との細胞内結合を阻害することが分かりました(図4b)。ヒト膵臓癌患者由来のMIA PaCa-2細胞をヌードマウス皮下に移植したXenograftモデルを作製し、レンチウイルスベクターを用いてSTAND-Y13-259を導入したところ、in vivoで強い抗腫瘍活性があることが分かり(図4c, d)、STAND法が汎用性を持った技術であることが示されました。
3. 今後の期待
STAND法により、細胞内では凝集してしまうscFvでも安定化し、標的タンパク質に作用できるようになることから、様々なタンパク質間相互作用の研究が促進され、生命原理の理解に貢献することやSTANDをベースとした全く新しい治療薬の開発が期待されます。また、今回示されたKrasの阻害STANDは、がん細胞だけで増殖する腫瘍溶解性ウイルスベクターとの組み合わせにより、ヒト癌細胞選択的に送り込むことが可能と考えられ、従来の低分子化合物では困難であったヒト膵臓癌や大腸癌の治療薬の開発につながることも期待されます。
発表雑誌
雑誌名:「Nature Communications 」(2020年1月17日公開)
論文タイトル:An ultra-stable cytoplasmic antibody engineered for in vivo applications
著者:Hiroyuki Kabayama*, Makoto Takeuchi, Naoko Tokushige, Shin-ichi Muramatsu , Miyuki Kabayama, Mitsunori Fukuda, Yoshiyuki Yamada and Katsuhiko Mikoshiba.*(*:co-corresponding authors)
DOI番号:doi.org/10.1038/s41467-019-13654-9
アブストラクトURL
https://doi.org/10.1038/s41467-019-13654-9
用語解説
(注1)ペプチドリンカー
重鎖と軽鎖の可変領域をつなぐ短いアミノ酸配列からなるペプチド。
グリシンとセリンからなる柔軟な構造を持つGS(GGGGS×3)リンカーが一般的。
(注2)HeLa細胞
ヒト子宮頸癌由来の細胞。
添付資料

図1. (a) Whole IgGの模式図、(b) ScFvの模式図、(c) HeLa細胞の細胞質における従来抗体scFvの凝集

図2. (a) pH 6.6(左)またはpH 7.4(右)における様々なscFvクローンの総電荷とHeLa細胞内における凝集との相関、(b) 様々なscFvクローンのpIとHeLa細胞内における凝集の相関

図3. (a-f) AAVベクターによるSTAND-A36 (a-c)/M4(d-f)の黒質ドーパミン神経細胞における発現、
(g) マイクロダイアリシスの模式図 、(h) 線条体マイクロダイアリシスの結果、(i) 線条体と黒質における
ドーパミン量

図4. (a) ヒト膵臓癌由来細胞における細胞内抗体の発現(左、STAND-Y13-259; 右、Myc-Y13-259)、 (b) STAND-Y13-259による細胞内Kras-Raf1結合阻害、(c, d) Xenograft model. (c) Kras-driven tumor proliferationのSTAND-Y13-259による阻害
以上
お問い合わせ先
【研究に関するお問い合わせ先】
東邦大学 理学部生物分子科学科 特任教授
理化学研究所 生命機能科学研究センター 客員主管研究員(併任)
上海科技大学 免疫化学研究所 教授(併任)
御子柴 克彦
日本獣医生命科学大学 獣医学部 獣医生化学研究室 大学院特別研究生
STAND Therapeutics株式会社 代表取締役CEO
樺山 博之
自治医科大学 オープンイノベーションセンター 神経遺伝子治療部門
特命教授 村松 慎一
東北大学大学院生命科学研究科 脳生命統御科学専攻膜輸送機構解析分野
教授 福田 光則
【報道に関するお問い合わせ先】
学校法人東邦大学 法人本部経営企画部
日本獣医生命科学大学 学長室・企画調査課
理化学研究所 広報室 報道担当
自治医科大学 大学事務部 研究支援課
東北大学大学院生命科学研究科 広報室