2020-02-20 国立遺伝学研究所
■ 概要
意識や五感が保たれたまま、体を全く動かすことができなくなる難病、筋萎縮性側索硬化症(きんいしゅくせいそくさくこうかしょう、Amyotrophic lateral sclerosis、以下、ALS(エーエルエス)と略す)は、根本的な治療法がない最も過酷な病の一つといわれています。ALS で障害をうける神経細胞「運動ニューロン」が、いつ、どのように機能を失い始めるのかについては明らかになっておらず、そのことが治療法の開発を妨げています。
この問題を解決するために、本研究グループは、光を使って TDP-43(ティーディーピー 43)というタンパク質を操作する技術を開発し、ALS にみられる様々な運動ニューロンの異常を光照射によって再現することに世界で初めて成功しました。
浅川和秀准教授らは、ALS の運動ニューロンで塊を形成することが知られている TDP-43 に、青い光を吸収すると塊を形成するように改変を加え、塊の形成を光照射によって自在に調節する技術を開発しました。光の照射を開始した後、TDP-43 の塊が形成される前に照射を停止しても、運動ニューロンに異常が現れることが明らかになり、これまで予想されていたよりも早い段階で、TDP-43 が運動ニューロンに障害を及ぼしていることがわかりました。塊の形成に先立つ TDP-43 の集合を防ぐことが、有効な ALS の治療法になると期待されます。
本研究の成果は、英国科学雑誌「Nature Communications」に 2020 年 2 月 21 日 19 時(日本時間)に掲載されます。本研究は、東京医科大学ケミカルバイオロジー講座の浅川和秀准教授、半田宏特任教授、情報・システム研究機構 国立遺伝学研究所の川上浩一教授による共同研究グループによって実施されました。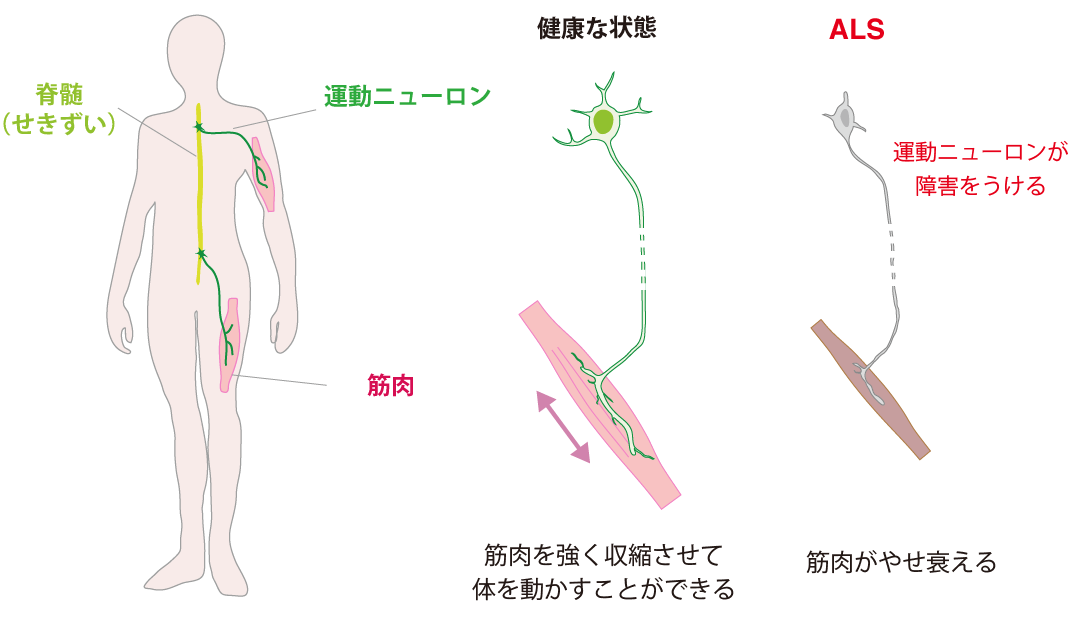
図 1:ALS では、運動ニューロンが障害を受け、筋肉がやせ衰える。
■ 成果掲載誌
本研究成果は、英国科学雑誌「Nature Communications」に 2020 年 2 月 21 日 19 時(日本時間)に掲載されます。
論文タイトル: Optogenetic modulation of TDP-43 oligomerization accelerates ALS-related pathologies in the spinal motor neurons
(光遺伝学を用いた TDP-43 の多量体化は、脊髄運動ニューロンの ALS 病態を促進する)
著者: Kazuhide Asakawa, Hiroshi Handa, Koichi Kawakami (浅川和秀、半田宏、川上浩一)
■ 研究の詳細
⚫ 研究の背景
ALS(エーエルエス、Amyotrophic lateral sclerosis、筋萎縮性側索硬化症、きんいしゅくせいそくさくこうかしょう)は、知性や五感が保たれたまま、全身の筋肉が徐々に衰える神経難病です。10 万人におよそ 2 人の割合で発症することが知られており、日本では、約 9,200 人がこの病気を患っています。発症から平均2〜3年で死に至る、難病中の難病ともいわれる過酷な病です。
ALS は、筋肉を収縮させる「運動ニューロン」と呼ばれる神経細胞が変性することで発症します(図1)。90%以上の ALS は、家族や近親者に ALS を患った人がいない孤発性(こはつせい)とよばれるタイプであり、1つの遺伝子変異が原因ではないため、発症の仕組みの解明が特に遅れています。
今から 14 年前に、孤発性 ALS の運動ニューロンに形成される塊の主成分が、TDP-43 というタンパク質であることが発見されました。しかし、体の奥深くにある運動ニューロンの TDP-43 を研究することは非常に困難であり、TDP-43 の塊と運動ニューロンの変性の因果関係を検証するには至っていませんでした。
⚫ 本研究の成果
本研究グループは、光照射によって塊の形成を調節できる改変型ヒト TDP-43 を開発し、ALS の状態によく似た運動ニューロンの異常を、モデル生物ゼブラフィッシュ(1)の生体内で再現することに成功しました。TDP-43 の塊の形成は、タンパク質の集合による「細胞核(さいぼうかく)から細胞質(さいぼうしつ)への移行(2)」、「細胞質における塊の形成」の2つのステップからなることが明らかになりました(図2)。このうち、光の照射量を調節して「細胞核から細胞質への移行」を誘発するだけでも、運動ニューロンが萎縮し、筋肉との結合が弱くなることがわかりました。さらに、長期にわたって光を照射し続けると、泳ぐことが困難になる魚が現れました。
運動ニューロンは、複雑な形をした大きな細胞であるため、ヒトや、マウスなどの大型の実験モデル動物では細胞の全体像を捉えることが難しく、ALS 研究の障壁となっています。一方で、体が小さくて透明に近いゼブラフィッシュは運動ニューロンの観察に適しています。本研究グループが、過去 10 年にわたって独自に開発を積み重ねてきたゼブラフィッシュの操作・観察技術(図3)により、「体の奥深くにある運動ニューロンの中の TDP-43 を、光を使って遠隔操作すること」と、「それにともなって運動ニューロン全体に現れる変化を経時的に詳しく観察すること」が可能になり、今回の研究成果につながりました。
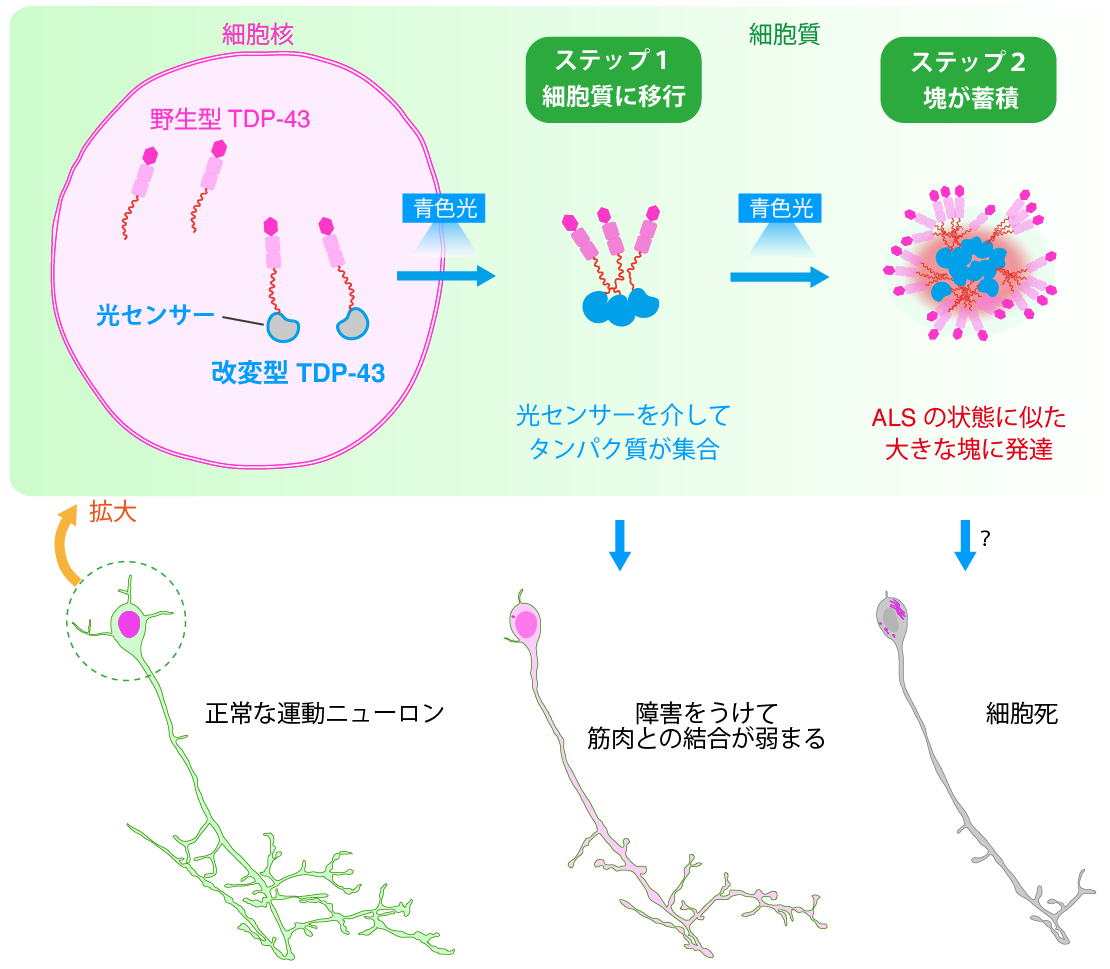
図 2:TDP-43 の細胞質への移行によって、運動ニューロンは障害を受け、筋肉との結合が弱まる。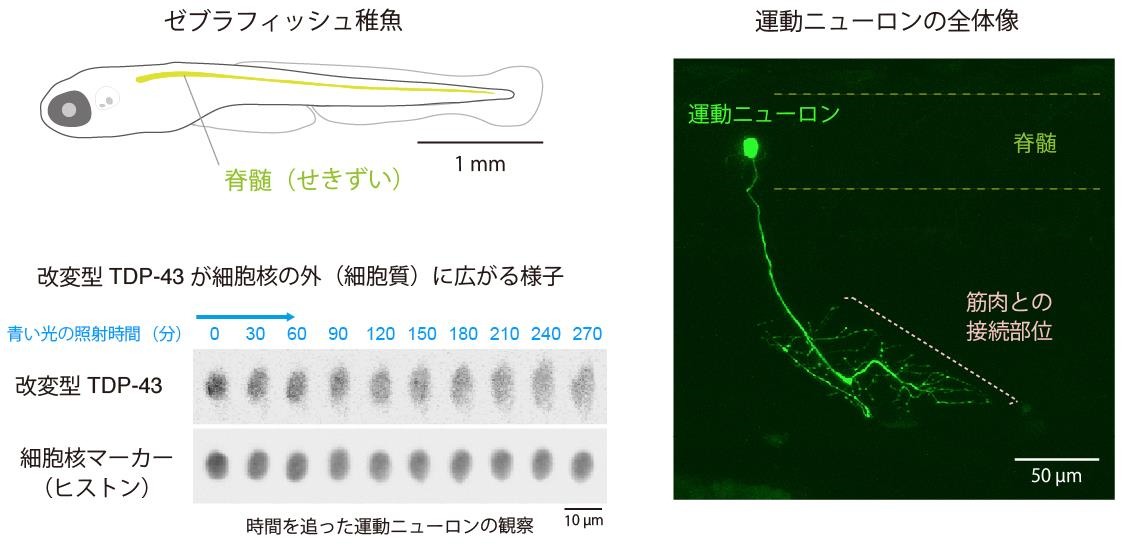
図 3:動物を生かしたまま、運動ニューロンの全体像と、その中で活動する TDP-43 を観察できる。
今後の期待
本研究によって、TDP-43 の塊が形成され始めると、それがきっかけとなって、運動ニューロンが機能を失い始めることが、世界で初めて示されました。塊の発達に先立つ TDP-43 の集合(オリゴマー化(3))を防ぐことが、ALS の有効な治療法になると考えられます。本研究で開発されたゼブラフィッシュ ALS モデルは、このプロセスを直接観察できる非常に有用な研究材料であり、ALS 創薬への応用が期待されます。
■ 用語解説
(1) ゼブラフィッシュ
インド原産の体長 4cm ほどの小型の熱帯魚。生後数週間の稚魚期には、体の組織が透明に近く生体内の細胞の観察に適していている。ヒト遺伝子のおよそ7割に対応する遺伝子を持っている。
(2) 細胞核と細胞質
細胞核(さいぼうかく)は、細胞の中にある、遺伝情報を含んだ膜に囲まれた球形の構造。細胞質(さいぼうしつ)は、細胞核の外側の領域。
(3) オリゴマー化
比較的少数のタンパク質などの分子が、結合を介して集合し小さな塊を形成すること。
■ 研究体制と支援
本研究は、東京医科大学ケミカルバイオロジー講座の浅川和秀准教授(国立遺伝学研究所客員研究員)、半田宏特任教授と、国立遺伝学研究所の川上浩一教授による共同研究グループによって実施されました。
また、本研究は、せりか基金、「生命の彩」ALS 研究助成基金、加藤記念難病研究助成基金、第一三共生命科学研究振興財団、武田科学振興財団、文部科学省の科学研究費補助金(JP16K07045、JP19K06933、JP15H02370)、ナショナルバイオリソースプロジェクト(NBRP[AMED])の支援を受けて実施されました。
■ 問い合わせ先
<研究に関すること>
⚫ 東京医科大学ケミカルバイオロジー講座
准教授 浅川 和秀 (あさかわ かずひで)
<報道担当>
⚫ 国立遺伝学研究所リサーチ・アドミニストレーター室 広報チーム