定量バイオイメージングの落とし穴
2019/01/11 京都大学
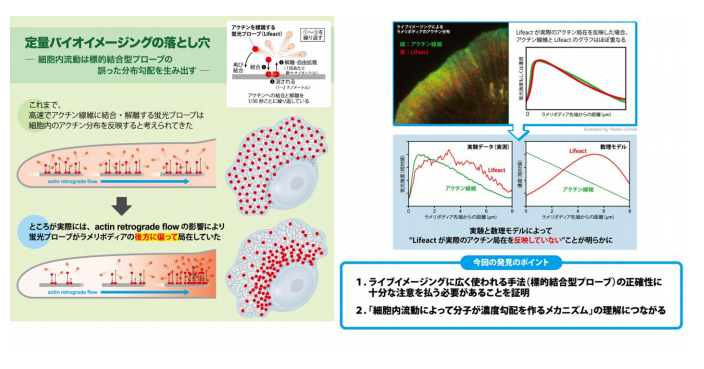
山城佐和子 生命科学研究科講師、渡邊直樹 同教授らの研究グループは、汎用されるアクチン結合プローブのLifeact が、アクチン線維流動の影響により細胞仮足の後方に偏る局在ミスを示すことを、実験と数理モデルにより明らかにしました。
定量的な蛍光バイオイメージングは、細胞が生きた状態における生体分子の時空間的情報を得るアプローチであり、生命科学の様々な分野で広く行われています。細胞内で生体分子を観察するには、目的の生体分子に結合する「標的結合型蛍光プローブ」を細胞内に導入し、可視化する手法がよく用いられます。目的の分子の動態を的確に解析するためには、蛍光プローブは、生体分子の細胞内局在を正確に反映する必要があります。
本研究成果は、定量イメージングに汎用される標的結合型プローブの正確性に対する注意喚起であり、また、Lifeact が細胞の先端から後方にかけて濃度勾配をもって分布することから、細胞内流動によって分子が濃度勾配を作るメカニズムの理解につながる発見です。
本研究成果は、2019年1月8日に、国際学術誌「Biophysical Journal」のオンライン版に掲載されました。

図:本研究の概要
書誌情報
【DOI】https://doi.org/10.1016/j.bpj.2018.11.022
Sawako Yamashiro, Daisuke Taniguchi, Soichiro Tanaka, Tai Kiuchi, Dimitrios Vavylonis, Naoki Watanabe (2019). Convection-Induced Biased Distribution of Actin Probes in Live Cells. Biophysical Journal, 116(1), 142-150.
詳しい研究内容について
―定量バイオイメージングの落とし穴―概要
定量的な蛍光バイオイメージングは、細胞が生きた状態における生体分子の時空間的情報を得るアプローチであり、生命科学の様々な分野で広く行われています。細胞内で生体分子を観察するには、目的の生体分子に結合する「 標的結合型蛍光プローブ」を細胞内に導入し、可視化する手法がよく用いられます。目的の分子の 動態を的確に解析するためには、蛍光プローブは、生体分子の細胞内局在を正確に反映する必要があります。
京都大学大学院生命科学研究科 山城佐和子 講師、渡邊直樹 同教授らは、汎用されるアクチン結合プローブの Lifeact「 が、アクチン線維流動の影響により細胞仮足の後方に偏る局在ミスを示すことを実験と数理モデ ルにより明らかにしました。本成果は、定量イメージングに汎用される標的結合型プローブの正確性に対する 注意喚起です。また、Lifeact「 が細胞の先端から後方にかけて濃度勾配をもって分布することから、細胞内流 動によって分子が濃度勾配を作るメカニズムの理解につながる発見です。
本研究成果は、2019 年 1 月 8 日に米国生物物理学会誌 Biophysical「 Journal」にオンライン掲載されまし た。
 1.背景
1.背景生きた細胞の中で生体分子の動態を計測する定量的な蛍光バイオイメージングは、様々な生命現象の解明に 役立っています。細胞内で目的の生体分子を可視化するためには、目的の生体分子に結合する「 標的結合型蛍 光プローブ」を細胞内に導入し、顕微鏡観察する手法がよく用いられます。 アクチン細胞骨格は速やかに崩壊「 再編成されるダイナミックな構造体であり、細胞の移動や形態制御、分 裂など、様々な細胞現象で中心的な役割を果たします。
アクチンのライブイメージングには、Lifeact「 という 2008 年に紹介された比較的新しいアクチン標識プローブ(プローブは、特定の物質を検出するための物質を いう)が汎用されます。Lifeact は酵母の Abp140 タンパク質に由来する 17 アミノ酸のアクチン結合ペプチド で、蛍光標識して細胞内に導入した場合、1/30 秒程度の非常に速いスピードでアクチン線維に結合 解離を 繰りかえします(図1)。このような性質から Lifeact は、細胞内のアクチンダイナミクスに影響を与えずに、 均等にアクチン構造を標識する理想的なプローブであると考えられていました。
2.研究手法・成果
今回の研究では、生細胞における Lifeact の局在を、実際のアクチン局在と比較しました。その結果、細胞 の伸展部にあるラメリポディア(葉状仮足、図2)において、実際のアクチン局在と Lifeact「 は一致せず、 Lifeact が後方に偏る局在ミスを示すことに気がつきました。また、Lifeact に加えて、アクチン線維に特異的 に結合するファロイジンについても、同様の局在ミスが観察されました。ラメリポディアは高密度のアクチン 線維網目状構造を持ち、内部のアクチン構造は、絶え間なく細胞辺縁から中心に向かって流動しています。こ の現象は求心性アクチン線維流動(レトログレードフロー)と呼ばれます(図2)。私たちは、流動するアク チン構造は、たとえわずかな結合時間であっても、アクチン結合プローブをラメリポディアの後方に集積させ る効果があると考えました。そこで、流動に起因する分子勾配配置モデル (convection-induced「 gradient「 distribution「 model)「 を作り、偏微分方程式を用いた数理モデル解析による検証を行いました。その結果、 Lifeact のように非常に結合 解離の速いプローブでも、アクチン線維流動はアクチン結合プローブの分布に 非常に強く影響することが証明されました(図3)。
3.波及効果、今後の予定
光学顕微鏡技術の発展に伴い、定量バイオイメージングはその重要性が増してきています。本研究成果は、 定量イメージングにおいて汎用される「 標的結合型蛍光プローブ」が、細胞内流動の影響を受けて不正確な分 布を示すことを初めて明らかにしました。蛍光プローブが、標的生体分子の動態を反映するかどうかは、定量 イメージングで得られるデータの信頼性の要です。今後は、標的結合型プローブの使用に際して、十分な注意 を払う必要があることを生命科学の分野で広く注意喚起することが期待されます。実際、私たちは過去にファ ロイジンを用いて定量イメージングを行った研究 (Wilson「et「al.,「Nature,「2010)「 を再検証しました。アクチン 結合プローブの代わりに、蛍光標識アクチンを用いて標的であるアクチンを直接可視化したところ、過去の研 究と相反する結果が得られました (Yamashiro「et「al.,「MBoC,「2018)。また本研究成果は、細胞内流動によって 分子が濃度勾配を作るメカニズムの理解につながる発見です。今後、本研究が提案する分子勾配配置モデルが、 細胞内で実際に働いているかどうか、明らかにしていく予定です。
4.研究プロジェクトについて
本研究は、下記機関より資金的支援を受けて実地されました。
● 日本学術振興会 (JSPS)「 科学研究費補助金
● 米国国立衛生研究所 (NIH)「RO1 グラント
● 科学技術振興機構 (JST)「 戦略的創造研究推進事業 (CREST)「 「 統合1細胞解析のための革新的技術基盤」
● 上原記念生命科学財団
<研究者のコメント>
アクチン結合プローブであるファロイジンの生細胞における局在が、実際のアクチン局在と異なることは、 10 年以上前に既に報告されていました(Vallotton「et「al.,「MBoC,「2005)。しかし、ファロイジンの局在ミスは 見過ごされ、その後も定量イメージングに用いられてきました。本研究は、細胞内流動に起因する標的結合型 プローブ局在ミスのメカニズムを明らかにし、定量イメージングの軌道修正に貢献する重要な成果であると考 えています。
<論文タイトルと著者>
タイトル: Convection-induced「biased「distribution「of「actin「probes「in「live「cells (流動に起因するアクチン プローブの勾配配置による局在ミス)
著 者: 山城佐和子、 谷口大相、田中聡一郎、木内泰、 Dimitrios「Vavylonis、渡邊直樹 掲 載 誌: Biophysical「Journal
DOI:10.1016/j.bpj.2018.11.022.
<イメージ図>
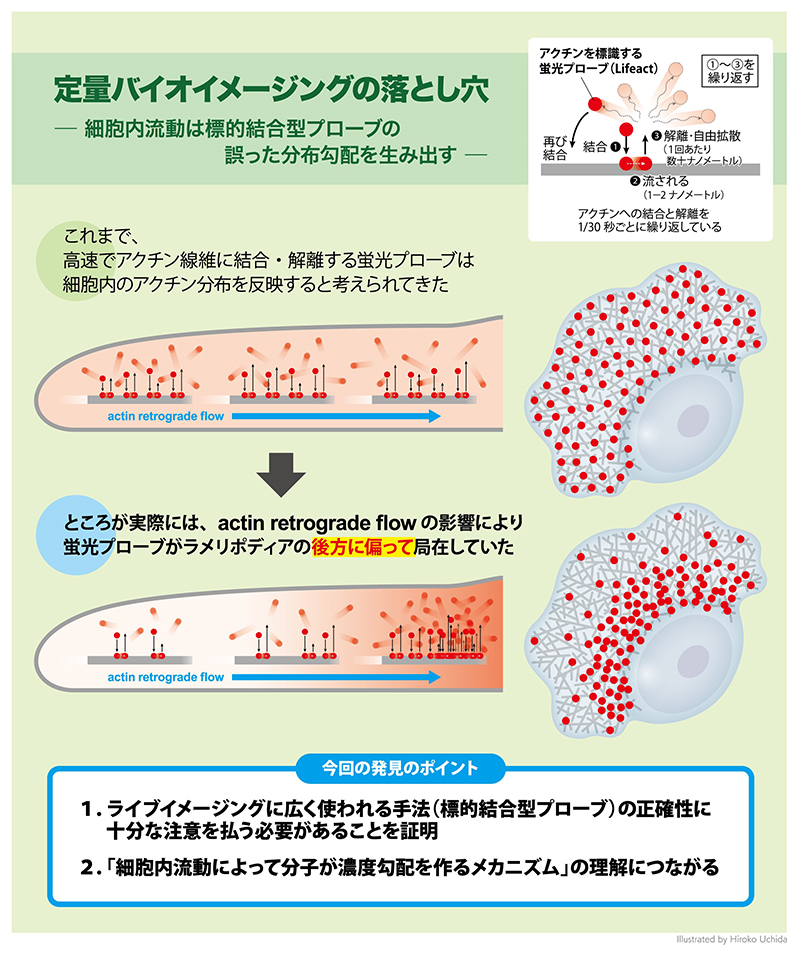
図 1. 本研究成果の概要
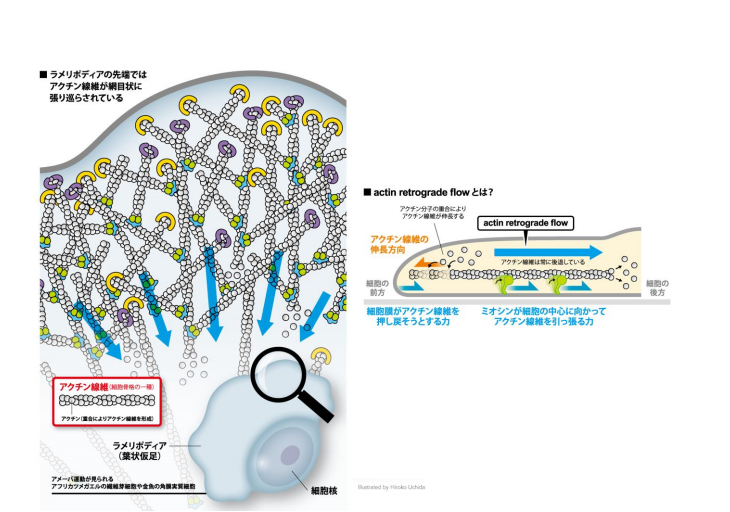
図 2. ラメリポディア(左)とアクチンレトログレードフロー(右)の模式図
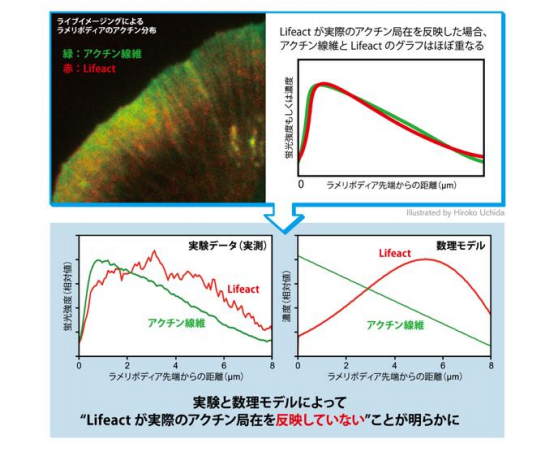
図 3. Lifeact が後方に偏る局在ミスが実験と数理モデルの両方で証明された。