2023-05-25 名古屋工業大学
発表のポイント
〇 高度に発達した目をもつハコクラゲは、原始的な無脊椎動物(刺胞動物)であるにも関わらず、目の中で光受容機能を担うタンパク質(クラゲロドプシン(注1))が、哺乳類などの脊椎動物とよく似た光反応特性を示すことが明らかになりました。
〇 クラゲロドプシンが示す、脊椎動物ロドプシンと類似の光反応特性は、光吸収・反応機能に重要なアミノ酸残基の特異な位置によるものであることを、赤外分光とAIを活用した構造解析から明らかにしました。
〇 ヒトを含めた動物に視覚機能をもたらす、最初の機能性タンパク質であるロドプシンの進化の謎に迫る新たな知見を得ました。
〇 クラゲロドプシンを新規光遺伝学(注2)ツールとして応用するための分子基盤の理解を促進することが期待されます。
概要
名古屋工業大学大学院工学研究科の犬飼紫乃氏(工学専攻生命・応用化学系プログラム 博士前期課程2年)、片山耕大 准教授、神取秀樹 特別教授、大阪公立大学大学院理学研究科の寺北明久 教授、小柳光正 教授らの研究グループは、高度に発達した目をもつハコクラゲが、進化の過程でロドプシン(クラゲロドプシン)中の特異な位置にカウンターイオン(注3)を移動させた結果、脊椎動物ロドプシンとよく似た光反応特性を示すようになったことを明らかにしました。そして、カウンターイオンの位置が異なる3種(クラゲ:原始的な無脊椎動物(刺胞動物)、ウシ:脊椎動物、イカ:発達した無脊椎動物(軟体動物))のロドプシンで比較解析を行うことにより、クラゲロドプシンが辿った分子進化を裏付ける構造変化情報を取得することに成功しました。
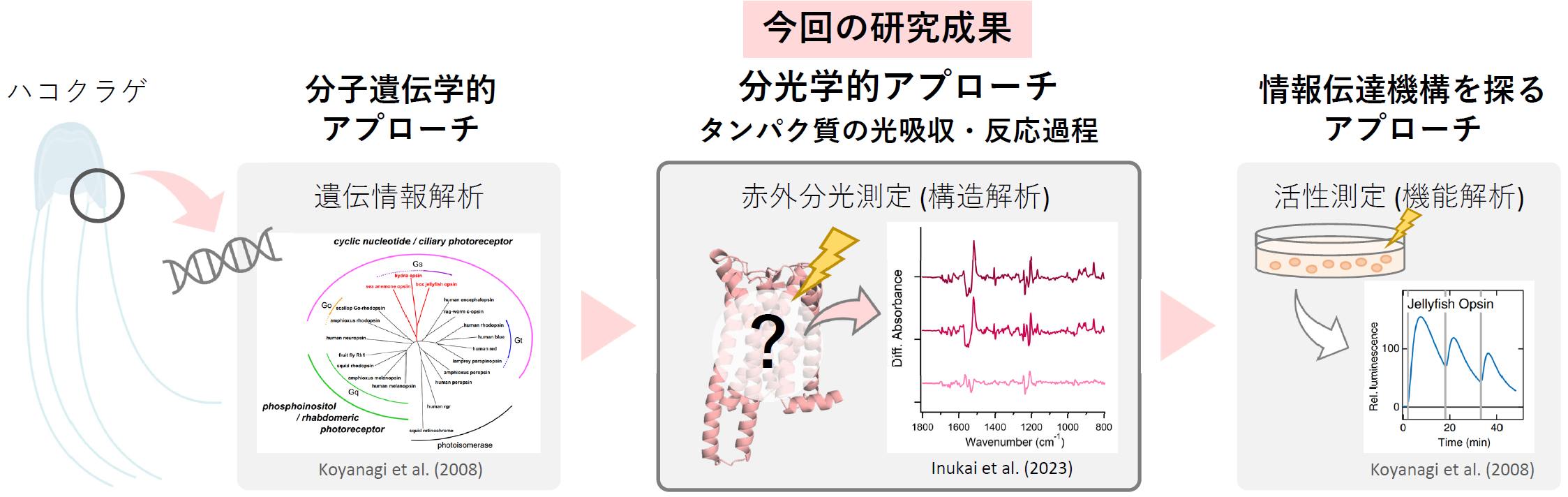
本研究成果の概要
本研究成果は、2023年5月24日に米国科学誌「The Journal of Biological Chemistry」誌に掲載されました。
研究の背景
私たちヒトを含む動物のほとんどは、ロドプシンと呼ばれる光受容膜タンパク質を利用することで視覚情報を伝達しています。ロドプシンは、そのタンパク質内部にビタミンA誘導体のレチナールという色素分子を結合しています。レチナールはその正電荷を帯びた部位(シッフ塩基結合)でロドプシンと結合しており、一方で、ロドプシンはその結合を安定化させるためにカウンターイオンという負電荷アミノ酸を有しています。レチナールは、それ自身は紫外光を吸収しますが、ロドプシンタンパク質の内部に結合することで可視光を吸収できるようになります。この際、私たちの視覚機能は、光吸収に伴い、レチナールのシス体からトランス体への異性化反応(注4)が引き起こされることで開始されます。これまでロドプシン内のカウンターイオンが、紫外光から可視光への吸収する光波長のシフト、そして”シス-トランス”異性化反応の制御に重要な役割を果たすことが報告されており、私たちの視覚機能が発揮される上で、カウンターイオンは不可欠なアミノ酸となっています。
このカウンターイオンがロドプシンの内部で存在する位置は、無脊椎動物ロドプシンと脊椎動物ロドプシンとで大きく異なっています。それらを比較した最近の研究から、脊椎動物が視覚機能を向上させる際に、どのようにロドプシンを進化させてきたかが分かってきました。例えば、無脊椎動物ロドプシンがもつカウンターイオンは細胞外の第2ループ(注5)に位置するのに対し、脊椎動物ロドプシンでは、カウンターイオンを膜貫通(注5)部位にある第3ヘリックス(注5)に移すことで、光情報伝達の増幅効率を向上させることが明らかになっています。近年、原始的な無脊椎動物でありながら高度に発達した目をもつハコクラゲ(刺胞動物)がもつクラゲロドプシンも脊椎動物ロドプシンと空間的に類似した位置である、膜貫通第2ヘリックスにカウンターイオンを移したことが明らかになりました(図1)。
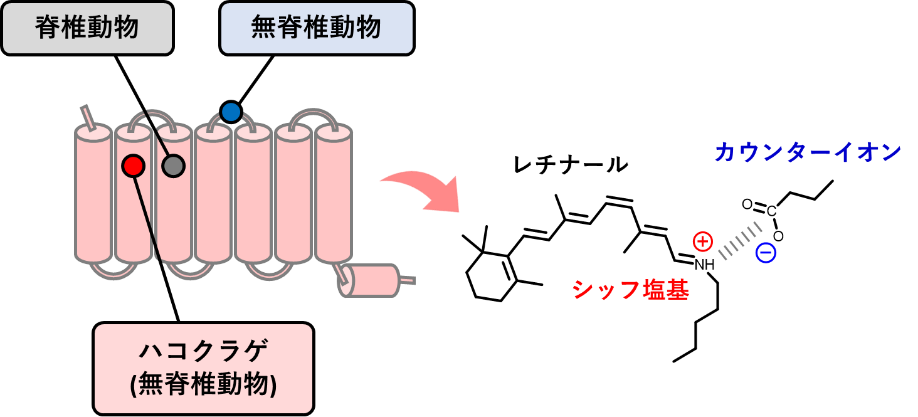
図1 カウンターイオン位置の変位
また、動物ロドプシンはGタンパク質共役型受容体(注6)の一種であり、受容した光の情報伝達を、Gタンパク質を介して伝えています。Gタンパク質の種類もいくつかある中で(Gt, Gi, Go, Gq, Gs, G12/13)(注7)、従来、無脊椎動物ロドプシンはGqタンパク質、脊椎動物ロドプシンはGt (i/o)タンパク質を介して情報伝達を行うのが一般的とされていました。一方、クラゲロドプシンは、これまで見つかっている1000種類を超える動物ロドプシンの中で、初めてGsタンパク質を介して情報伝達を行っていることが分かりました。Gsタンパク質の細胞内情報伝達物質は、細胞内セカンドメッセンジャーであるcAMPであることから、クラゲロドプシンは光で細胞内のcAMP濃度を上昇させる新たな光遺伝学ツールとしても、注目を集めています。このように、クラゲロドプシンは、動物ロドプシンが視覚機能を向上させる進化についての基礎研究や、光遺伝学ツールとしての応用研究において重要な位置づけであります。しかしながら、クラゲロドプシンが示す、光反応およびGsタンパク質を介した情報伝達に関する分子機構はこれまでほとんど分かっていないのが現状でした。
研究の内容・成果
今回、本研究グループは、液体窒素温度(77 K)での紫外可視およびフーリエ変換赤外分光測定を行うことにより、クラゲロドプシンが光吸収後、レチナールの”シス-トランス”異性化直後までに形成されるロドプシンタンパク質の構造変化を捉えることに成功しました。
具体的には、暗室下で調製したクラゲロドプシンを77 Kで凍結した試料に対し、光を照射する前後の赤外吸収スペクトルの差を計算することで、レチナールの異性化に伴う、反応開始前の状態から初期中間体への転移によって生じる構造変化を、赤外信号として原子レベルで捉えることを試みました。カウンターイオンの位置が異なる3種(クラゲ:原始的な無脊椎動物(刺胞動物)、ウシ:脊椎動物、イカ:発達した無脊椎動物(軟体動物))のロドプシンの初期中間体の赤外差スペクトルの精密な比較解析を行った結果、クラゲロドプシンに特徴的な構造情報を抽出することに成功し、クラゲロドプシンのレチナールのシッフ塩基由来の赤外信号が、ウシロドプシンと類似していることが分かりました。これは、クラゲロドプシンのレチナールシッフ塩基とカウンターイオンとの相互作用の強さが、ウシロドプシンのものと類似していることを示します(図2a)。
また、AIシステムを駆使したタンパク質構造予測ツールを活用してクラゲロドプシンのモデル構造を構築し、レチナールシッフ塩基とカウンターイオン間の距離を解析した結果、クラゲロドプシンとウシロドプシンは異なる膜貫通ヘリックスにカウンターイオンを有していながら(前者:第2ヘリックス、後者:第3ヘリックス)、ウシロドプシンのX線結晶構造から解析したシッフ塩基とカウンターイオン間の距離とほとんど同一の値を示すことが分かりました(図2b)。フーリエ変換赤外分光測定は、原子の位置情報を得ることはできませんが、分子の振動の変化をスペクトル変化として抽出することで、化学的な相互作用の変化を原子レベルで捉えることができる利点があります。今回、フーリエ変換赤外分光測定から得られた相互作用情報とAIシステムにより構築したクラゲロドプシンのモデル構造情報を組み合わせることで、初めてクラゲロドプシンのレチナールシッフ塩基とカウンターイオンとの空間的な位置関係を明らかにしました。
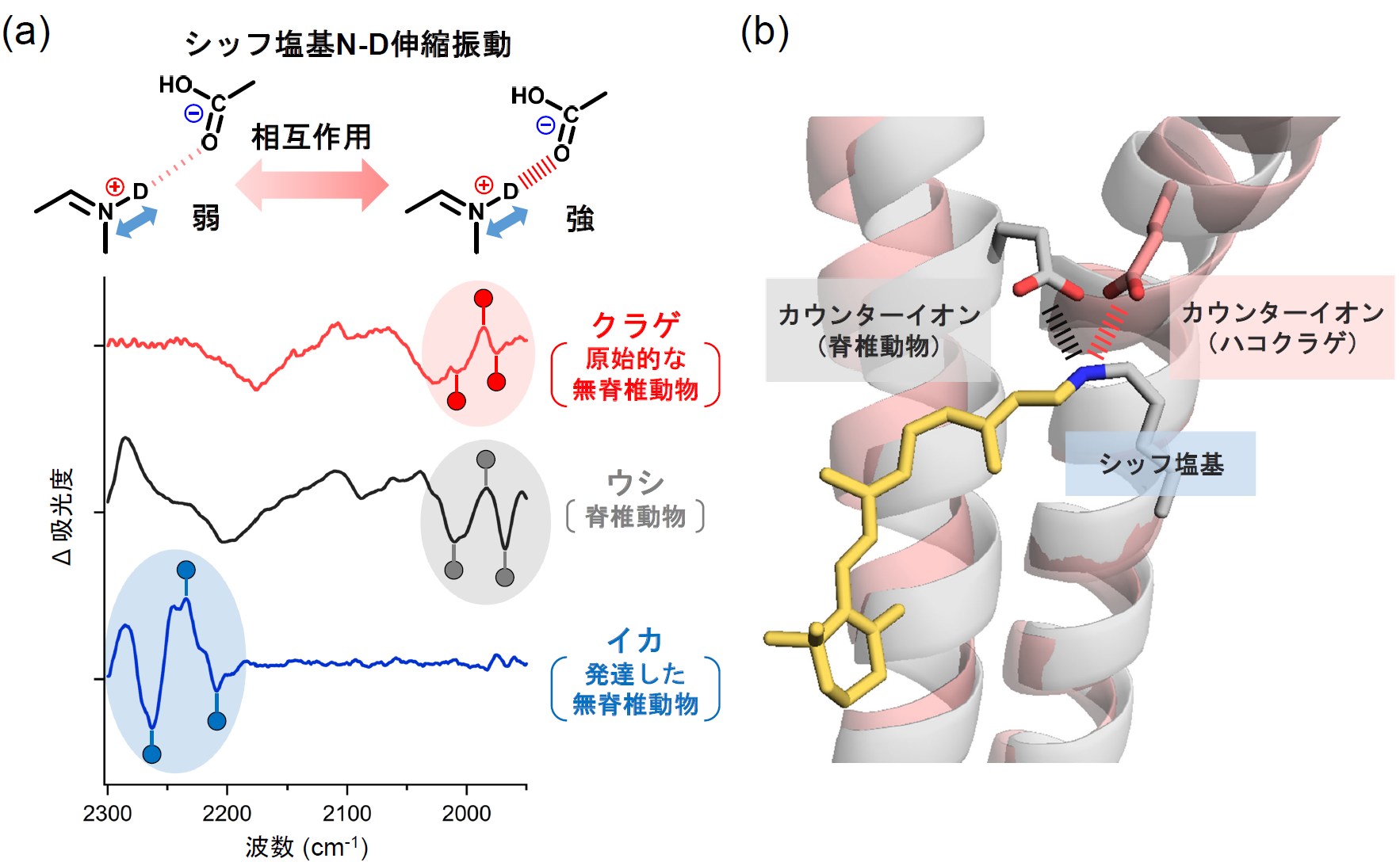
図2 (a) 赤外分光測定により観測した、クラゲ、ウシ、イカロドプシンのシッフ塩基N-D伸縮振動
(b) クラゲロドプシンのモデル構造(桃色)とウシロドプシンの立体構造(灰色)の構造比較
つまり、クラゲロドプシンは視覚機能を向上させる進化の過程で、脊椎動物ロドプシンと空間的に類似した位置に、カウンターイオンを配置していることが明らかになりました。さらに、レチナールの化学構造を反映した赤外信号の詳細な比較解析から、イカロドプシンよりもむしろウシロドプシンに近いスペクトル形状を示したことから、レチナールの異性化反応のプロセスもウシロドプシンとの高い類似性をもつことが分かりました。以上の結果から、無脊椎動物であるにも関わらず、ハコクラゲの目の中で光受容機能を担うロドプシンの光反応特性は、脊椎動物ロドプシンと同じ振る舞いを示すことが明らかになりました。
その一方で、クラゲロドプシンのレチナールの結合部を構成するアミノ酸の側鎖やαヘリックス構造、さらにタンパク質内部に特異的に結合した水分子の構造変化に反映した赤外信号の詳細な比較解析の結果、ウシロドプシンとイカロドプシンのそれぞれに似たスペクトル変化(中間的なスペクトル形状)を示すことが分かりました(図3)。今回の結果は、クラゲロドプシンが唯一、Gsタンパク質を介した光情報伝達を行うための、特徴的な構造変化を示している可能性があります。
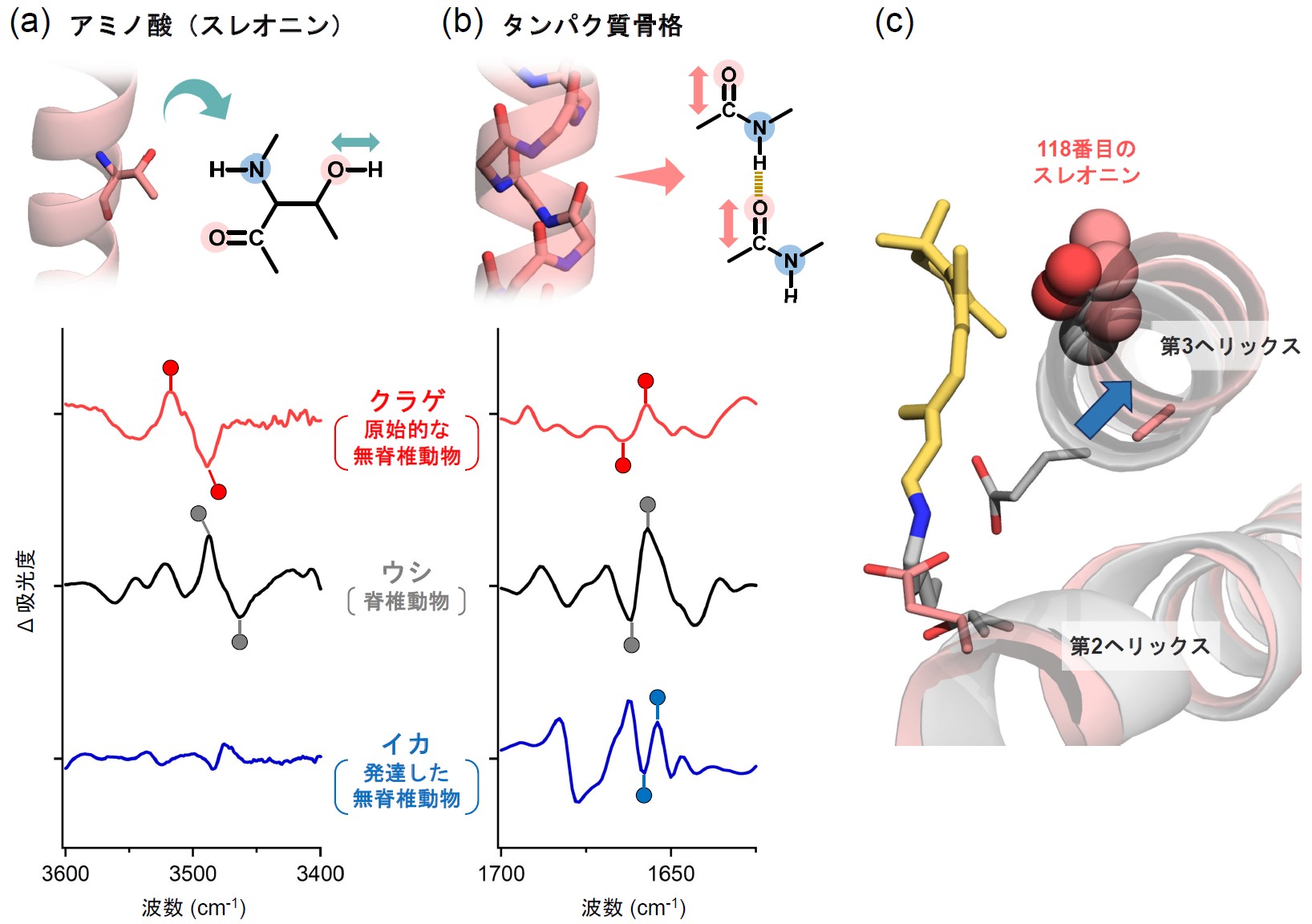
図3 (a) 赤外分光測定により得たスレオニンのO-H伸縮振動
(b) タンパク質骨格のC=O伸縮振動
(c) クラゲロドプシンのモデル構造(桃色)とウシロドプシンの立体構造(灰色)の構造比較
社会的な意義・今後の展望
クラゲロドプシンは、動物ロドプシンの中で唯一Gsタンパク質を介して、受容した光の情報を細胞内に伝えています。従って、今後、クラゲロドプシンがどのようなメカニズムで活性化し、Gsタンパク質と相互作用することで光の情報伝達を行っているのか明らかにできれば、光で細胞内のcAMP濃度を上昇させる、新たな光遺伝学ツールの開発研究の促進につながります。実際に、最近、クラゲロドプシンを遺伝子組み換え技術により導入した培養細胞や心筋細胞、さらに線虫に対し、光刺激によりcAMP濃度を上昇させることに成功した研究報告例も増えつつあります。今回の研究によりクラゲロドプシンの動作機構の一端が明らかになったことで、クラゲロドプシンを対象とした光遺伝学ツールの開発や、これを利用した、Gsタンパク質を介した情報伝達の異常によって引き起こされる疾患のメカニズム解明や疾患治療などの応用研究がますます広がりを見せることが期待されます。
本研究成果は、科学技術振興機構(JST)戦略的創造研究推進事業 さきがけ「量子技術を適用した生命科学基盤の創出」研究領域 研究課題名「構造基盤に立脚した色認識機構および色覚情報伝達機構の解明」(JPMJPR19G4)令和元年度採択(研究者:片山耕大)、CREST「光の特性を活用した生命機能の時空間制御技術の開発と応用」領域(JPMJCR1753、研究課題名:細胞内二次メッセンジャーの光操作開発と応用、研究代表者:神取秀樹)および科学研究費補助金(特別推進研究、新学術領域研究など)の支援を受けて行われました。
用語解説
(注1)クラゲロドプシン
ハコクラゲ (box jellyfish) の目の中で光受容機能を担うタンパク質 (ロドプシン) のことです。ハコクラゲは刺胞動物門箱虫綱に属する原始的な無脊椎動物ですが、我々ヒトを含む脊椎動物と似た、非常に発達したレンズ眼をもっています。
(注2)光遺伝学
光受容タンパク質を、遺伝学的手法を用いて特定の細胞や生体組織に導入し、外部から光刺激を加えることにより生命活動を操作する技術です。イオンチャネル機能をもつ微生物ロドプシンが光で神経活動を制御する光遺伝学ツールとして幅広く利用されている一方で、動物ロドプシンは、多くの生物で細胞内情報伝達に利用されているセカンドメッセンジャー(環状ヌクレオチド分子:cAMP、cGMP)の合成や、生理機能を発揮するカルシウムイオンの放出を光で制御するツールとして利用が期待されています。
(注3)カウンターイオン
レチナールとタンパク質との結合部位(シッフ塩基結合)の正電荷を安定化させるために、レチナール近傍に存在している負電荷アミノ酸(グルタミン酸もしくはアスパラギン酸)のことを指します。脊椎動物ロドプシンは第2ヘリックスにカウンターイオンを獲得したことにより、ロドプシンがGタンパク質の活性化させる効率を、無脊椎動物ロドプシンの50倍ほど増大させたことが分かっています。
(注4)レチナールのシス体からトランス体への異性化反応
視覚において最初に起こる出来事は、レチナールのシス体からトランス体への異性化反応です。一般的な動物ロドプシンでは、始状態で11シス体のレチナールと選択的に結合し、光を受容することによって全トランス体へ異性化します。
(注5)ヘリックス、ループ、膜貫通
タンパク質の一次構造であるポリペプチド鎖は、主鎖のN-H基とC=O基との間に水素結合を形成することにより、らせん状やシート状の二次構造をとります。このうち、らせん状の構造をαヘリックス構造と呼びます。また、水素結合を形成しない場合は、ひも状のループ構造をとります。
膜タンパク質の立体構造は、生体膜を貫通している部位(膜貫通部位)と、細胞内外に露出している部位に分かれています。ロドプシンを含むGタンパク質共役型受容体(注6)は、7本の膜貫通ヘリックス構造と、それらを繋ぐループ構造から構成されます。
(注6)Gタンパク質共役型受容体
7本のαヘリックス構造をもつ膜タンパク質のことであり、3つのサブユニットからなるGタンパク質を活性化させることで、外部から受け取った刺激(視覚、味覚、嗅覚など)を細胞内へと伝達しています。Gタンパク質共役型受容体の種類や、受容した刺激に応じて、細胞応答の異なる約20種類に及ぶ様々な種類のGタンパク質と共役することができます。
(注7)Gt, Gi, Go, Gq, Gs, G12/13
Gタンパク質は、情報伝達の方法やアミノ酸配列の相同性に応じて、いくつかの種類に分類されています。そのうち、Gsタンパク質は、アデニル酸シクラーゼ(AC)と呼ばれる酵素を活性化することでcAMPを産生します。また、GiおよびGoタンパク質は、ACを阻害することでcAMP産生を抑制し、視細胞中に存在するGtタンパク質は、ホスホジエステラーゼ(PDE)と呼ばれる酵素を活性化することでcGMP産生を抑制します。さらに、Gqタンパク質は、ホスホリパーゼCを活性化させることでカルシウムイオンの濃度を上昇させます。G12/13タンパク質は、Rhoグアニンヌクレオチド交換因子(Rho-GEF)を介して、細胞の形態形成を制御しています。
論文情報
論文名:Investigating the Mechanism of Photoisomerization in Jellyfish Rhodopsin with the Counterion at an Atypical Position
著者名:Shino Inukai, Kota Katayama*, Mitsumasa Koyanagi, Akihisa Terakita, Hideki Kandori*
*責任著者
掲載雑誌名:The Journal of Biological Chemistry
公表日:2023年5月24日
DOI: https://doi.org/10.1016/j.jbc.2023.104726![]()
URL: https://www.jbc.org/article/S0021-9258(23)01754-4/fulltext![]()
お問い合わせ先
研究に関すること
名古屋工業大学大学院工学研究科 工学専攻(生命・応用化学領域)
准教授 片山 耕大
名古屋工業大学大学院工学研究科 工学専攻(生命・応用化学領域)
特別教授 神取 秀樹
大阪公立大学大学院理学研究科
教授 寺北明久
大阪公立大学大学院理学研究科
教授 小柳光正
広報に関すること
名古屋工業大学 企画広報課
大阪公立大学 広報課
科学技術振興機構 広報課
JST事業に関すること
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
保田 睦子