2023-05-25 基礎生物学研究所
体節は、脊椎動物の発生過程において体幹部および尾部に一時的に形成される繰り返し構造で、その後の発生において体節の繰り返し性は、脊椎骨や骨格筋の分節性へと引き継がれます。体節の繰り返し構造は、体節の前駆細胞である未分節中胚葉において分子時計(分節時計)により作られる、周期性を持つ時間情報を基にして形成されることが知られていました。その一方で、実際に分節時計の周期性が体節の空間的な繰り返し構造に変換される仕組みについては、不明な点が多く残されていました。
今回、基礎生物学研究所/生命創成探究センターの矢部泰二郎助教、高田慎治教授、金沢大学理工研究域生命理工学系の瓜生耕一郎助教からなる研究チームは、ゼブラフィッシュを用いて、体節形成に必須な因子として知られるRipplyの機能および発現制御機構について詳細な解析を行い、Tbx6、Ripply、Her1/7およびERKシグナルの4因子から構成される遺伝子発現制御ネットワークを発見しました。この制御ネットワークに基づいて作られた数理シミュレーションにより、ゼブラフィッシュの体節形成をほぼ完全に再現することができたことから、ゼブラフィッシュの体節形成おいて、時間的な周期性というアナログ情報を、体節の繰り返し構造というデジタルな形態に変換するための分子機構の同定に成功したと考えられます。
本研究成果は、英国科学雑誌Nature Communicationsに2023年4月13日付で掲載されました。
 【研究の背景】
【研究の背景】
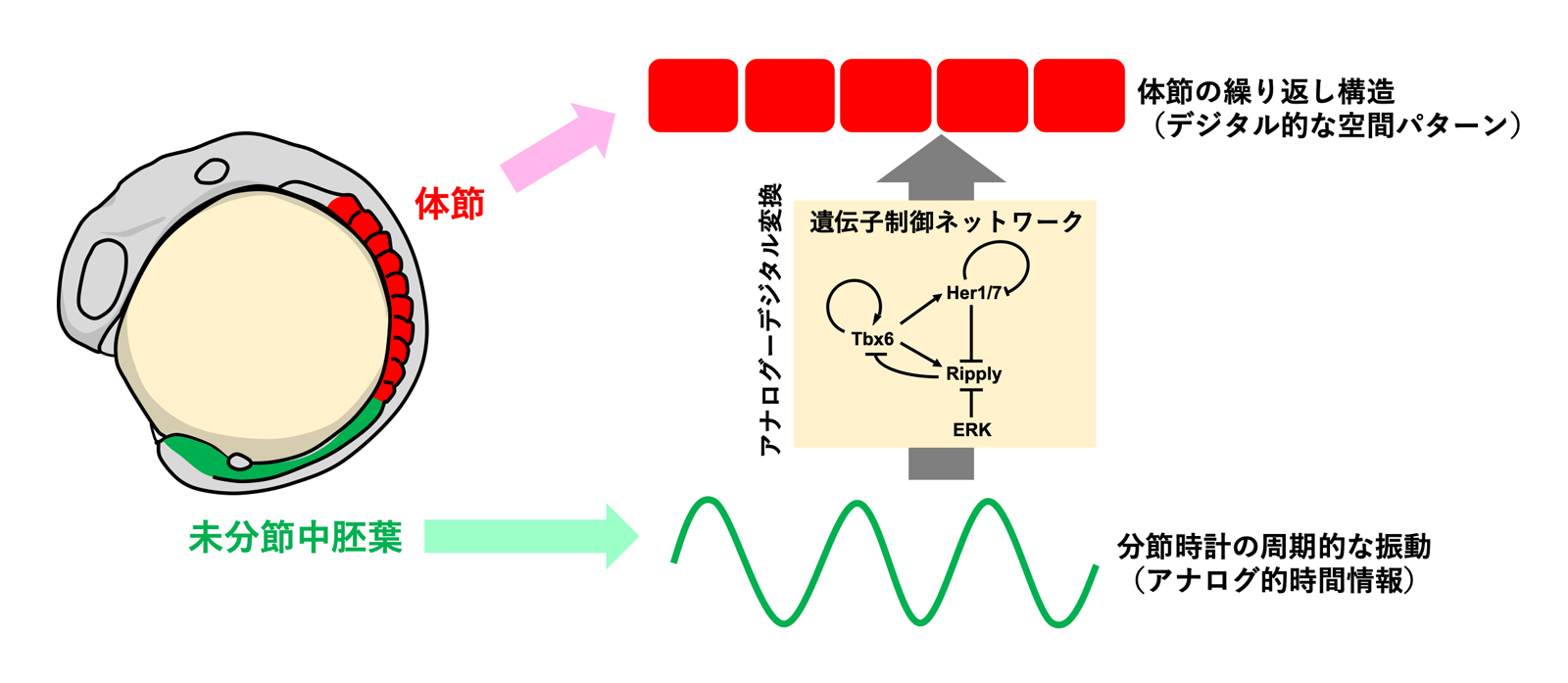
体節は、脊椎動物の発生過程において体幹部および尾部の中軸組織の両側に一時的に形成される繰り返し構造であり、体節の繰り返し性を基にして、脊椎骨や骨格筋といった分節性を持った組織が形成されます(図1参照)。体節は、その起源となる未分節中胚葉の前方部に一定周期で境界構造(分節境界)が形成されることにより、前方から一つずつ作られます。1976年に理論生物学者のCookeらは、このような体節形成の周期性を説明するために”Clock and Wavefrontモデル(クロックアンドウエーブフロントモデル)”を提唱しました。このモデルでは、未分節中胚葉のそれぞれの細胞が持つ分子時計により作られる時間的な周期性が、空間的な周期性へと変換されることにより、体節の繰り返し構造が形成されると考えられています。その後の研究により体節形成を制御する分子時計(=分節時計)の分子実体として、Notchシグナルおよびその下流因子である転写抑制因子Hairy/Hesの発現振動が同定され、分節時計により作り出される時間的周期性が体節の分節構造へと変換される分子メカニズムに関して、さまざまなモデルが提唱されていましたが、統一的な見解は得られていませんでした。
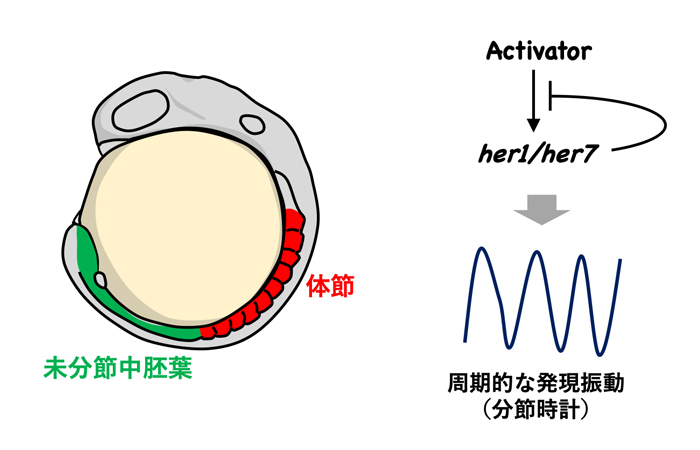
図1. 分節時計と体節形成
体節は脊椎動物の発生時に形成される繰り返し構造で、未分節中胚葉の前端に周期的に分節境界が作られることにより形成されます(左図)。未分節中胚葉では、転写抑制因子her1/her7 (ゼブラフィッシュのHairy/Hesホモログ)が自身の発現を抑制することにより周期的に発現します。ゼブラフィッシュ胚ではこのようなher1/her7の発現振動が分節時計を形成します(右図)。
動画1. ゼブラフィッシュの分節時計の振動の様子
本研究ではゲノム編集により内在性のHer7を可視化して、分節時計の可視化を行いました。未分節中胚葉では分節時計の振動が波のように後方から前方へと伝播する様子が観察されます。
【研究の成果】
脊椎動物の未分節中胚葉では、分節時計遺伝子の発現の振動は後方から前方へと伝播する進行波を形成します(動画1)。これまでに、未分節中胚葉の前方部で分節時計遺伝子の発現振動が停止することにより固定化された波形パターンを基に、体節の繰り返し構造が形成される可能性を示すモデルが提唱されていました。このように、分節時計遺伝子の発現振動により作られる動的な時間情報が空間的な波形パターンとして固定され、体節の繰り返し構造が作られるという考え方は、直感的には非常に理解しやすいのですが、実験的にはほとんど検証されていませんでした。
一方、これまでの研究により、個々の体節を区分する分節の境界は転写因子Tbx6の発現境界が規定することが知られています(図2参照)。このTbx6の発現はRipplyによって抑制されますが、RipplyはTbx6の発現境界の手前で周期的に発現することから、Ripplyが発現するたびにTbx6の発現境界が後方へとシフトして行き、その結果として体節境界が一定の時間周期の下、繰り返し作られることになります。
本研究ではゼブラフィッシュのripply1/2二重変異体を作成し、その表現型を詳細に解析しました。ripply1/2二重変異体胚(ripply1/2欠損胚)では分節境界が形成されないだけでなく、本来ならば分節時計遺伝子の発現が消失する未分化中胚葉前方部においても、分節時計遺伝子her1/her7の発現振動が持続していました(図3左図、動画2参照)。さらに、未分節中胚葉前方部における分節時計構成因子her1/her7の発現にはTbx6が必須であったことから、未分節中胚葉前方部においてRipplyがTbx6タンパクを分解することにより体節の分節境界が形成されると同時に分節時計が停止することが明らかになりました。この結果は、分節時計が振動を停止することにより波形パターンが固定され、分節時計の時間的周期性が体節の空間的な周期性へと変換されるという従来のモデルとは大きく異なるものです(図3右図参照)。
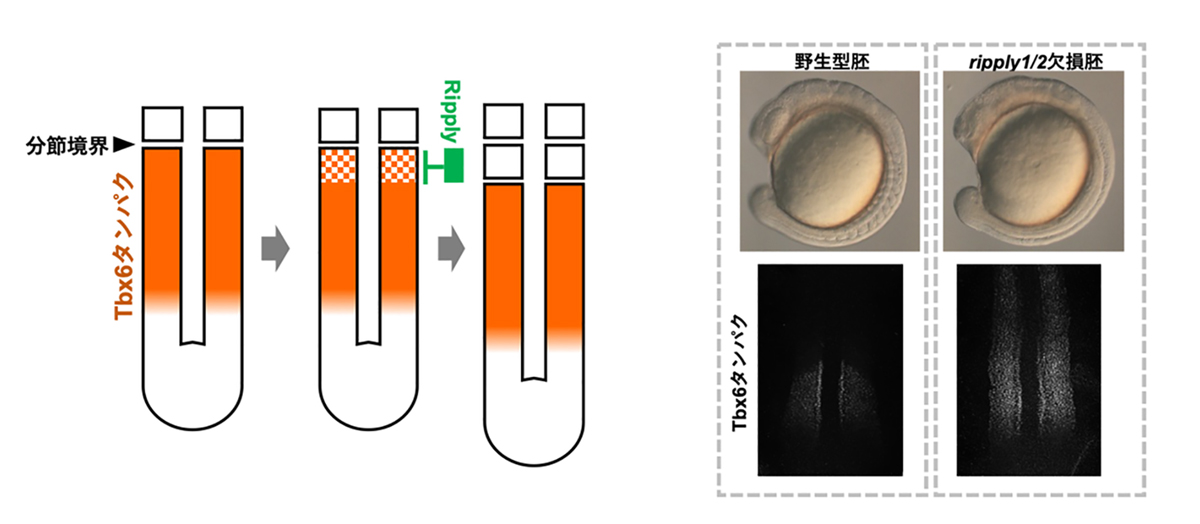 図2. 体節の分節境界形成におけるRipplyとTbx6の役割
図2. 体節の分節境界形成におけるRipplyとTbx6の役割
体節の分節境界は、Tbx6タンパクの発現の前方境界により規定され、そのTbx6タンパクの発現はRipplyによる抑制によって形成されます(左図)。ripply1/2欠損胚では本来ならば未分節中胚葉でのみ発現するTbx6タンパクが分解されず、前方部においてもその発現が持続され、結果として体節の分節構造が形成されません(右図)。
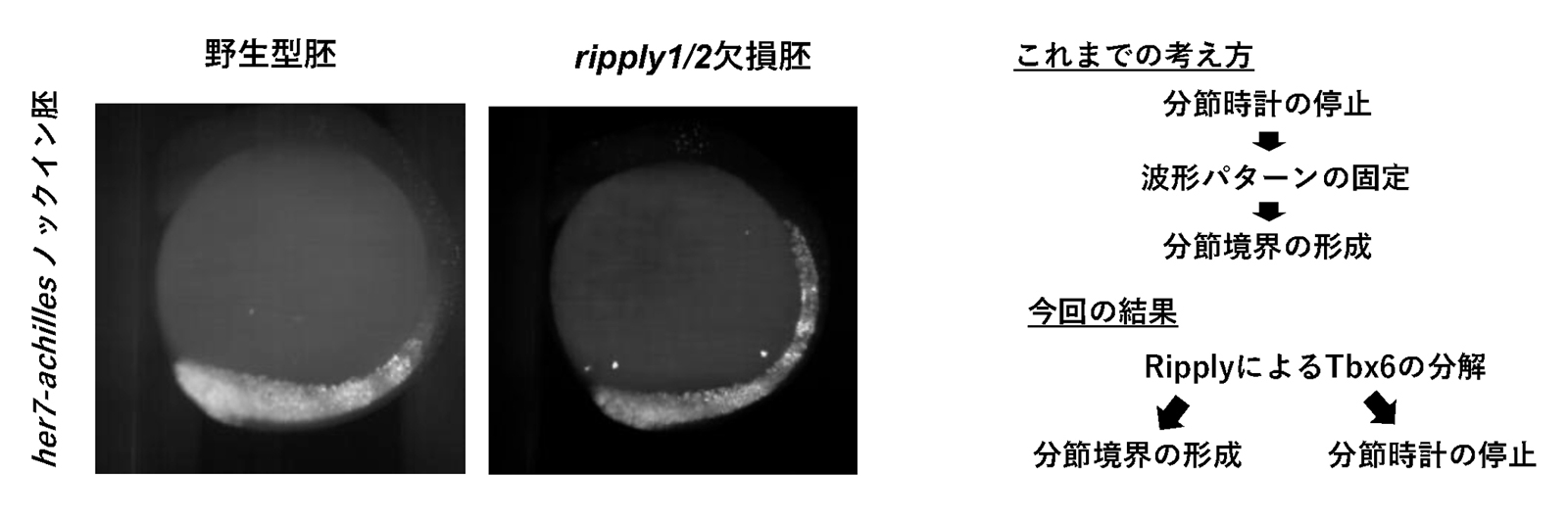 図3. Ripplyによる分節時計の停止
図3. Ripplyによる分節時計の停止
ripply1/2欠損胚では分節境界が形成されないだけでなく、分節時計が停止せずに前方部でも分節時計因子であるher7遺伝子の発現振動の波が観察されました(左図)。これらの結果より、分節時計が停止することにより分節境界が形成されるのではなく、RipplyによってTbx6タンパクが分解されることにより分節境界が形成されると同時に分節時計が停止していると考えられました(右図)。
動画2. ゼブラフィッシュ振動野生型胚とripply1/2欠損胚における分節時計の振動の比較
それでは、分節時計の時間情報はその位相を固定することなく、どのようにして安定的な空間的繰り返しパターンを形成するのでしょうか?その問題を明らかにするためにripply遺伝子の発現制御機構に注目して解析を行いました。マウス胚ではRipply遺伝子の発現は転写因子Mesp2により活性化されることが知られていましたが、研究グループは既にゼブラフィッシュのripplyの発現にはmespは必須ではないことを報告しています (参考文献)。そこで、ゼブラフィッシュを用いた発生遺伝学的な手法や培養細胞を用いたゼブラフィッシュripply遺伝子の発現調節領域の解析を行った結果、未分節中胚葉においてripply遺伝子の発現は分節時計の構成因子であるHer1/7と、未分節中胚葉後方部において活性化するERKシグナルにより抑制的に制御されていることが明らかになりました。これらの結果と既に報告されている個々の因子の相互作用を統合することにより、Tbx6、Ripply、Her1/7、ERKシグナルの4つの因子は図4で示すような遺伝子発現制御ネットワークを形成すると考えられました。このネットワークによれば、未分節中胚葉後方部においてはERKシグナルにより抑制されていたripplyの発現が、ERKシグナルが弱まる未分節中胚葉前方部では、分節時計によって周期的に活性化され、その結果Tbx6の発現境界が周期的に後方へとシフトし、体節境界が繰り返し作られることになります。このネットワークを用いて数理モデルを作成し、コンピュータシミュレーションを行ったところ、ゼブラフィッシュ体節形成時にみられる周期的なTbx6タンパクの発現前方境界の形成を完全に再現することができました(動画3参照)。未分節中胚葉におけるTbx6の発現は、ポジティブフィードバックにより制御されることから、高発現状態もしくは低発現状態のどちらかを二者択一的(デジタル的)に取るものと考えられています。実験ならびにコンピュータシミュレーションの結果から、未分節中胚葉においてもともと高発現状態で保たれているTbx6の発現は、Ripplyにより抑制されることが引き金となって低発現状態へとシフトし、恒久的に抑制されることが明らかにされました。すなわち、時間周期性というアナログ情報の媒体である分節時計によってRipplyの発現が繰り返し引き起こされるたびに、Tbx6タンパクの発現状態のデジタルな切り替えが起き、その結果として体節の繰り返し構造が次々に作り出されるものと考えられました。
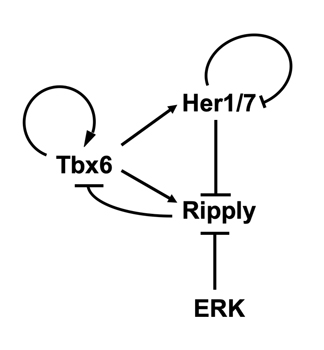
図4. ゼブラフィッシュの体節形成を制御する遺伝子転写制御ネットワーク
今回の研究により同定された、ゼブラフィッシュの体節形成を制御する遺伝子転写制御ネットワーク
動画3. 今回の研究により同定された遺伝子転写制御ネットワークを基に作られた数理モデルを用いたコンピュータシミュレーション動画
【今後の展望】
これまでに、分節時計の時間情報による体節の空間的繰り返しパターン形成機構を説明するために多くのモデルが考案されてきましたが、その多くは実験的な裏付けを欠いていました。本研究では、実験的に検証された相互作用のみで構成された転写制御ネットワークを用いたコンピュータシミュレーションで、ほぼ完全にゼブラフィッシュの体節形成を再現することに成功しました。体節形成では、発生温度などの環境的変化への対応機構や、組織サイズの変化に対するスケーリング補正機構など、さまざまな未解明な問題が残されており、今回発見した制御ネットワークだけではこれら全てを説明することはできません。本研究により同定されたネットワークは、ゼブラフィッシュの体節形成の制御機構のコア部分であると考えられ、本ネットワークを修飾するサブネットワークをさらに解析することにより、脊椎動物の体節形成の詳細を明らかにすることが可能になると期待されます。
また、体節は脊椎動物の代表的器官である脊椎骨の基となる組織であり、その形成機構は脊椎動物間で高度に保存されていると考えられてきました。しかしながら、近年の研究により、分節時計の動作機構やその下流でのRipply遺伝子の発現制御機構は、ゼブラフィッシュとマウスで非常に多様化していることが明らかになりつつあります。本研究により明らかにされたゼブラフィッシュの転写制御ネットワークを、他の動物のものと比較することにより、脊椎動物の体節形成機構の進化について新しい知見が得られることが期待されます。
本文中の参考文献
Taijiro Yabe, Kazuyuki Hoshijima, Takashi Yamamoto, Shinji Takada
“Quadruple zebrafish mutant reveals different roles of Mesp genes in somite segmentation between mouse and zebrafish” Development, 143,2842-52(2016); doi: 10.1242/dev.133173
【発表雑誌】
雑誌名: Nature Communications
掲載日: 2023年4月13日
論文タイトル: Ripply suppresses Tbx6 to induce dynamic-to-static conversion in somite segmentation
著者: Taijiro Yabe, Koichiro Uriu, Shinji Takada
DOI: https://doi.org/10.1038/s41467-023-37745-w
【研究グループ】
本研究は、基礎生物学研究所/生命創成探究センターの矢部泰二郎助教と高田慎治教授、金沢大学理工研究域生命理工学系の瓜生耕一郎助教の共同研究グループによって実施されました。
【研究サポート】
本研究は、JSPS科研費(18H02454、21H02498、17H05782、19H04797、17H05762、 19H04772、17K07423、20K06653、22H05642)およびExCELLS若手奨励研究(22-Y7)の支援を受けて実施されました。
【本研究に関するお問い合わせ先】
自然科学研究機構 基礎生物学研究所 分子発生学研究部門
自然科学研究機構 生命創成探究センター 発生シグナル創発研究グループ
助教 矢部 泰二郎
教授 高田 慎治
金沢大学 理工研究域 生命理工学系
助教 瓜生 耕一郎
【報道担当】
自然科学研究機構 基礎生物学研究所 広報室
自然科学研究機構 生命創成探究センター 研究戦略室
金沢大学 理工系事務部 総務課総務係