人工光合成触媒の合理的設計の糸口に
2019-10-18 岡山大学,理化学研究所,科学技術振興機構,日本医療研究開発機構
ポイント
- 光合成は光エネルギーを利用して、光化学系IIと呼ばれるタンパク質が水分子から酸素分子を形成する反応で始まりますが、酸素分子が形成される仕組みは分かっていませんでした。
- 量子ビームであるX線自由電子レーザーを用いて、光化学系IIの「ゆがんだイス」型の触媒が酸素分子を形成する直前の状態の立体構造を正確に決定しました。
- 本研究成果は、光合成で水分子から水素イオンや電子を取り出す仕組みの解明だけでなく、光で水を分解するための人工光合成触媒の設計にも役立つことが期待されます。
岡山大学 異分野基礎科学研究所の菅 倫寛 准教授、秋田 総理 准教授、沈 建仁 教授、理化学研究所の吾郷 日出夫 専任研究員らの共同研究グループは光化学系II注1)の「ゆがんだイス」の形をした触媒が酸素分子を形成する直前の状態の立体構造を決定しました。この結果から、光合成において酸素分子が形成される反応の仕組みが明らかになりました。本研究成果は、米国東部時間10月17日(日本時間10月18日)米国科学誌「Science」のResearch Articleとして掲載されます。
光合成は光エネルギーを利用して、光化学系IIと呼ばれるタンパク質が水分子から電子と水素イオンを取り出し、酸素分子を形成する反応によって始まります。これまでの研究で、反応が起こる触媒部分の立体構造や酸素形成の部位が明らかになっていましたが、酸素分子が形成される仕組みはよく分かっていませんでした。
研究グループは、光化学系IIの結晶にX線自由電子レーザー(XFEL)注2)施設SACLA注3)の発振する量子ビームを照射し、立体構造を高い解像度で解析しました。その結果、酸素分子の形成に必要と考えられる2つの酸素原子を触媒中に発見し、量子化学計算の結果と考え合わせることによって、これら2つの酸素原子の化学的な性質を明らかにしました。さらに反応に必要な水分子を取り込むための経路や反応で生じた水素イオンを排出するための経路を見いだしました。
本研究で明らかになった酸素分子を形成する仕組みは、光エネルギーを利用して水から電子と水素イオンを取り出して有用な化学物質を作り出す「人工光合成注4)」の技術を開発するための重要な知見を与えると期待されます。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業 個人型研究(さきがけ)(課題番号:JPMJPR18G8、JPMJPR16P1)、日本学術振興会 科学研究補助金「新学術領域研究(研究領域提案型)」(課題番号:JP17H06434、JP17H05884)、「若手研究(A)」(課題番号:JP16H06162)、「若手研究(B)」(課題番号:JP16K21181)、「特別推進研究」(課題番号:JP16H06162)、日本医療研究開発機構 創薬等先端技術支援基盤プラットフォームなどの支援を受けて実施しました。
<現状>
植物や藻類が太陽の光エネルギーを利用して水と大気中の二酸化炭素から糖を合成し、酸素分子を放出する反応は、光合成として知られています。光合成は、光化学系IIと呼ばれる、約20個のタンパク質とクロロフィル、カロテノイドなどの集光色素からなる複合体が光エネルギーを吸収して効率よく利用し、水分子から電子と水素イオンを取り出して酸素分子を形成する反応から始まります。光化学系IIが反応を触媒する詳細な仕組みを解明し、人工的に利用することができれば、光エネルギーを利用して、水から電子と水素イオンを取り出し、有用な化学物質を作り出す「人工光合成」の技術開発にもつながると期待されています。
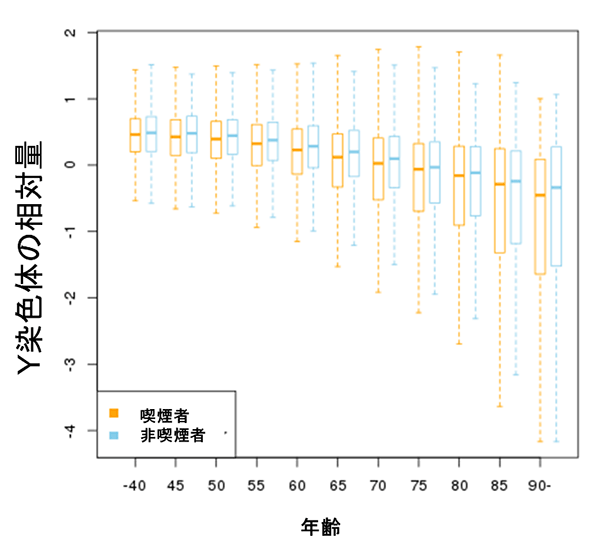
光化学系IIは、非常に安定な水分子から電子と水素イオンを取り出す反応を温和な条件下で触媒する巨大なタンパク質です。これまで沈教授らのグループは光化学系IIの結晶を高い品質で作製することに成功し、放射光施設SPring-8の強力なX線やX線自由電子レーザー施設SACLAの強力なX線パルスを用いて、その結晶構造を2011年および2015年にそれぞれ解析し、水分子を分解する触媒部分の正体はマンガン(Mn4CaO5)クラスターで「ゆがんだイス」の形をしていることを明らかにしています(図1)。触媒が「ゆがんだイス」の形をしているのはタンパク質の内部に存在しているためであり、この形が反応サイクルで少しずつ変化して酸素分子を形成すると考えられています。2017年にはS3状態と呼ばれる酸素分子を形成する反応の「途中」の状態を解析することで、酸素形成のために必要な水分子が「ゆがんだイス」型である触媒の中に取り込まれる様子を捉えることにも成功しています。
しかし、2017年の解析では触媒に取り込まれた水分子の化学的性質を明らかにできなかったため、酸素が形成される仕組みには不明な点が残されていました。また酸素形成に必要な水分子を取り込むための経路や反応で生じた水素イオンを排出するための経路についてもよく分かっていませんでした。
<研究成果の内容>
菅 倫寛 准教授、秋田 総理 准教授、沈 建仁 教授、吾郷 日出夫 専任研究員らの共同研究グループは、「固定ターゲット無損傷タンパク質結晶構造解析法注5)」を微小なサイズの光化学系IIの結晶に適用しました。光化学系IIの結晶に室温でレーザー閃光を1~2発照射すると、水を分解する反応サイクルをS2~S3状態と呼ばれる「途中」の状態に進めることができます。これら「途中」の状態を急速に凍結することで固定し、フェムト秒のX線パルスを照射してX線の損傷を受けていない状態でX線回折データを取得しました。今回の解析では2017年の解析を上回る2.15オングストロームの高い解像度で解析しただけでなく、触媒の周期的な5つの中間状態のうち3つを捉えることに成功しました(図2)。解析では、量子化学計算の結果を用いることで、従来よりも正確に触媒の立体構造を決定することができました。その結果、酸素分子の形成に必要と考えられる2つの酸素原子を触媒中に発見し、これらの化学的な性質を明らかにすることができました。これにより、反応の開始時(S1状態)には触媒部分の中間にあるO5と呼ばれる酸素原子が、次のステップ(S2状態)で少し移動してスペースをつくり、さらにその次のステップ(S3状態)でO6と呼ばれる酸素原子が取り込まれる仕組みが見いだされました。さらに触媒部分の周辺で起きたタンパク質の立体構造の変化に注目したところ、反応に必要な水分子を取り込むための経路や反応で生じた水素イオンを排出するための仕組みが明らかになりました。
<社会的な意義>
光化学系IIにある「ゆがんだイス」の形をした触媒は、周期的な5つの中間状態を経て、極めて高い効率で水分解反応を行っています。本研究は、水分解反応のサイクルにおいて、酸素を形成する直前の状態の触媒の立体構造を正確に決定して、酸素形成に必要とされる2つの酸素原子の化学的性質を明らかにしました。
本研究の成果により、これまで謎であった、酸素分子が形成されるために必要な立体構造が明らかとなりました。これは、太陽の光エネルギーを利用して水分解反応を人工的に実現する触媒について構造基盤に関する情報を提供したことになります。この反応を模倣する「人工光合成」が実現すれば、太陽の光エネルギーを利用して水から電子と水素イオンを取り出し、有用な化学物質を高効率・低コストで作り出すことが可能となります。このような夢の「人工光合成」の技術は、エネルギー問題、環境問題、食糧問題を解決し得る重要なものであると期待されています。
<参考図>
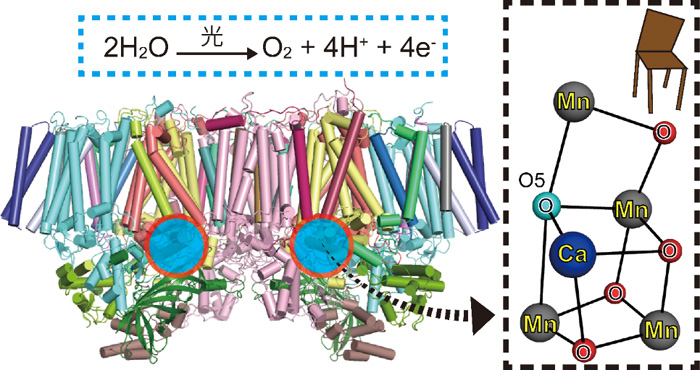
図1 光化学系IIの全体構造
全20個のタンパク質からなる複合体が2つ集合して1つの構造をとり、水分子から水素イオン(H+)と電子(e-)を取り出して酸素分子を形成する反応を触媒する。赤丸で囲んだ部分に反応を進行させる触媒部分がある。光化学系IIの触媒部分であるゆがんだイス型のマンガンクラスターを右側に拡大した。
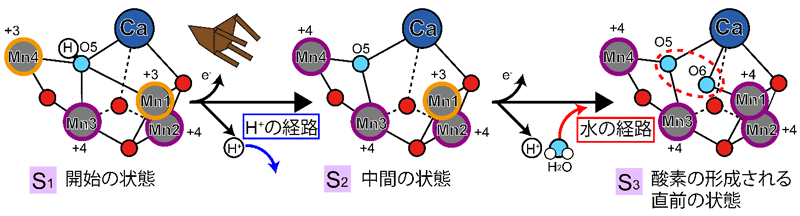
図2 酸素分子を形成する反応における触媒部分の立体構造の変化
反応サイクルは光化学系IIの特別なクロロフィルが光を受け取り励起されて進み、次の状態に進むときに触媒部分付近から電子を1つ取り出す。S1と呼ばれる反応の開始状態ではO5と呼ばれる酸素原子(水色)に水素イオン(H+)(白色)が結合しているが、次のS2と呼ばれる反応の中間状態ではO5は水素イオンを失い、Mn4の方へ引き寄せられる。するとO5の近くに少しスペースができる。次のS3と呼ばれる酸素形成の直前の状態になると水の経路から新しい水分子がO6(水色)として取り込まれる。O5とO6は酸素分子を形成するのにちょうどよい位置関係にある(赤色破線の丸囲み)。Mn原子(灰色)の近くの数字(+3、+4)はMn原子の電荷状態を表している。
<用語解説>
- 注1)光化学系II
- 光合成反応では光化学系IIと光化学系Iと呼ばれる2つのタンパク質複合体がクロロフィルで受け取った光のエネルギーを効率よく利用して、光化学系IIは水から電子と水素イオンを取り出す反応を、光化学系Iは糖を合成するのに必要な強力な還元力を供給する反応を触媒する。
- 注2)X線自由電子レーザー(XFEL)
- 従来の放射光の10億倍も明るいX線をフェムト秒の時間スケールを持つパルスとして発振させたものをX線自由電子レーザー(X-ray Free Electron Laser、XFEL)と呼ぶ。フェムト秒は1015分の1秒で、光が約3マイクロメートルしか進めない。このため強いX線のために照射位置の試料は破壊されてしまうが、照射時間が短いので試料の損傷によるタンパク質の構造変化が起こる前に回折像を撮影することができる。その結果、X線の損傷を受けていないタンパク質の立体構造を決定することができる。
- 注3)X線自由電子レーザー(XFEL)施設SACLA
- 理化学研究所と高輝度光科学研究センターが共同で建設した日本のXFEL(X-ray Free-Electron Laser)施設。2006年度から5年間の計画で建設・整備を進めた国家基幹技術の1つ。2011年3月に完成し、SPring-8 Angstrom Compact free-electron LAserの頭文字を取ってSACLAと命名された。2011年6月に最初のX線レーザーを発振、2012年3月から共用運転が開始された。SPring-8の10億倍明るいX線を、10フェムト秒未満のパルス時間内で提供する。
- 注4)人工光合成
- 光合成を人為的に行う技術のこと。ほぼ無尽蔵に供給される太陽光を利用して、地球上に豊富にある水を分解して水素ガスやその他の有用化合物を作ることができる。地球温暖化に対する環境負荷が大きい二酸化炭素の放出を伴わない、あるいは二酸化炭素を他の有用な化合物に変換することができるので、クリーンで再生可能なエネルギー源として注目されている。
- 注5)固定ターゲット無損傷タンパク質結晶構造解析法
- SACLAで開発実証されたX線結晶構造解析の方法で、X線自由電子レーザーのパルスX線と大型結晶の相乗効果で、放射線損傷の影響なく、巨大なタンパク質複合体の結晶であっても精密なX線結晶構造解析ができる(Hirata, K. et al. (2014) Nature Methods 11, 734-736)。
<論文タイトル>
- “An oxyl/oxo mechanism for oxygen-oxygen coupling in PSII revealed by an X-ray free electron laser”
(X線自由電子レーザーで明らかにしたPSIIのO-O形成におけるoxyl/oxo機構) - 著者名:Michihiro Suga, Fusamichi Akita, Keitaro Yamashita, Yoshiki Nakajima, Go Ueno, Hongjie Li, Takahiro Yamane, Kunio Hirata, Yasufumi Umena, Shinichiro Yonekura, Long-Jiang Yu, Hironori Murakami, Takashi Nomura, Tetsunari Kimura, Minoru Kubo, Seiki Baba, Takashi Kumasaka, Kensuke Tono, Makina Yabashi, Hiroshi Isobe, Kizashi Yamaguchi, Masaki Yamamoto, Hideo Ago, and Jian-Ren Shen
- DOI:10.1126/science.aax6998
<お問い合わせ先>
<研究に関すること>
菅 倫寛(スガ ミチヒロ)
岡山大学 異分野基礎科学研究所 准教授
沈 建仁(シン ケンジン)
岡山大学 異分野基礎科学研究所 教授
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部
<報道担当>
岡山大学 総務・企画部 広報課
科学技術振興機構 広報課