2018-04-23 東海大学,国立研究開発法人 日本医療研究開発機構
研究のポイント
- がんウイルスであるEpstein-Barrウイルス(EBV)(注1)は感染細胞を腫瘍化させます。EBV陽性のB細胞リンパ腫は、細胞外小胞の一種であるエクソソーム(注2)の分泌により周囲のマクロファージの活性を制御し、腫瘍細胞の増殖を促すことが明らかになりました。
- エクソソーム中に含まれるEBV由来小分子RNA(注3)により、マクロファージにおけるTNF-a、IL-10などの合成が活発になりました。これらの働きにより、マクロファージがリンパ腫の生存を促す「炎症性ニッチ」(注4)の構築に貢献します。
- 血液細胞の大部分がヒト由来の細胞に置き換えられた「造血系ヒト化マウス」(注5)を用いたEBV感染モデルにおいて、マクロファージを消失させると、同時にリンパ腫細胞も減少しました。
- EBV陽性びまん性大細胞型B細胞リンパ腫(注6)患者群において、腫瘍細胞あたりのウイルス由来小分子RNAの発現量が高いほど、予後が不良でした。この結果から、EBV由来小分子RNAの疾患診断マーカー、治療標的としての利用が期待されます。
背景
Epstein-Barrウイルス(EBV)は、世界人口の約90%以上の人々が感染していると言われていますが、健康な状態であれば私たちの身体にはほとんど無害です。しかし加齢や、臓器移植手術時の免疫抑制剤投与、エイズウイルスの感染などが原因で免疫機能が低下してしまうと、体内でEBVが増殖し、様々な疾患の原因になります。
EBV感染によって発症する病気の中でも、悪性リンパ腫はその大部分を占め、予後が不良であることが知られています。中でもB細胞性リンパ腫では、EBV陽性の場合、EBV陰性の場合に比べて既存の治療法が効きにくいことが報告されています。その原因の一つには、現在のB細胞性リンパ腫治療では、EBV感染の有無に関わらず、同じ治療法が適用されていることが考えられます。そこで、EBV関連リンパ腫の病態・発症機序の理解を深めることにより、新たな治療法の開発が期待されます。
EBV関連リンパ腫組織には多くの免疫細胞が浸潤し、炎症状態であることが知られています。これら免疫細胞は正常細胞であるにも関わらず、腫瘍の生存に必要であると考えられ、「炎症性ニッチ」と呼ばれます。リンパ腫細胞が「炎症性ニッチ」を構築する仕組みを明らかにし、その働きを抑制することができれば新しいリンパ腫治療法となると考えられますが、現在のところ、その仕組みの多くは明らかにされていません。
概要
東海大学医学部内科学系 血液腫瘍内科学の樋口 廣士特任助教、山川 奈津子研究員(現・米国Yale大学研究員)、幸谷 愛教授、国立成育医療研究センター 高度先進医療研究室の今留 謙一室長らの研究グループは、造血系ヒト化マウスを利用し、EBV陽性リンパ腫細胞が正常な免疫細胞に影響を与え、炎症性ニッチを構築する仕組みの解明を試みました。このマウスではヒト造血幹細胞を免疫不全マウスに移植することにより、血液細胞の大部分がヒト由来のものに置き換えられているため、ヒト生体内に近い環境をマウス生体内で模倣することができます。この造血系ヒト化マウスに2種類のEBV株(AkataとB95-8)を感染させると、Akata感染マウスは感染後、約12週で全個体が死亡したのに対して、B95-8感染マウスは約80%が生存していました。これらのマウスの腫瘍組織像を観察してみると、腫瘍細胞だけでなく、マクロファージの浸潤にも違いが認められました。
このリンパ腫形成能の違いについて、当研究グループでは、リンパ腫細胞から分泌される細胞外小胞の一種であるエクソソームに着目しました。近年、多くの研究グループから、腫瘍由来のエクソソームが腫瘍の悪性化や転移を促進することが報告されています。試験管内でAkata感染により腫瘍化させたB細胞の培養上清から、超遠心法によりエクソソームを分離し、ほとんどリンパ腫形成が認められなかったB95-8感染マウスへの投与を試みたところ、腫瘍細胞の浸潤が増加し、それに伴い生存率の著しい低下が認められました。この時、同様にマクロファージの浸潤も増加しており、腫瘍悪性化との関連が示唆されました。そこで、クロドロネートリポソーム処理によりマクロファージを特異的に除去すると、腫瘍の消退も認められたことから、マクロファージがリンパ腫生存に必要な炎症性ニッチとして機能することが明らかとなりました(図1)。
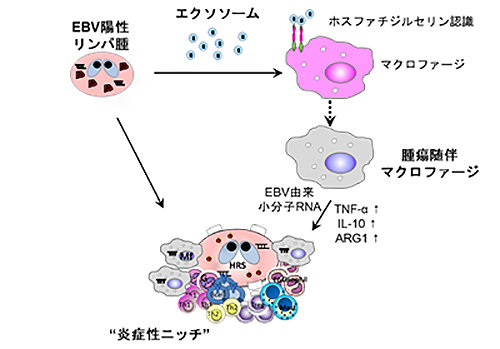
図1 EBV陽性リンパ腫が小分子RNAとエクソソームを駆使して”炎症性ニッチ”を形成する機序
エクソソームがマクロファージの機能に与える影響を解明するため、試験管内でヒト末梢血単核球(PBMC)をエクソソームで処理したところ、エクソソームの大部分は単球に取り込まれており、リンパ球にはほとんど取り込まれていませんでした(図2)。
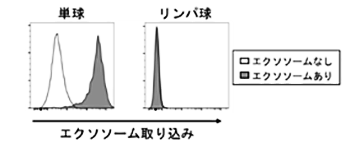
図2 リンパ腫由来エクソソームは血中の単球に選択的に取り込まれるが、リンパ球にはほとんど取り込まれなかった。
エクソソームは内部にタンパク質や核酸を豊富に内包しており、細胞から細胞への物質輸送を担うと考えられています。本研究ではリンパ腫細胞由来エクソソームに含まれる分子の中でもEBV由来小分子RNAが、単球・マクロファージにおいて活性化マーカー分子CD69および、炎症性ニッチ形成を促す因子TNF-α、IL-10の発現を促進することを明らかにしました(図3)。加えて、ヒト単球様細胞株THP-1にEBV由来小分子RNAを発現させると、腫瘍支持性マクロファージの代表的なマーカーであるARG1などの発現が増加する一方、抗原提示関連分子の発現が低下していたことから、獲得免疫機能を抑制する働きも示唆されました。EBV由来小分子RNAの標的分子の一つである転写因子MEF2C(注7)をRNA干渉により発現抑制すると、THP-1細胞におけるIL-10発現が促進されました。これらの結果から、EBV由来小分子RNAによるMEF2Cの発現抑制により、マクロファージの活性が制御され、炎症性ニッチの構築に貢献することが明らかになりました。
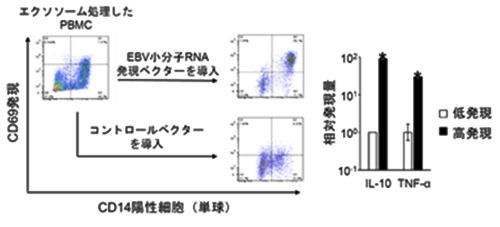
図3 小分子RNAを多く内包するエクソソームは、単球におけるCD69、IL10、TNF-αの発現を促進した。
今後の展開
本研究の成果からEBV由来小分子RNAがリンパ腫悪性化を促す一因であると考えられたため、びまん性大細胞型B細胞リンパ腫組織におけるEBV由来小分子RNAの発現を解析しました。その結果、腫瘍細胞あたりのEBV由来小分子RNAの発現量が高い患者さんほど、予後不良であることが明らかになりました(図4)。このことはEBV由来小分子RNAがリンパ腫の悪性度を診断するマーカーとなる可能性を示唆しています。同時に擬似核酸を用いて直接的にEBV由来小分子RNA機能を阻害することも今後の展開として期待されます。
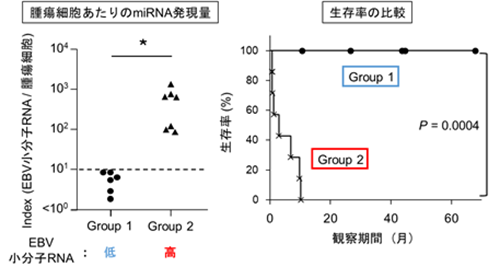
図4 びまん性大細胞型B細胞リンパ腫患者群は、腫瘍細胞あたりの小分子RNA発現量に依存して二分された。腫瘍細胞あたりに小分子RNAが高発現している患者群は著しく予後不良であった。
用語
- (注1)Epstein-Barr ウイルス
- 二本鎖DNAをゲノムとして持つヘルペスウイルスの一種。EBV関連疾患の多くは悪性リンパ腫などの血液腫瘍であるが、稀に胃がんなどの上皮細胞がんも引き起こすことが知られている。本研究課題ではAkataとB95-8の2種類のウイルス株を用いている。
- (注2)エクソソーム
- 細胞から分泌される脂質二重膜を持つ小胞の中でも、直径が50-200 nm程度の微小なものがエクソソームと呼ばれる。がん研究の分野では、エクソソームが様々なタンパク質や核酸を輸送することで、がんの生存や悪性化を促す働きが注目を集めている。
- (注3)小分子RNA
- タンパク質に翻訳されない非コードRNAの一種で、20-25塩基程度の短鎖RNA。メッセンジャーRNAがタンパク質へ翻訳される段階を抑制することで、遺伝子の発現を抑制する。
- (注4)炎症性ニッチ
- 正常な免疫細胞などから構築され、腫瘍細胞が生存するのに必要な微小環境。
- (注5)造血系ヒト化マウス
- 重症免疫不全マウス(NOD/shi-scid, IL-2RKOマウス)にヒト臍帯血由来の造血幹細胞を移植したマウス。マウス生体内に生着したヒト造血幹細胞からヒトの血液細胞が再構築されるため、ヒトの造血研究などで有用なツールとして用いられている。
- (注6)びまん性大細胞型B細胞リンパ腫
- B細胞性悪性リンパ腫の一種。日本においては悪性リンパ腫のうち、およそ30%程度を占める。その中でもEBV陽性の症例は、日本では10%程度であるのに対して、欧米諸国では5%未満である。
- (注7)MEF2C
- 様々な細胞の分化を制御する転写因子。本研究課題では、EBV由来小分子RNAにより発現が抑制される分子として同定され、マクロファージにおけるIL-10発現を制御する機能が明らかになった。
論文情報
- タイトル
- Role of exosomes as a proinflammatory mediator in the development of EBV-associated lymphoma
- 著者名
- Hiroshi Higuchi, Natsuko Yamakawa, Ken-Ichi Imadome, Takashi Yahata, Ryutaro Kotaki, Jun Ogata, Masatoshi Kakizaki, Koji Fujita, Jun Lu, Kazuaki Yokoyama, Kazuki Okuyama, Ai Sato, Masako Takamatsu, Natsumi Kurosaki, Syakira Mohamad Alba, Azran Azhim, Ryouichi Horie, Toshiki Watanabe, Toshio Kitamura, Kiyoshi Ando, Takao Kashiwagi, Toshimitsu Matsui, Akinao Okamoto, Hiroshi Handa, Masahiko Kuroda, Naoya Nakamura, and Ai Kotani
- 雑誌
- Blood
本研究は国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(PRIME)「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」研究開発領域(研究開発総括:横山 信治)における研究開発課題「炎症がん由来エクソソームにおける脂質の役割」(研究開発代表者:幸谷 愛)及び肝炎等克服実用化研究事業「B型肝炎ウイルスRNAと相互作用する宿主因子の網羅的同定とその制御による病態制御法開発(研究開発代表者:大塚 基之)」における分担研究開発課題「B型肝炎ウイルスRNAと相互作用する宿主因子の網羅的同定による肝炎・持続感染の制御法開発」(研究開発分担者:幸谷 愛、課題番号:16fk0210114h0001)の一環として行われました。
お問い合わせ先
研究に関する窓口
東海大学 医学部内科学系血液腫瘍内科学
教授 幸谷 愛
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)基盤研究事業部 研究企画課