2020-04-01 群馬大学,日本医療研究開発機構
本件のポイント
- これまで、特定の遺伝子のみのスイッチ(エピゲノム*1)をオンにした疾患モデル動物を作製することはできなかった。
- エピゲノム編集を応用し、狙った遺伝子のみのスイッチをオンにすることにより、シルバーラッセル症候群*2の疾患モデルマウスを作製した。
- 今回の技術は、遺伝子のスイッチの異常により起こる疾患の基礎研究や治療研究に利用可能と期待される。
本件の概要
DNAメチル化*3は、体の中で重要な役割をしている遺伝子の発現に関わるスイッチ(エピゲノムと定義されています)の一つです。例えば、がんの増殖を抑える遺伝子のスイッチがオフになることで正常な細胞ががん細胞に変化することなど、スイッチの異常はがんや代謝疾患、免疫疾患など人間の病気に深く関係しています。これらの疾患の基礎研究や治療研究のためには、原因となる遺伝子のスイッチのみを操作し症状を再現した疾患モデル動物*4を作製することが重要です。しかし、これまでこのような疾患モデル動物を作製することができませんでした。
そこで、群馬大学生体調節研究所ゲノム科学リソース分野の畑田出穂教授、堀居拓郎准教授、森田純代助教らのグループは、熊本大学発生医学研究所の中尾光善教授、日野信次朗准教授及び群馬大学大学院医学研究科の向後寛講師らとの共同研究で、同グループが以前に開発したエピゲノム編集法*5を応用し、特定の遺伝子のみのスイッチ(DNAメチル化)を効率的にオンにすることにより、シルバーラッセル症候群の疾患モデルマウスの作製に成功しました。この新たな技術は、シルバーラッセル症候群をはじめ遺伝子のスイッチの異常により発症するがんや代謝疾患、免疫疾患などの基礎研究や治療研究への応用に、大きく広がることが期待されます。
本成果は英国の科学雑誌『Genome Biology』(4月1日付け:日本時間4月1日)に掲載されます。
背景
双子は基本的に同じゲノム*6を持ちますが、病気のなりやすさが全く同じではありません。では、どのようにしてこのような差が生まれるのでしょうか? それは多くの遺伝子にはスイッチがあり、年齢を重ねるにつれて個々人の遺伝子のスイッチのオンとオフが異なってくるためです。つまり、遺伝子には働いている(オンの)ものと働いていない(オフの)状態のものがあり、更にどの遺伝子がオンになるかの組み合わせが個々人によって違うためです。このことは双子に限らず、我々すべての人間に当てはまります。そして遺伝子のスイッチをエピゲノムといい、いくつかの種類があります。その中でDNAメチル化はシトシン塩基*7のメチル化修飾のことであり、メチル化されている遺伝子は一般にオフになることが知られています。遺伝子のスイッチの異常は、さまざまな疾患でみられます。例えば、がんではがんを抑制する遺伝子がオフになっています。また、シルバーラッセル症候群は成長に関係した遺伝子のスイッチの異常で体の成長が遅れます。
2012年、CRISPR/Cas9*8ゲノム編集法という狙った遺伝子のみを切断する技術が開発され、注目されています。この技術により、ガイドRNAという標的となる遺伝子の一部の配列を組み込んだRNAと複合体を形成することで、Cas9タンパク質は標的となる遺伝子に結合し切断することができます。2012年、私たちはdCas9という切断ができない変異型Cas9酵素にエピゲノムを操作する酵素を結合させたものを用いると、標的となる遺伝子のスイッチを操作(エピゲノム編集)することができることを報告しました。しかしながら、細胞レベルでの操作はできるものの、体の中の遺伝子のスイッチを効率良く操作することはできていませんでした。
成果
今回はエピゲノム編集法を応用し、体の中の狙った遺伝子のスイッチを効率よくオンにすることにより、シルバーラッセル症候群の疾患モデルマウスを作製することに成功しました。そのために私たちは以下の3通りの方法(図1)を試しました。
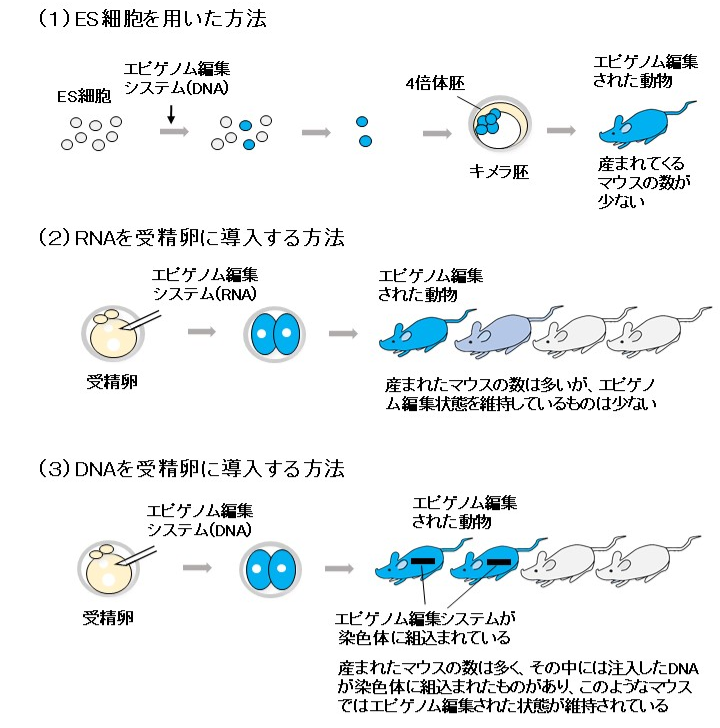
図1:エピゲノム編集によるモデル動物の作製法
- (1)ES細胞*9を用いた方法
- ES細胞は動物のすべての細胞に分化することができる細胞です。先ずES細胞でエピゲノム編集を行い、シルバーラッセル症候群の原因となる遺伝子のメチル化を操作します。そして、4倍体胚*10とキメラ*11にします。4倍体胚は胎盤になることはできても個体にはなりませんので、エピゲノム編集を行ったES細胞に100%由来するマウスが産まれてきました。ただし、この方法では産まれてくるマウスの数が非常に少なく、次に受精卵を直接操作する方法を試すことにしました。
- (2)RNAを受精卵に導入する方法
- エピゲノム編集のシステムをRNAとして受精卵に注入し、シルバーラッセル症候群の原因となる遺伝子のメチル化の操作を行いマウスを産ませました。産まれたマウスの数は多くなりましたが、エピゲノム編集された状態を維持しているものは少なく、ほとんどは元に戻ってしまっていました。このことから、この方法も効率があまり良くないことが分かりました。RNAは受精卵に注入後数日で壊れてしまうため、安定的に保持されるDNAを用いた方が良いと考えました。
- (3)DNAを受精卵に導入する方法
- エピゲノム編集のシステムをDNAとして受精卵に注入し、シルバーラッセル症候群の原因となる遺伝子のメチル化の操作を行いマウスを産ませました。産まれたマウスの数は多く、その中には注入したDNAが染色体に組込まれたものがあり、このようなマウスではエピゲノム編集された状態が維持されているため、詳細な症状の解析を行いました。その結果、エピゲノム編集されたマウス(図2)はシルバーラッセル症候群の患者でみられる症状のうち、胎児の発育遅延、出生後の成長障害、身体の左右非対称、頭が体の割に大きい、顔貌の異常、食欲不振、低血糖など多くの症状を示しました。

図2:シルバーラッセル症候群の疾患モデルマウス
社会的意義とこれからの展望
本技術により体の中の狙った遺伝子のみのスイッチを操作することができます。エピゲノムの異常で発症するがんや代謝疾患、免疫疾患など、さまざまな疾患のモデル動物を作製することにより、これらの疾患の研究に役立てることができます。
本研究は、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)「次世代型疾患モデル動物作出」(研究代表者:畑田 出穂)等の一環で行われました。
用語解説
- *1 エピゲノム
- 遺伝子のスイッチのことです。私たちの体には異なった働きをするさまざまな種類の細胞がありますが、細胞の種類が異なっても基本的に同じ遺伝子を持っています。これは細胞中にある多くの遺伝子にはスイッチがあり、細胞の種類によって各々の遺伝子のスイッチのオンとオフは異なるためです。つまり、遺伝子には働いている(オン)ものと働いていない(オフ)ものがあり、更にどの遺伝子がオンになるかの組み合わせが細胞の種類によって違うのです。エピゲノムとしてはDNAのメチル化とヒストンの修飾があります。
- *2 シルバーラッセル症候群
- 胎児の発育遅延、出生後の重度の成長障害、三角の顔や広い額などのような頭蓋および顔面の特徴、身体の非対称などに特徴づけられる疾患です。染色体11p15上のH19遺伝子のメチル化の異常が、この疾患の主要な原因と考えられています。
- *3 DNAメチル化
- DNAはアデニン、シトシン、グアニン、チミンの4つの塩基を持ち、これにより遺伝情報をコードしていますが、シトシンは修飾酵素によりメチル化された状態のものと、脱メチル化された状態のものが存在します。これによりシトシンのコードする遺伝情報が変わるわけではありませんが、遺伝子のスイッチのオン(脱メチル化)とオフ(メチル化)が変化します。このような遺伝子のスイッチをエピゲノムといいます。
- *4 疾患モデル動物
- 人間の病気に類似した疾患を呈するように人為的に操作された実験動物です。
- *5 エピゲノム編集法
- 特定の遺伝子のエピゲノムを選択的に改変する手法です。この手法によって、特定の遺伝子のエピゲノムが細胞の機能に与える影響を調べることができ、また、遺伝子治療の一形態として病気の治療へ応用することも検討されています。
- *6 ゲノム
- ゲノムとは、遺伝子(gene)と染色体(chromosome)から合成された言葉で、DNAのすべての遺伝情報のことです。
- *7 シトシン塩基
- DNAの構成成分の中の塩基の一つです。塩基は遺伝情報を担っておりアデニン、シトシン、グアニン、チミンの4種類があります。その中でもシトシンは、遺伝子のスイッチであるメチル化修飾される性質を持ちます。
- *8 CRISPR/Cas9
- ゲノム中の特定の遺伝子のみを切断する技術の一つであり、特定の遺伝子を破壊したり改変したりすることができます。Cas9タンパク質が標的となる遺伝子の一部の配列を組み込んだガイドRNAと複合体を形成することで、標的となる遺伝子と結合し切断することができます。
- *9 ES細胞
- 動物の初期胚由来の細胞から作製された、あらゆる細胞に分化できる能力をもった細胞です。
- *10 4倍体胚
- 初期胚の細胞分裂の抑制あるいは細胞融合により作製したゲノムを2倍量もつ胚です。哺乳類の場合、個体として生まれることはありません。
- *11 キメラ
- 同一の個体内に異なる遺伝情報を持つ細胞が混じっている状態や、そのような状態の個体のことです。
発表雑誌
- 雑誌名
- 「Genome Biology」(4月1日(英国時間)オンライン)
- 論文タイトル
- Successful generation of epigenetic disease model mice by targeted demethylation of the epigenome
- 著者
- Takuro Horii、 Sumiyo Morita、 Shinjiro Hino、 Mika Kimura、 Yuko Hino、 Hiroshi Kogo、 Mitsuyoshi Nakao、 Izuho Hatada*
- DOI 番号
- 10.1186/s13059-020-01991-8
お問い合わせ先
研究に関すること
群馬大学生体調節研究所
教授 畑田出穂
報道に関すること
群馬大学生体調節研究所
係長 関根浩二
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課

