2020-07-21 横浜市立大学,東京大学医科学研究所,日本医療研究開発機構
横浜市立大学大学院医学研究科臓器再生医学谷口英樹教授(東京大学医科学研究所幹細胞治療研究センター再生医学分野教授)、関根圭輔客員准教授(東京大学医科学研究所幹細胞治療研究センター再生医学分野客員研究員、国立がん研究センター独立ユニット長)らの研究グループは、東京大学医科学研究所、栄研化学株式会社などと共同で、ヒトiPS細胞から肝臓細胞などさまざまな細胞に分化誘導した際にわずかに残る可能性がある未分化なヒトiPS細胞を高感度に検出する手法を開発しました。本研究で得られた結果は、ヒトiPS細胞から肝臓細胞や血管、神経などさまざまな細胞を分化誘導し、再生医療へと応用する際に、製造工程における品質評価の手法を提供するもので、再生医療製品の安全性の向上に貢献すると期待されます。
※本研究は、『Scientific Reports』に掲載されました。(英国時間2020年6月24日10時付:日本時間2020年6月24日18時付オンライン)
※本研究は、国立研究開発法人日本医療研究開発機構(AMED)「再生医療実現拠点ネットワークプログラム」の一環として行われました。
研究成果のポイント
- iPS細胞から肝臓細胞を誘導した際にわずかに残る可能性がある未分化ヒトiPS細胞の高感度検出法を開発
- 本手法が肝臓細胞以外に、血管内皮細胞、間葉系細胞、神経細胞の品質評価においても有用であることを確認
- ヒトiPS細胞由来の再生医療用細胞の製造工程において、本手法による品質評価を実施することで再生医療製品の安全性の向上が期待される
研究の背景
再生医療に用いるヒトiPS細胞から分化誘導した機能細胞(臓器細胞)は、全ての細胞を完全に分化させることが困難であるため、未分化なiPS細胞がわずかに混入する可能性があります。未分化なiPS細胞が体内へ移植された場合、奇形腫を形成する可能性があるため、機能細胞を患者さんに移植する前に、未分化なiPS細胞の混入の可能性を評価する必要があります。現在、本研究グループは2013年に確立したミニ肝臓*1の作製技術(Nature 499(7459): 481-4, 2013)の再生医療への応用を目指していますが、肝臓の再生医療に向けては、大量の細胞を移植する必要があるため、製造工程で実施できる迅速かつ高感度な未分化iPS細胞の混入検出手法が必要となります。
これまでにいくつかの未分化iPS細胞の混入評価法が報告されているため、これらの評価法で用いられるマーカー遺伝子の使用を試みましたが、これらのマーカー遺伝子は、肝臓では正常の発生過程においても発現が見られました。したがって、ヒトiPS細胞から分化誘導した際にも、正常な肝臓細胞として発現するのか、あるいは未分化iPS細胞が混入しているのか区別が付かず、評価手法としては不適切であることが明らかとなりました。
そこで本研究では、これまでに実施したヒトiPS細胞由来ミニ肝臓を対象とした1細胞レベルの全遺伝子発現情報(Nature 546(7659):533-538, 2017)をもとに、このミニ肝臓の品質評価に適した評価手法の開発に取り組みました(図1)。
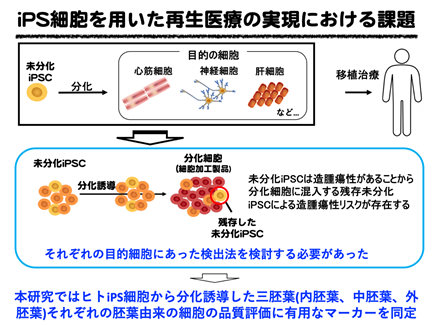
図1 iPS細胞を用いた再生医療の実現における課題と本研究の概要
研究の内容
まず、これまでに実施したヒトiPS細胞由来ミニ肝臓を対象とした1細胞レベルの全遺伝子発現情報の再解析を行い、分化細胞に混入する未分化iPS細胞を検出可能なマーカーとして、未分化iPS細胞での発現が特異的に高く、分化細胞で発現が減少する12遺伝子を抽出しました。これら12遺伝子について詳細な遺伝子発現解析や、実際に分化細胞の中に未分化iPS細胞を混入させて、混入した未分化iPS細胞を検出する試験などを実施し、特にESRG、CNMD、SFRP2の3遺伝子がヒトiPS細胞由来肝細胞に未分化iPS細胞が混入した場合にも、高感度に検出可能であり、再生医療用細胞の品質評価に有効であることが明らかとなりました(図2)。ヒトiPS細胞由来ミニ肝臓は肝細胞の他、ヒトiPS細胞由来血管内皮細胞、ヒトiPS細胞由来間葉系細胞を用いることから、これらの細胞でも、未分化iPS細胞の混入評価に有効か否か検討を行いました。その結果、ヒトiPS細胞由来血管内皮細胞、ヒトiPS細胞由来間葉系細胞においても、混入した未分化iPS細胞を高感度に検出する上で有効であることが明らかとなりました(図3)。
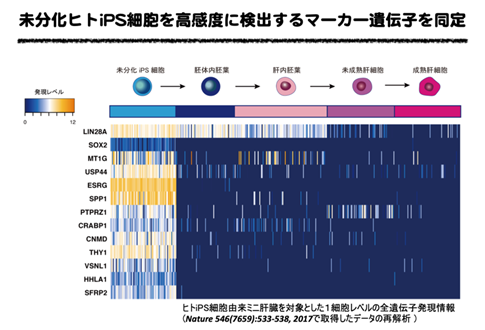
図2 未分化ヒトiPS細胞を高感度に検出するマーカー遺伝子を同定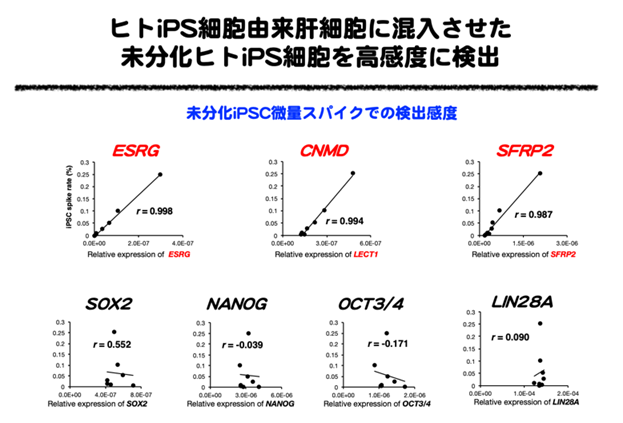
図3 ヒトiPS細胞由来肝細胞に混入させた未分化ヒトiPS細胞の検出ESRG、CNMD、SFRP2:本研究により再生医療用細胞に混入する未分化ヒトiPS細胞の検出に有用であることが明らかとなった遺伝子群。SOX2、NANOG、OCT3/4:SOX2、OCT3/4は山中伸弥教授(京都大学)らによって報告された、iPS細胞の樹立にも使われるいわゆる山中4因子に含まれる遺伝子で、NANOGはiPS細胞の樹立の際にその発現が多能性幹細胞の指標として使われた遺伝子。いずれもiPS細胞の多能性幹細胞としての指標となるが、今回の研究で肝臓細胞に混入する未分化iPS細胞の検出には検出が感度が不十分であることが明らかとなった。LIN28A:ジェームズ・トムソン教授(ウィスコンシン大学)らによって報告されたiPS細胞の樹立においてOCT3/4、SOX2、NANOGとともに使われた遺伝子。また、LIN28Aは混入する未分化iPS細胞の検出に有用であることが報告されている。今回の研究では肝臓細胞に混入する未分化iPS細胞の検出には検出感度が不十分であることが明らかとなった。
脊椎動物は発生初期に、内胚葉、中胚葉、外胚葉という3種類の胚葉(三胚葉)を形成し、これらの胚葉からそれぞれ内胚葉は肝臓や肺、腸、膵臓など、中胚葉は血管や間葉系細胞、心筋細胞など、外胚葉からは神経や皮膚などが作られます。本研究で同定したマーカー遺伝子が内胚葉由来細胞(肝臓、膵臓)、中胚葉由来細胞(血管内皮細胞、間葉系細胞)において有効であったことから、外胚葉由来細胞である神経細胞においても有効であるか検討しました。すると、ヒトiPS細胞由来神経細胞においても混入した未分化iPS細胞を高感度に検出する上で有効であることが明らかとなりました。これらの結果から、本研究で同定したマーカー遺伝子はヒトiPS細胞を用いた再生医療を実現する上で、ヒトiPS細胞由来ミニ肝臓だけでなく、さまざまな臓器の細胞の品質評価に有効であると期待されます。
今後の展開
本研究グループでは、現在AMED「再生医療実現拠点ネットワークプログラム」において、国立成育医療研究センターとともにヒトiPS細胞由来ミニ肝臓を用いた再生医療の実現へ向け、研究開発を進めています。本研究で開発した技術を再生医療用ミニ肝臓の製造工程の品質評価に用いることにより、未分化iPS細胞の混入に基づく造腫瘍性リスクを著名に低減させることができ、移植を受ける患者さんの臨床的な安全性を格段に向上させることが可能となります。また、本技術はミニ肝臓だけでなく、ヒトiPS細胞を用いた他の細胞・組織・臓器の製造工程の品質評価においても有用な評価手法になることが期待されます。現在、本技術を発展させ、更なる検出感度および検出精度の向上に向けた技術開発に産学連携で取り組んでいます。
用語説明
- *1 ミニ肝臓:
- ヒトiPS細胞から分化誘導した肝内胚葉細胞と、血管内皮細胞、間葉系細胞を最適な比率で混ぜ合わせることで、in vitro培養条件下で自律的に創出した、肝臓の基となる立体的な肝芽(ミニ肝臓)のこと(Nature 499(7459):481-4, 2013; Nature 546(7659):533-538, 2017)。さらに、この革新的な3次元培養技術(器官原基法)を他器官の作製に応用し、肝臓のみならず、膵臓、腎臓、腸、肺、心臓、脳から分離した細胞から3次元的な器官原基を創出することを報告している。創出された3次元器官原基は、移植後すみやかに血流を有する血管網を再構成し、機能的な組織を自律的に形成することができる(Cell Stem Cell. 16(5):556-65, 2015;Cell Rep. 23(6):1620-1629, 2018)。
掲載論文
- Robust detection of undifferentiated iPSC among differentiated cells
- Keisuke Sekine, Syusaku Tsuzuki, Ryota Yasui, Tatsuya Kobayashi, Kazuki Ikeda, Yuki Hamada, Eriko Kanai, J. Gray Camp, Barbara Treutlein, Yasuharu Ueno, Satoshi Okamoto, Hideki Taniguchi
Scientific Reports
URL:www.nature.com/articles/s41598-020-66845-6
※本研究は、国立研究開発法人日本医療研究開発機構(AMED)「再生医療実現拠点ネットワークプログラム」、文部科学省科学研究費補助金の一環として行われました。
お問い合わせ先
本資料の内容に関するお問い合わせ
横浜市立大学大学院医学研究科 臓器再生医学
谷口英樹
関根圭輔
取材対応窓口、詳細の資料請求など
横浜市立大学 研究・産学連携推進課長 山﨑理絵
東京大学医科学研究所 幹細胞治療研究センター 再生医学分野
谷口英樹
関根圭輔
東京大学医科学研究所 国際学術連携室(広報) 清水麻子
AMEDの事業に関すること
日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部
再生医療研究開発課