2019-91-25 国立がん研究センター,学校法人慈恵大学,日本医療研究開発機構
国立研究開発法人国立がん研究センター(理事長:中釜斉、東京都中央区)と学校法人慈恵大学(理事長: 栗原敏、東京都港区)は、卵巣明細胞がん(特に日本人に多い)や胆道がん、胃がんなどアジア人に多いがんで、高頻度にみられるARID1A遺伝子の変異した患者に対する新しい治療法を見出しました。
本研究成果は、国立がん研究センター研究所 ゲノム生物学研究分野(荻原秀明研究員、河野隆志分野長)と東京慈恵会医科大学・産婦人科学講座(高橋一彰助教、岡本愛光教授)との共同研究によるもので、米国がん専門誌「Cancer Cell」に2019年1月24日付け(日本時間1月25日)で発表されました。
ARID1A遺伝子の変異は、様々ながんで変異がみられるため、世界中で研究が進められていますが、効果的な治療法はありませんでした。研究チームは、ARID1A遺伝子変異の特徴である機能喪失性変異による代謝(メタボローム)異常と、この代謝異常を阻害することによる治療法を見つけ出すことに成功しました。機能喪失性変異を標的にすることでがんを治療する方法は、合成致死治療法と呼ばれ、新しい治療方法としてBRCA1, BRCA2遺伝子変異のある乳がんや卵巣がんの治療に用いられています。
本研究成果を応用し、今後、特異性の高い阻害薬などを開発することで、ARID1A遺伝子変異を持つ様々ながんに対して、効果の高い治療が可能になると考えます。
研究背景
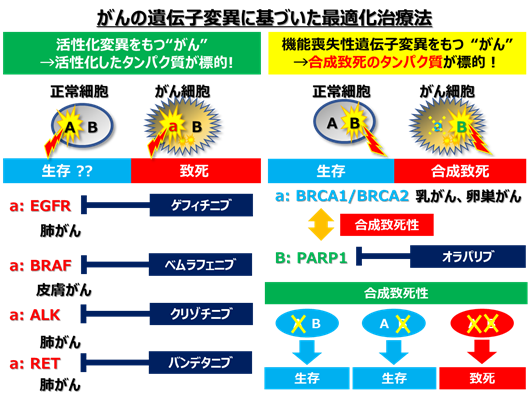
- 従来の分子標的治療法
- それぞれの患者さんのがんの遺伝子異常を調べることで、最適な治療法を選択する「がんゲノム医療」が進められています。たとえば肺がんや皮膚がんでは、EGFR、BRAF、ALK、ROS1遺伝子の活性化変異がそれぞれのキナーゼタンパク質の活性化をもたらし、がん細胞の増殖の鍵となっています。現在では、このようながんに対しては、活性化タンパク質に対する阻害薬(分子標的薬)が開発され、臨床現場で用いられています。しかしながら、多くのがんでは、このような遺伝子変異は検出されず、分子標的治療の対象となっていません。
- 「合成致死性」の理論に基づいた新たな治療法(合成致死治療法)
- 多くのがんで見つかるのはp53やARID1Aのように遺伝子の機能を失わせるような「機能喪失性変異」です。遺伝子が活性化する場合は、直接、活性化タンパク質を抑える薬を用いた治療ができますが、機能喪失性変異の場合は、このような治療はできません。そこで、別の考えに基づいた治療法が必要です。
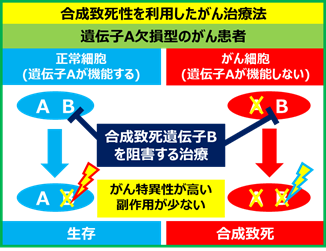
- ある遺伝子やタンパク質が欠損した場合に、それが原因で細胞に新しい弱点となる遺伝子やタンパク質が生まれることがあります。そして、この弱点となる遺伝子(タンパク質)を阻害すると細胞が死んでしまう、このような現象を「合成致死性(注1)」といいます。BRCA1, BRCA2遺伝子が欠損した乳がんでは、PARP1タンパク質が弱点であり、その阻害薬が現在治療に用いられています。このように「合成致死性」を利用したがん治療法(合成致死治療法)は新しいがん治療の概念として大きく期待されています。
- ARID1A遺伝子変異のあるがんについて
- ARID1A遺伝子は、様々な遺伝子の発現を促進するSWI/SNFクロマチンリモデリング複合体の一員として働くタンパク質を作ります。そして、ARID1Aタンパク質は、遺伝子変異によって、卵巣明細胞がん、子宮内膜がん、卵巣類内膜がんなどの女性のがんや、胃がん、胆道がんなどアジア人に多いがんで欠損しています。特に、日本人に多い卵巣明細胞がんでは、患者の二人に一人という高い割合です。そして、これらのがんは進行すると悪性であるため、有効な治療薬が求められています。
今回の研究でわかったこと
ARID1A遺伝子変異のあるがんは、抗酸化代謝物グルタチオン(注2)の量が少ないという弱点を発見し、APR-246などのグルタチオン阻害薬やグルタチオン合成酵素に対する阻害薬を使うことで、ARID1A欠損がんに対する抗腫瘍効果が示されることがわかりました。
本研究成果のポイント
- ARID1Aタンパク質は抗酸化物質グルタチオンの合成を制御するSLC7A11遺伝子の発現を促す。
- ARID1A欠損がんは、SLC7A11の発現低下により、グルタチオンの量が低いという弱点をもつ。
- 弱点であるグルタチオンやその合成を阻害することで、ARID1A欠損がんの治療が可能である。
- APR-246、BSOなどの既存抗がん剤(治験薬)が治療候補薬となる。
ARID1Aによるメタボローム制御
呼吸などにより、活性酸素種(ROS)は細胞に常に生まれますが、過剰になるとDNAが傷つき、細胞は死んでしまいます。そのため、ROSが増えすぎないように、グルタチオン(図ではGSHと表示)がROSを除去します。つまり、正常な細胞では、ROSとグルタチオンのバランスが保たれています。グルタチオンは、システイン、グルタミン酸、グリシンという3つのアミノ酸がつながってできた物質ですが、その原料となるシステインの量はSLC7A11タンパク質によって細胞の中に運び込まれます。
今回の研究では、ARID1Aタンパク質がSLC7A11遺伝子の発現を促すことを発見しました。そして、ARID1Aタンパク質を欠損したがんでは、SLC7A11タンパク質の量が少なくなるため、グルタチオンの材料であるシステインの量が減少しています。結果として、ARID1A欠損がんではROSとグルタチオンのバランスが崩れ、グルタチオンの量が少なくなっています。このグルタチオン量の低下がARID1A欠損がんの特徴であり、弱点であることを突き止めました。
メタボローム(注3)を標的とした合成致死治療法の発見
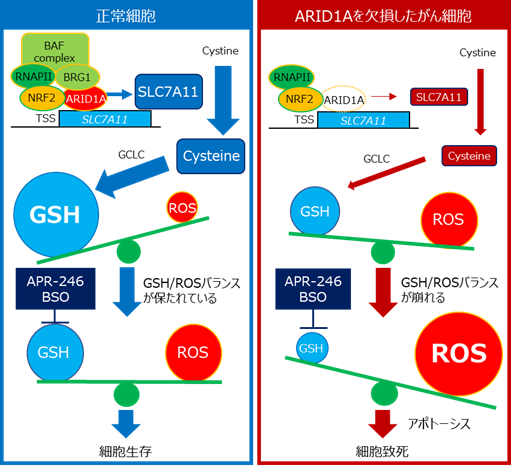
ARID1A欠損がんでは、グルタチオンそのものや、グルタチオンを作り出す酵素を阻害すると、容易にグルタチオンの量が減少してしまいます。その結果、ROSが過剰となり、がん細胞は死に至ります。つまりARID1A欠損がんでは、グルタチオンやその合成にかかわるタンパク質が弱点(合成致死標的)であり、その阻害薬を用いることで、高い治療効果が期待できます。
すでにグルタチオンやその合成酵素の阻害剤はいくつか存在しています。特に、今回の研究では、グルタチオンを阻害するAPR-246(Aprea Therapeutics社の治験薬)やグルタチオン合成酵素を阻害するbuthionine sulfoximine(BSO)が、ARID1A欠損がんの治療に有望であることを初めて示しました。
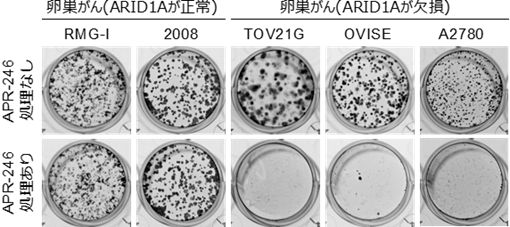
ARID1Aを欠損したがんは、特異的にAPR-246(グルタチオン阻害薬)処理により生存ができなくなる。
今後の展望
今回のがん治療法の提案は、ARID1A欠損細胞には正常細胞にはない「代謝(メタボローム)の弱点」があるという発見に基づいています。よって、正常細胞への影響が少ないため、がん細胞特異的な効果の高い治療法となる可能性があります。また、ARID1A欠損は、卵巣がんなどの婦人科がん、胆道がん、胃がんなどの消化器がんを含め、多くのがんで観察されます。また、ARID1A遺伝子変異は、遺伝子パネル検査(注4)での同定も可能です。
メタボロームを標的とした抗がん剤はまだまだ未開拓ですが、有望かつ新しい創薬領域です。APR-246を含めたグルタチオン阻害薬による治療法の確立、新しいグルタチオン合成阻害薬の開発に取り組むことで、さまざまなARID1A欠損がんの個別化治療を進め、治療成績の向上を目指してまいります。
用語解説
- (注1)合成致死性
- ひとつの遺伝子の欠損では細胞や個体に対する致死性を示さないのに、複数の遺伝子の欠損が共存すると致死性を示す現象。BRCA1, BRCA2遺伝子とPARP1遺伝子は合成致死性の関係にある。そのため、BRCA1, BRCA2を欠損した乳がん細胞は、PARP阻害剤に感受性となる。現在、BRCA1, BRCA2欠損乳がんに対してPARP阻害剤オラパリブが承認されている。
荻原研究員らは、肺小細胞がんやB細胞リンパ腫で欠損するCREBBP遺伝子、肺非小細胞がんで欠損するSMARCA4遺伝子に対する合成致死標的についても同定しており、治療法の開発に取り組んでいる。
合成致死に基づく新しいがん治療標的を発見(プレスリリース)|国立がん研究センター
-
- Ogiwara H, Sasaki M, Mitachi T, Oike T, Higuchi S, Tominaga Y, Kohno T. Targeting p300 addiction in CBP-deficient cancers causes synthetic lethality via apoptotic cell death due to abrogation of MYC expression. Cancer Discovery. 2016. 6(4):430-445. doi: 10.1158/2159-8290.CD-15-0754.
- Oike T, Ogiwara H, Tominaga Y…Kohno T. A synthetic lethality-based strategy to treat cancers harboring a genetic deficiency in the chromatin remodeling factor BRG1. Cancer Res. 2013; 73(17): 5508-5518. doi: 10.1158/0008-5472.CAN-12-4593.
- (注2)グルタチオン
- 3つのアミノ酸(グルタミン酸、システイン、グリシン)からなるトリペプチドで、抗酸化物質であり、フリーラジカルや過酸化物といった活性酸素種から細胞を保護する役割をもつ。
- (注3)メタボローム
- 低分子化学物質(代謝産物)の総体を指す呼称である。これに対し、遺伝子の総体をゲノム、タンパク質の総体をプロテオームと呼ぶ。メタボロームを標的とした創薬は、創薬の新分野として期待されている。
- (注4)遺伝子パネル検査
- 1度に多数のがんにかかわる遺伝子の変異を調べる検査。国内では、114個の遺伝子変異を調べる「NCCオンコパネル検査」があり、ARID1A遺伝子の変異を検出することができる。このNCCオンコパネル検査システムは、2018年12月25日にわが国で体外診断用医薬品・医療機器として製造販売を承認された。
国立がん研究センターが開発した日本人のための国産がんゲノムプロファイリング検査(プレスリリース)|国立がん研究センター
発表論文
- 雑誌名:Cancer Cell (Published Online on January 24, 2019)
- タイトル:Targeting the Vulnerability of Glutathione Metabolism in ARID1A-Deficient Cancers
- 著者:Hideaki Ogiwara (co-corresponding author), Kazuaki Takahashi (co-first author), Mariko Sasaki, Takafumi Kuroda, Hiroshi Yoshida, Reiko Watanabe, Ami Maruyama, Hideki Makinoshima, Fumiko Chiwaki, Hiroki Sasaki, Tomoyasu Kato, Aikou Okamoto, Takashi Kohno (corresponding author)
- DOI: https://doi.org/10.1016/j.ccell.2018.12.009
共同研究者
- 国立研究開発法人 国立がん研究センター
- 研究所
- ゲノム生物学研究分野 佐々木 麻里子、黒田 高史
- 先端医療開発センター
- バイオマーカー探索TR分野 佐々木 博己、千脇 史子
- 鶴岡連携研究拠点
- がんメタボロミクス研究室 牧野嶋 秀樹、丸山 亜美
- 中央病院
- 病理検査科 吉田 裕、渡辺 麗子
- 婦人腫瘍科 加藤 友康
本研究への支援
国立研究開発法人日本医療研究開発機構(AMED)
革新的がん医療実用化研究事業
「クロマチンリモデリング遺伝子欠損がんにおける代謝経路を標的とした合成致死治療法の開発(JP17ck0106374、JP18ck0106374)」
本件に関するお問い合わせ先
国立研究開発法人 国立がん研究センター
研究所 ゲノム生物学研究分野 分野長 河野隆志(こうの たかし)
研究所 ゲノム生物学研究分野 研究員 荻原秀明(おぎわら ひであき)
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
学校法人慈恵大学
産婦人科講座 助教 高橋一彰(たかはし かずあき)
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課