2020-09-03 東京大学,日本医療研究開発機構
発表者
清宮崇博(東京大学医学部附属病院 消化器内科/東京大学大学院医学系研究科 内科学専攻 消化器内科学 医学博士課程4年生)
大塚基之(東京大学医学部附属病院 消化器内科/東京大学大学院医学系研究科 内科学専攻 消化器内科学 講師)
小池和彦(東京大学医学部附属病院 消化器内科/東京大学大学院医学系研究科 内科学専攻 消化器内科学 教授)
発表のポイント
- 膵癌で発現する環状RNAとよばれる特殊なRNAを網羅的に探索し、これまで存在が知られていなかった新規環状RNAを同定しました。
- この新規環状RNAは膵癌組織で高発現しているだけでなく、膵癌患者の血液中にも高頻度に検出されることを見出しました。
- 早期診断が難しく予後不良な膵癌の早期発見に貢献する新しい診断マーカーとなる可能性を秘めています。
発表概要
膵癌は、かなり進行した状態で見つかることが多く、死亡者数は年々増加傾向にあり、極めて予後不良な癌とされています。このため、膵癌の早期発見を可能にする、新しいバイオマーカー(注1)の開発が強く求められています。その一環として、癌で発現するRNAを、血中で検出することでマーカーとする、いわゆるリキッドバイオプシー(注2)の試みがなされてきました。近年、環状RNA(注3)と呼ばれる特殊なRNAがさまざまな癌で異常発現することが徐々に明らかとなり、新しいバイオマーカーとして注目されてきました。
東京大学医学部附属病院消化器内科の清宮崇博大学院生、大塚基之講師、小池和彦教授らの研究グループは、環状RNAに特異的なRNAシークエンス解析(注4)を行い、膵癌において高発現する環状RNAを網羅的に探索しました。その結果、既存のデータベースにない新規環状RNAを見出し、その全長配列を同定しました。また、この新規環状RNAは膵癌の進行度に対応して高発現する傾向がみられることから、膵癌進行に関与している可能性が示唆されました。さらに、この新規環状RNAは膵癌組織で高発現するのみならず、膵癌患者およびその前癌病態にある患者の血液からも高頻度に検出されることを確認しました。この結果は、採血による膵癌の早期診断・前癌病態の囲い込み(注5)へ応用できる可能性を示唆しています。
本研究成果は、日本時間2020年9月3日に Journal of Human Genetics(オンライン版)にて発表されます。なお、本研究は日本医療研究開発機構(AMED)次世代がん医療創生研究事業、革新的医療技術創出拠点プロジェクト(橋渡し研究戦略的推進プログラム)東京大学拠点シーズA、および文部科学省科学研究費補助金などの支援により行われました。
発表内容
研究の背景
膵癌による死亡者数は年々増加傾向にあり、部位別での癌死亡数は肺癌・大腸癌・胃癌に次いで第4位となっています。膵癌は早期発見が難しく、診断時にはほとんどの患者において高度に進行した状態で発見されるため、外科的切除の適応とならず、抗癌剤治療の進歩はあるものの依然として5年生存率は8.5%と極めて予後不良であり、難治癌の代表とされています。そのため、膵癌の早期発見・早期治療を可能とする新しい膵癌の診断マーカーの開発が強く求められています。
その一環として、癌組織から血液中に遊離する核酸(DNAやRNA)を検出して癌の診断マーカーとして応用する、いわゆるリキッドバイオプシーの研究が進んでいます。膵癌においても、癌に特異的なDNA変異の検出や、これまでに報告した反復配列RNA(注6)の定量(※)など、数々の手法が開発され診断マーカーとしての応用が検討されてきました。近年、環状RNAと呼ばれる特殊な形態を持つRNAがさまざまな癌で異常発現することが明らかになりつつあります。さらに環状RNAはその構造上の特徴から、通常のRNA(環状ではなく線形)より血液中で安定して存在することが知られており、バイオマーカーとしての応用が期待されてきました。本研究では、環状RNAに特異的なRNAシークエンス解析を行い、既知の環状RNAだけでなく既存のデータベースにない新規環状RNAも網羅的に探索し、新しい膵癌のバイオマーカーとしての可能性を検討しました。
(※)【プレスリリース】膵癌の早期診断に役立つ血中の反復配列RNA の高感度測定法を開発(2016年6月3日 東京大学医学部附属病院)
研究内容
まず、正常な膵組織および膵癌組織由来のRNAをエクソヌクレアーゼ(注7)で処理したのち、RNAシークエンス解析によって環状RNAを網羅的に探索しました。その結果、膵癌由来のRNAから54,000種類、正常由来のRNAからは14,000種類の環状RNAを同定しました。これらのうち、約4万種類が既存のデータベースにない新規環状RNAであることが明らかとなりました。続いて、膵癌組織と正常膵組織における環状RNAの発現量を比較し、12番染色体から転写されている新規環状RNAが膵癌で高発現していることを見出し、さらにその全長配列を同定しました。
次に、膵癌組織43例、正常膵組織10例に対してこの新規環状RNAと特異的に結合するプローブを用いてRNA in situ ハイブリダイゼーション(注8)を行い、膵癌組織で新規環状RNAが有意に高発現していることを確認しました(図1)。さらに、癌の進行度に対応して新規環状RNAが高発現する傾向が認められました。また、本研究チームは、膵組織を採取するには侵襲の大きい処置が必要となるため、バイオマーカーとしての応用を考慮し、非侵襲的に採取可能な血液から環状RNAを検出できることが必要と考えました。そこで、前増幅とドロップレットデジタルPCR法(注9)を組み合わせたところ、わずか200マイクロリットルの血液から微量の新規環状RNAを検出できることを見出しました。次いで、この手法により、膵癌患者20人と健常者20人の血清を用いて新規環状RNAを測定したところ、健常者と比較して膵癌患者で特異的に新規環状RNAが検出されました(感度0.45、特異度0.90)。さらに興味深いことに、新規環状RNAは膵癌の前癌病態として知られる膵管内乳頭粘液性腫瘍(Intraductal Papillary Mucinous Neoplasm:IPMN、注10)を持つ患者10人中6人の血清からも検出され、膵癌の早期診断だけでなく、前癌病態の囲い込みにも有用である可能性が示唆されました(図2)。
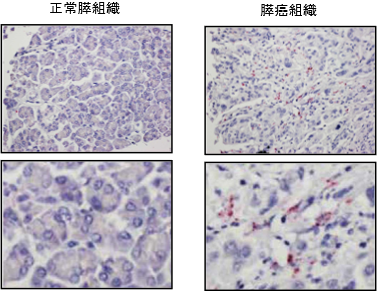
図1.正常膵組織と膵癌組織における環状RNAの発現比較RNA in situ ハイブリダイゼーションによって新規環状RNAは赤く染色されている。今回同定した新規の環状RNAは膵癌組織で有意に多く発現していた。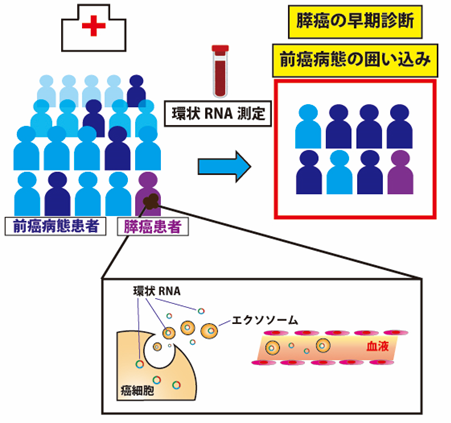
図2.癌診断マーカーとしての血中環状RNA癌細胞から遊離した環状RNAや、エクソソーム(注11)に取り込まれて癌細胞から放出された環状RNAを、血液から簡便に検出することで、膵癌の早期診断や前癌病態の囲い込みに有用なマーカーとなる可能性がある。
社会的意義・今後の予定
これらの結果は、新規環状RNAが膵癌および前癌病態の診断マーカーとして応用できる可能性があることを示しています。また、前癌病態である膵管内乳頭粘液性腫瘍患者の血清からも検出されたこと、膵癌の進行度に対応して高発現する傾向が認められたことから、膵癌の発癌・進行に関与している可能性が示唆されます。今後は、バイオマーカーとしての有効性をより多くの症例で検証し臨床応用の可能性を探りつつ、新規環状RNAの異常発現が膵癌の病態にどのように関わるかを解明し、膵癌の克服を目指していきたいと考えています。
発表雑誌
- 雑誌名
- Journal of Human Genetics
- 論文タイトル
- Aberrant expression of a novel circular RNA in pancreatic cancer
- 著者
- 清宮崇博、大塚基之*、岩田琢磨、田中恵理、關場一磨、柴田智華子、森山優、中川良、小池和彦(*責任著者)
- DOI番号
- 10.1038/s10038-020-00826-5
用語解説
- (注1)バイオマーカー
- 生体内に存在するタンパク質やDNA・RNAなどの物質で、病気の存在や進行度の指標となるもの。
- (注2)リキッドバイオプシー(liquid biopsy)
- 血液中に遊離する癌組織由来の物質を検出することで、癌の診断、治療法の選択、治療効果の予測などを行う技術。直接癌組織を採取するよりも低侵襲で繰り返し行うことができるメリットがある。
- (注3)環状RNA
- 通常のRNA分子に存在する5’末端と3’末端が結合した環状構造を有する1本鎖RNA。その構造上の特性から線形RNAとは異なる生物学的機能を有することが知られている。
- (注4)RNAシーケンス解析
- 次世代シーケンサーと呼ばれる一度に大量の塩基配列を決定できる装置を用いて、網羅的にRNAの発現量などを解析する方法。
- (注5)囲い込み
- 癌の早期発見のためには、発癌しやすい集団について集中的に経過を追う
ことが効率的である。このような発癌リスクの高い集団を何らかの形で同定する(囲い込む)
ことが臨床的に重要である。 - (注6)反復配列RNA
- ゲノムDNAの中心領域に密集して存在する、一定の塩基配列が数多く反復する領域から主に転写されて出てくるRNA。通常の状態ではほとんどRNAには転写されていないが、発生過程や癌などの異常に伴ってRNAとして発現することがある。
- (注7)エクソヌクレアーゼ
- 5’末端もしくは3’末端から核酸を分解する酵素。環状RNAは末端を持たない構造であるためエクソヌクレアーゼで分解されない。
- (注8)RNA in situ ハイブリダイゼーション(in situ hybridization:ISH)
- 組織や細胞において特定のRNAの分布や量を測定する方法。検出したいRNAと相補的な配列を持つプローブを組織上で結合させ、シグナルを増幅し視覚化する。
- (注9)前増幅とドロップレットデジタルPCR法
- ドロップレットデジタルPCR法(droplet digital PCR)とはサンプルを多数の微細なdroplet(液滴)に分け、各droplet内でPCR反応を行うことで、高感度に微量ターゲットを増幅することができるPCR法。1度droplet digital PCR法でターゲットを増幅し、もう1度droplet digital PCR法を行うことで検出感度を上げることができる。1回目のdroplet digital PCR法によるターゲットの増幅を前増幅と呼ぶ。
- (注10)膵管内乳頭粘液性腫瘍(IPMN)
- 膵管内にできた乳頭状腫瘍が多量の粘液を産生する疾患。膵癌の前癌病変として知られる。
- (注11)エクソソーム
- 細胞から分泌される直径30-150nmの小胞。エクソソームはタンパク質やDNA・RNAなどの物質を内包しており、他の細胞へ物質を運搬することで細胞間コミュニケーションを媒介する。
お問い合わせ先
研究内容に関するお問い合わせ先
東京大学医学部附属病院 消化器内科
大学院生 清宮崇博(せいみやたかひろ)
講師 大塚基之(おおつかもとゆき)
取材に関するお問い合わせ先
東京大学医学部附属病院 パブリック・リレーションセンター
担当:渡部、小岩井
AMEDの事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
次世代がん医療創生研究事業(P-CREATE)
国立研究開発法人日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 拠点研究事業課