偶発的に生じてしまうゲノム編集をコントロールする核酸分子の開発
2020-10-30 産業技術総合研究所
ポイント
- ゲノム編集酵素の活性を細胞内でコントロールする技術を開発
- これまで問題となっていた偶発的なゲノム編集を抑制できる
- ゲノム編集を利用するさまざまな分野(医療、品種改良、診断など)への貢献が期待される
概要
国立研究開発法人 産業技術総合研究所【理事長 石村 和彦】(以下「産総研」という)健康医工学研究部門【研究部門長 達 吉郎】分子複合生理研究グループ 宮岸 真 研究グループ長、バイオメディカル研究部門【研究部門長 大西 芳秋】構造創薬研究グループ 加藤 義雄 研究グループ長らの研究グループは、ゲノム編集酵素Cas9に強固に結合し、酵素活性をコントロールする核酸分子(核酸アプタマー)を開発した。また、この核酸アプタマーを細胞内に導入することにより、ゲノム編集酵素の活性をコントロールして、これまで問題となっていた偶発的なゲノム編集(オフターゲット)を抑制し、より正確にゲノム編集ができることを実証した。この技術は、分子生物学研究、遺伝子治療、品種改良など、ゲノム編集技術が利用されるさまざまな分野への貢献が期待される。なお、2020年10月30日にNucleic Acids Research誌(電子版、オープンアクセス)に掲載される。
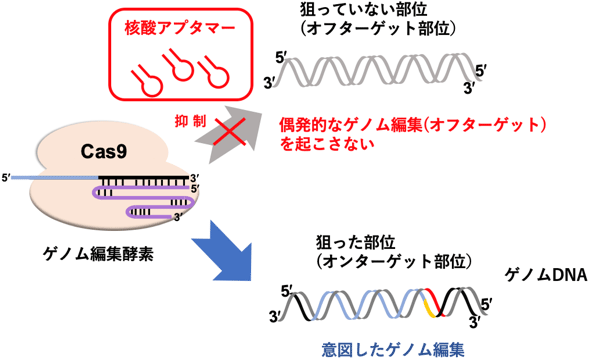
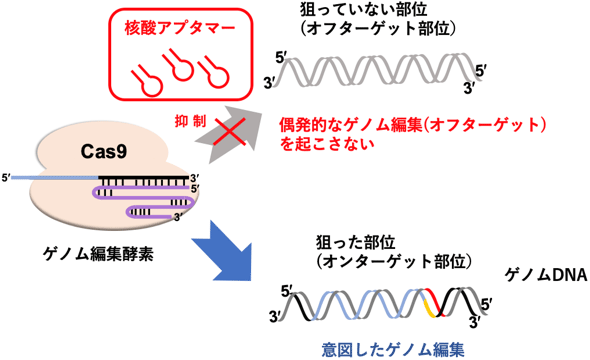
今回開発した核酸アプタマーにより、偶発的に生じてしまうゲノム編集を抑制できる
開発の社会的背景
最近、遺伝子配列を書き換えるゲノム編集技術が生物学、医薬分野で大きく注目され、2020年のノーベル化学賞に輝いた。この技術は、ゲノム編集酵素によって、細胞のゲノム配列を書き換える(編集する)技術であり、遺伝子治療、品種改良、医療技術など、さまざまな応用研究が進められている。しかし、ゲノム編集によって引き起こされる偶発的なゲノム配列の変異・欠失など(オフターゲット)の発生は、安全性を担保する上で大きな課題となっている。
研究の経緯
産総研では、これまで独自の核酸アプタマー取得技術(インビトロセレクション法)の開発を行っており、エクソソーム(細胞外小胞)を認識する核酸アプタマーなど、さまざまなターゲット分子に結合する核酸アプタマーを取得してきた。今回、ゲノム編集酵素Cas9をターゲットとし、インビトロセレクション法によりスクリーニングを行い、高い結合能と阻害活性を併せ持つ核酸アプタマーの取得を目指した。
なお、今回の研究開発は、国立研究開発法人新エネルギー・産業技術総合開発機構の委託事業「植物等の生物を用いた高機能品生産技術の開発プロジェクト(2016~2019年度)」による支援を受けて行った。
研究の内容
ゲノム編集酵素Cas9タンパク質をターゲットとして、インビトロセレクション法により、核酸ライブラリーからCas9タンパク質に結合する核酸配列を選びだした。Cas9タンパク質に結合した核酸配列に対して次世代シークエンサーによる大規模配列解析と情報解析を行い、複数の候補核酸配列を見出した。これらの候補核酸配列の中から、Cas9の酵素活性を指標として二次スクリーニングを行い、酵素活性を抑制する核酸配列(核酸アプタマー)を見出した。詳細な解析から、この核酸アプタマーはCas9のゲノムDNA結合領域と、ガイドRNAであるcrRNAの両方に結合しており、これらの結合が阻害活性に寄与していると推定された。また、この核酸アプタマーを細胞内に導入すると、細胞内のゲノム編集をコントロールできることも確認できた。さらに、この核酸アプタマーのcrRNA認識配列に修飾核酸(LNA)を用いたところ、細胞内での核酸アプタマー活性が大幅に改善した(図1)。
今回開発した核酸アプタマーによる偶発的な核酸配列の変異や欠損を抑制する効果を評価するため、HEK293細胞にEMX1遺伝子座を狙ったCas9/sgRNAプラスミドを導入し、10時間後と2日後にLNAを用いた核酸アプタマーを導入した。5日後に細胞を回収、抽出したDNAの次世代シークエンサーによる配列解析により、EMX1のターゲット部位と、報告されているオフターゲット部位での配列変異(インデル)を調べて、抑制効果(抑制率)を算出した。核酸アプタマーを適切なタイミングで細胞に導入すれば、ゲノム編集酵素Cas9によってオフターゲット部位に生じる非特異的なゲノム編集を、ターゲット部位での特異的なゲノム編集に比べて約2.5倍抑制できることが判明した(図2)。今回開発した核酸アプタマーで、ゲノム編集酵素をコントロールすることにより、オフターゲット部位でのゲノム編集の発生を抑制し、より正確で安全なゲノム編集が可能となった。
今回開発した核酸アプタマーの設計コンセプトは、Cas9以外のさまざまなCRISPRファミリー(Cas3、Cpf1など)に対しても適用できるため、これまで阻害剤が全く見つかっていなかったゲノム編集酵素に関連したさまざまな応用も期待される。
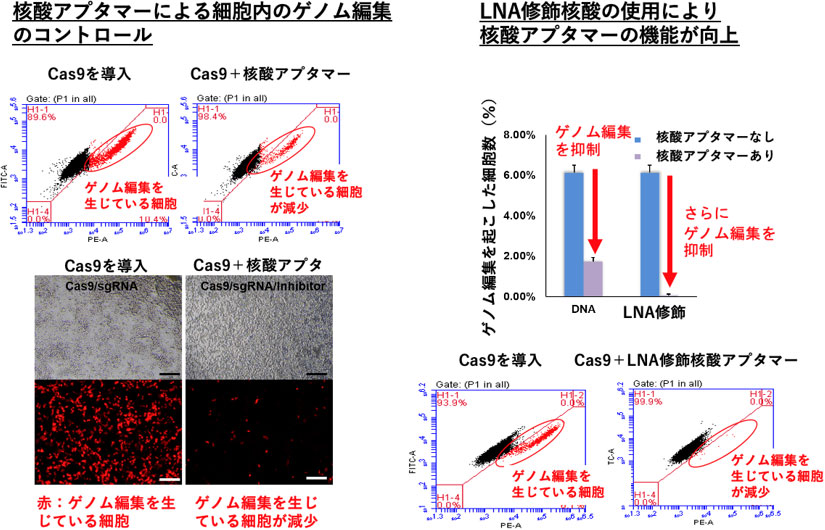
図1 核酸アプタマーによる細胞内でのゲノム編集のコントロール
核酸アプタマーの細胞への導入により、ゲノム編集が生じた細胞(赤)が減少している(左)。修飾核酸LNAを用いた核酸アプタマーを使用した場合には、ほぼゲノム編集細胞が消失している(右)。左図はHEK293細胞にCas9/crRNA複合体を導入することにより、ゲノム内に挿入した発現調節DNA領域上でゲノム編集が生じ、下流の蛍光タンパク質が発現することにより、細胞が赤く見える。左上と右下の図は、セルソーターという機器で個々の細胞の特性を計測したもの。横軸は蛍光色素の量、縦軸は細胞の自家蛍光量を示している。
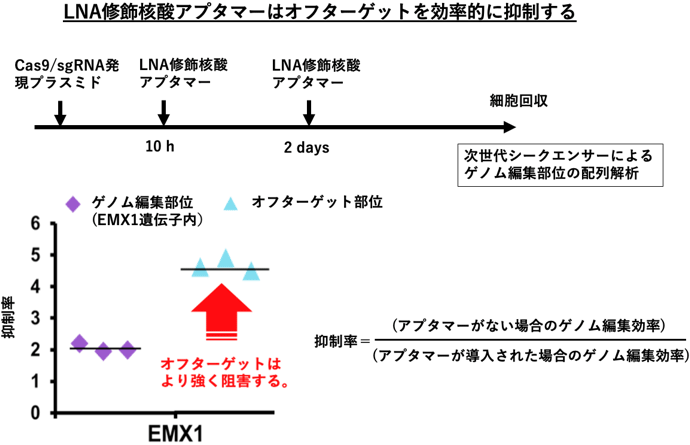
図2 非特異的なゲノム編集(オフターゲット)の抑制効果
今後の予定
Cas9の他の部位に結合する別の核酸アプタマーについて、結合部位の解析を行っている。ゲノム編集酵素の異なる部位に結合する複数の核酸アプタマーを開発して、ゲノム編集のさまざまな機能をコントロールする技術を構築していきたい。
用語の説明
- ◆ゲノム編集
- ゲノム配列を編集する技術。ゲノム内のターゲットとする配列を特異的に切断する酵素の発見により、ここ数年、急速に進展した。2020年のノーベル化学賞。Cas9とガイド鎖crRNA複合体を用いたCRISPR Casシステムが主流となっている。
- ◆Cas9
- ゲノム編集酵素。crRNA(sgRNA)をガイド鎖として、ゲノム配列中のcrRNAの配列に対応するターゲット配列を切断する。この酵素の発見により、ゲノム配列の改変が可能となった。ゲノム編集酵素にはCas9以外にもさまざまな種類がある。
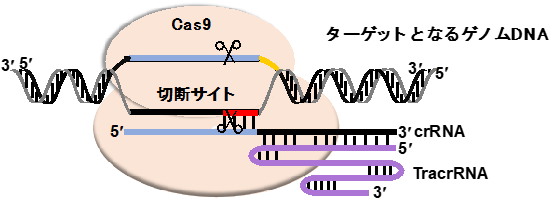
Cas9/crRNA/TracrRNA複合体はcrRNAをガイド鎖として、特定のゲノム配列を認識し、切断する。
- ◆核酸アプタマー
- 抗体のようにターゲット分子に対して、結合能をもつ核酸分子。一般的にインビトロセレクション法(分子進化法)により取得される。
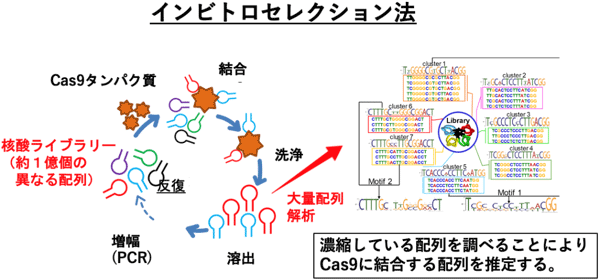
- ◆インビトロセレクション法
- さまざまな配列からなる核酸ライブラリーからターゲット分子に結合する核酸を取得する方法。分子進化法、SELEX法とも言う。図に示すようにターゲット分子への結合、洗浄、溶出、増幅のサイクルを繰り返し、核酸ライブラリーからターゲット分子に強固に結合する配列を取得する。今回は、結合配列を次世代シークエンサーにより大量に取得し解析して、セレクションで濃縮している配列を推定した。
- ◆LNA(Locked Nucleic Acid)
- 大阪大学、今西 武 教授が開発した修飾核酸。核酸(DNA,RNA)はグアニンとシトシン(G:C)、アデニンとチミジンまたはアデニンとウラシル(A:T or A:U)が塩基対を形成するが、LNAは核酸の構造を固定することで塩基対形成能を大幅に向上させたものであり (G:C[LNA], A:T[LNA])、核酸を用いたさまざまな検出系で利用されている。今回は核酸アプタマーとcrRNAの塩基対形成部位にこの修飾核酸を挿入することにより、大幅に細胞内阻害活性を増強することができた。