脳内タウ病変の可視化による病態解明、早期診断、新規治療薬の開発促進に役立つ
2020-10-30 量子科学技術研究開発機構,日本医療研究開発機構
発表のポイント
- アルツハイマー病や前頭側頭葉変性症1)など多様な認知症で、タウ2)病変を高いコントラストで捉え、これらの疾患の検出・鑑別を早期から可能にする世界で唯一のタウPET3)薬剤である18F-PM-PBB3の開発に成功しました。
- 18F-PM-PBB3を用いたPETにより、各種認知症の重症度の客観的な評価が可能になることから、新規治療薬の効果判定にも有用性が見込まれます。
- 18F-PM-PBB3はヒトのみならず疾患モデルマウスのタウ蓄積も高精度で検出する唯一の薬剤であり、タウを標的とする認知症の治療薬開発や疾患メカニズム解明に、非臨床から臨床まで一気通貫での活用が可能になります。
概要
国立研究開発法人量子科学技術研究開発機構(理事長平野俊夫、以下「量研」)量子医療・医学部門放射線医学総合研究所(以下「放医研」)脳機能イメージング研究部(樋口真人部長)の互健二技術員、高堂裕平主幹研究員、島田斉主幹研究員らは、アルツハイマー病や前頭側頭葉変性症など、多様な認知症の脳内でのタウの蓄積を画像化し、これらの疾患の検出・鑑別を可能にする次世代タウPET薬剤18F-PM-PBB3の開発に成功しました。
認知症には4大原因疾患(4大認知症4)と呼ばれる)があり、そのうちアルツハイマー病、前頭側頭型認知症、レビー小体型認知症5)には異常タンパク質の蓄積が関連しています。前二者には、アミロイドβ(Aβ)6)やタウを主とする異常タンパク質が脳内に蓄積し、これらの異常タンパク質の蓄積にともない神経細胞が死ぬことで、物忘れや運動障害、精神症状などの多彩な症状が出現します。認知症でみられる症状は原因疾患ごとに多様である一方、異なる原因疾患でも同じ症状が出現しうるため、症状のみでどの疾患かを早期に診断することができません。
そこで、Aβやタウといった異常タンパク質を生体脳で画像化し、これらの蓄積の有無や蓄積場所の検討を行うことで認知症を鑑別する研究開発が世界各地で行われてきました。量研(当時の放医研)では、2013年に世界に先駆けてタウを生体脳で画像化するPET薬剤11C-PBB37)を開発し、種々の疾患におけるタウを画像化してきました。しかし、前頭側頭葉変性症を含む個々の症例ごとに、どの疾患かを鑑別できるほど高精度にタウを画像化することはできなかったため、11C-PBB3の改良を重ねてきました。
その結果、11Cよりも利便性の高い18Fを結合した次世代型18F-PM-PBB3の開発に成功し、前頭側頭葉変性症を含む様々な認知症におけるタウ病変の検出・鑑別を可能にしました。さらに、18F-PM-PBB3により検出されるタウ病変の量がアルツハイマー病や前頭側頭葉変性症の重症度との関連性を示すことも明らかにしました。そしてアルツハイマー病や前頭側頭葉変性症の一種である進行性核上性麻痺8)を高い感度・特異度9)(90%以上)で健常者と区別ができることも示しました。
18F-PM-PBB3は疾患モデルマウスのタウ病変も生体脳で可視化できるため、マウスからヒトまで共通して利用可能な技術として認知症の病態研究および治療薬開発を促進することが期待されます。また、現在、量研の支援のもとAPRINOIA社主導で米国、台湾、日本において18F-PM-PBB3の診断薬としての承認を得るための第1相および第2相臨床試験が、中国では第3相臨床試験が進められています。タウ病変に対する治療薬候補が世界で開発されており、今後、ますます18F-PM-PBB3の需要は高まるものと考えられます。
本研究は、日本医療研究開発機構(AMED)革新的技術による脳機能ネットワークの全容解明プロジェクト「神経変性疾患のタンパク凝集・伝播病態と回路障害の分子イメージング研究」、MEXT/JSPS科研費JP16H05324、JP18K07543、JP26117011、CREST「記憶構造を解明する新しい光操作・画像法の開発」などの支援を受けて実施されたもので、当該分野においてインパクトの大きい論文が数多く発表されている米国の科学誌「Neuron」のオンライン版に2020年10月30日(金)午前1時(日本時間)に掲載されます。
研究開発の背景と目的
近年、認知症患者の増加が社会問題となっています。その要因として、①高齢化社会により高齢者人口が増加していること、②年齢が増すほどに認知症が増加すること、③根本的な治療法が開発されていないために発症・進行をくい止められないこと、が考えられます。認知症の問題により国内では年間5兆円を超える経済損失が生じ、家族負担を合わせると10兆円以上の損失といわれています。認知症では年齢が増すほどに脳に蓄積する異常タンパク質の量が増え、この異常タンパク質の蓄積を抑えることが根本的な治療に不可欠と考えられます。
認知症には4大原因疾患(4大認知症と呼ばれる)があり、そのうちアルツハイマー病、前頭側頭型認知症、レビー小体型認知症は、タウ、アミロイドβ(Aβ)、シヌクレイン10)等、種々の異常タンパク質が脳で蓄積する病気です。これらの異常タンパク質の蓄積にともない、神経細胞が死ぬことで、物忘れや運動障害、精神症状などの多彩な症状が出現します。これらの症状は症例ごとに多様である一方、異なる疾患でも同様の症状を呈することがあるため、症状のみで早期診断を実現することはできません。そこで、異常タンパク質の蓄積を可視化するイメージング技術を用いた早期診断が必要となります。Aβやタウといった異常タンパク質蓄積を生体脳で可視化し、その有無や蓄積場所の検討を行うことで、認知症を疾患ごとに鑑別できるようにする研究開発が世界各地で行われてきました。
タウのイメージングは世界に先駆けて2013年に当時の放医研において開発したPET薬剤11C-PBB3によって実現され、研究グループはこれまでにアルツハイマー病(2018年6月6日プレスリリース)、特定地域で多発する認知症(2018年12月8日プレスリリース)、家族性の前頭側頭葉変性症(2019年2月15日プレスリリース)などを対象に成果をあげてきました。一方で、11C-PBB3を含むこれまでの認知症PET薬剤には解決すべき課題がありました。
①アミロイドPETはアルツハイマー病以外に有用でなく、かつ、アルツハイマー病の重症度評価に利用できない。
②これまでのタウPET薬剤は前頭側頭葉変性症におけるタウ病変検出の精度が低い。
③これまでのタウPET薬剤は認知症モデル動物のタウ病変の画像化に有用でなく、治療薬開発等において基礎と臨床をつなぐイメージングの利用が困難。
これらの課題を解決すべく、様々な認知症におけるタウ病変を可視化して認知症を鑑別し、マウスから臨床まで一気通貫に活用できるタウPET薬剤の開発を目指しました。
研究の手法と成果
本研究では、より実用的なタウPET薬剤を目指すため、11C-PBB3の課題を解消し、かつ、より臨床現場に普及しやすい18Fを結合した化合物18F-PM-PBB3を作成しました。そして、死後脳や認知症モデルマウスを用い18F-PM-PBB3の有効性を検証しました。その結果18F-PM-PBB3は死後脳に蓄積するタウに対して良好な親和性を認め、さらに認知症モデルマウスにおいても生体内のタウを高感度に可視化できることを確認しました。
そこで健常高齢者23名、アルツハイマー型認知症(軽度認知障害を含む)患者17名、前頭側頭葉変性症(進行性核上性麻痺、大脳基底核変性症候群11)、進行性非流暢性失語12)、行動障害型前頭側頭型認知症(ピック病を含む)13))患者21名を対象に、18F-PM-PBB3 PET検査を行い、タウ蓄積が認められる脳部位とその量を調べました。その結果、健常者と比較してアルツハイマー病患者では側頭葉から頭頂葉を中心とした大脳皮質全般に、前頭側頭葉変性症患者では疾患に応じて様々な部位に18F-PM-PBB3の高集積を認めました(図1)。
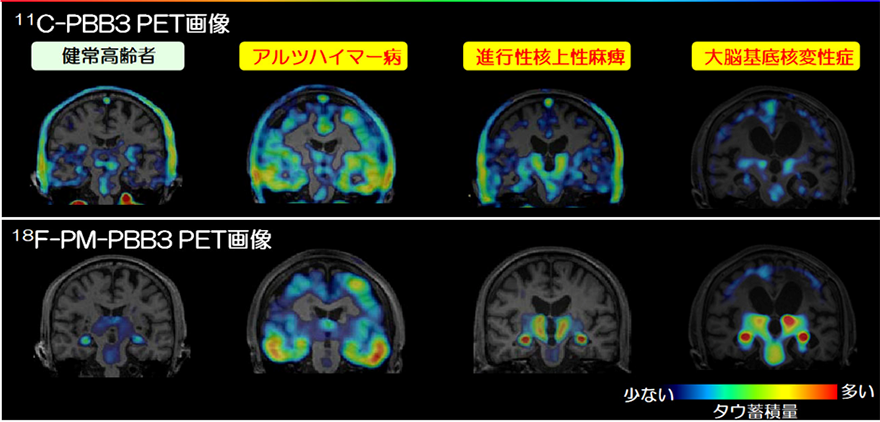 図1 11C-PBB3から18F-PM-PBB3への進化
図1 11C-PBB3から18F-PM-PBB3への進化
健常高齢者、アルツハイマー病患者、前頭側頭葉変性症患者におけるタウ蓄積画像の比較アルツハイマー病および前頭側頭葉変性症における集積が、18F-PM-PBB3では11C-PBB3よりもさらに明確に描出が可能となった。健常高齢者を含むすべての対象で非特異的な集積が18F-PM-PBB3では減少した。
さらに前頭側頭葉変性症患者のうち、病状の進行によりなくなられた方の剖検で得られた脳標本を用い、生前に実施していたPET検査を参照し、脳標本のタウ病変と脳内の18F-PM-PBB3結合との関連を検討しました(図2)。これにより、生前の検査で認められた18F-PM-PBB3高集積部位において、死後脳から様々なタイプのタウが確認され、18F-PM-PBB3が多様なタウを検出可能であることを実証しました。
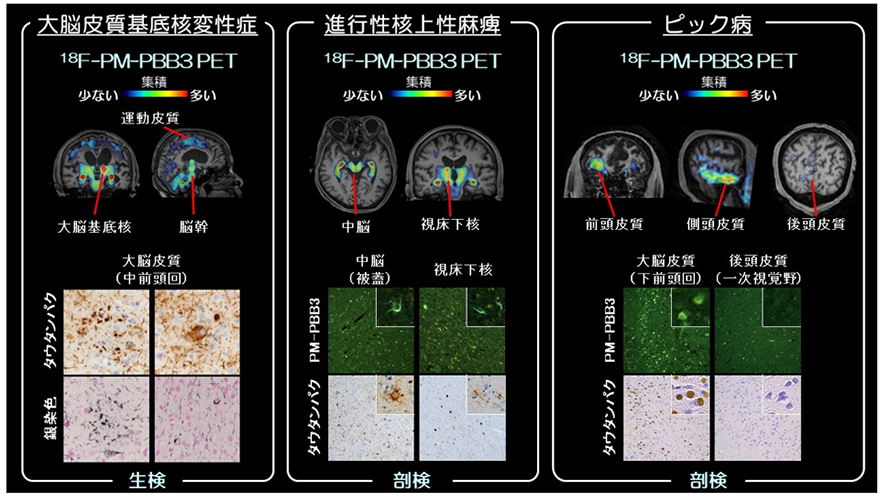 図2 前頭側頭葉変性症患者におけるPET画像、病理所見との関連大脳皮質基底核変性症、進行性核上性麻痺患者、ピック病患者ともに、18F-PM-PBB3 PETで高集積を認めた部位に各疾患に特徴的なタウ病変の蓄積が確認された。
図2 前頭側頭葉変性症患者におけるPET画像、病理所見との関連大脳皮質基底核変性症、進行性核上性麻痺患者、ピック病患者ともに、18F-PM-PBB3 PETで高集積を認めた部位に各疾患に特徴的なタウ病変の蓄積が確認された。
また健常高齢者、早期および進行期のアルツハイマー病患者における脳のタウ蓄積を18F-PM-PBB3を用いて評価したところ、早期アルツハイマー病においてタウの蓄積を検出し、進行に伴い病変が広がりをみせていることを確認しました(図3上段)。さらに前頭側頭葉変性症のうち、進行性核上性麻痺患者における脳のタウ蓄積、脳萎縮、および重症度との関連を検討したところ、タウ蓄積と脳萎縮がほぼ一致した部位で認められ、その一部の領域におけるタウ蓄積量は重症度と相関していました(図3下段)。これらの結果は18F-PM-PBB3が診断のみならず、病勢の把握にも有用、すなわち創薬における治療効果判定にも有用であることを示唆しています。
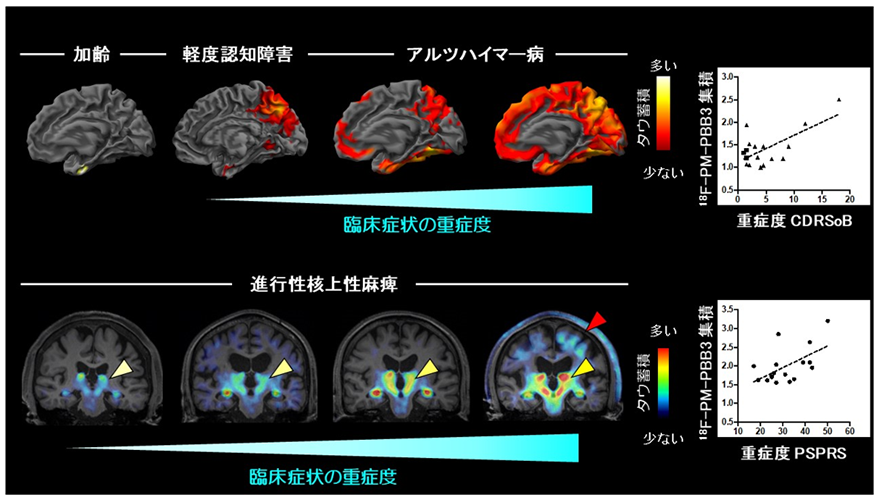 図3 アルツハイマー病・進行性核上性麻痺患者におけるタウの分布と重症度との関連上図:健常からアルツハイマー病に至るタウの広がりと重症度との関連
図3 アルツハイマー病・進行性核上性麻痺患者におけるタウの分布と重症度との関連上図:健常からアルツハイマー病に至るタウの広がりと重症度との関連
下図:進行性核上性麻痺患者におけるタウ蓄積と重症度との関連
黄三角は大脳深部のタウ蓄積を、そして赤三角は大脳皮質のタウ蓄積を示唆する18F-PM-PBB3の集積を示す。
また、アルツハイマー病のみならず、既存のPET薬剤では診断が困難だった進行性核上性麻痺においても高い感度・特異度で(90%以上)患者と健常者を診断できることも明らかにし、本PET薬剤の診断薬としての有用性を示しました。(図4)。
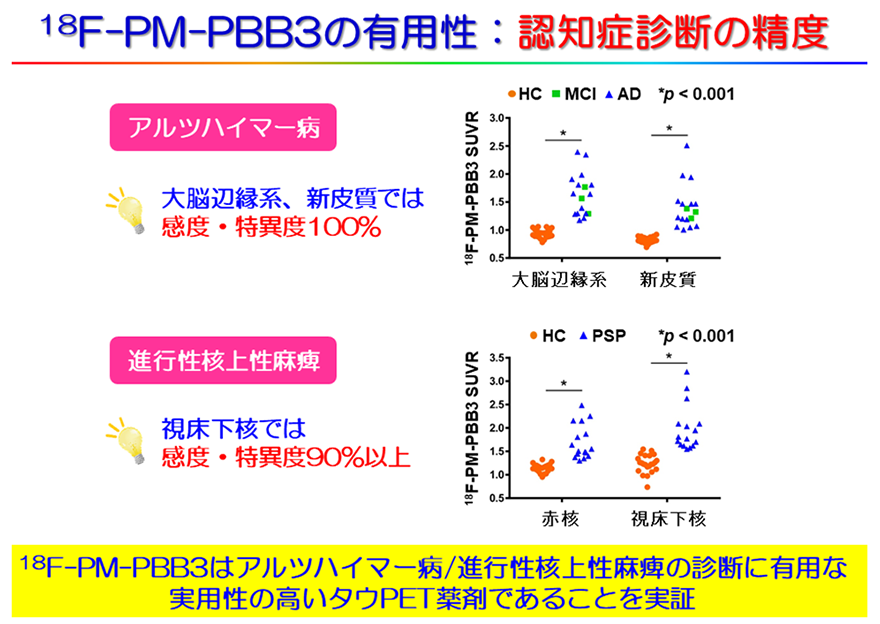 図4 18F-PM-PBB3はアルツハイマー病/進行性核上性麻痺を高い感度・特異度で健常者と区別可能アルツハイマー病(AD)、進行性核上性麻痺(PSP)のいずれにおいても18F-PM-PBB3の集積は健常者(HC、オレンジ)では疾患群(青:AD、緑:MCI(軽度認知機能障害))の値よりも低値であることが多数を占め、健常と疾患の区別が可能であることがわかる。
図4 18F-PM-PBB3はアルツハイマー病/進行性核上性麻痺を高い感度・特異度で健常者と区別可能アルツハイマー病(AD)、進行性核上性麻痺(PSP)のいずれにおいても18F-PM-PBB3の集積は健常者(HC、オレンジ)では疾患群(青:AD、緑:MCI(軽度認知機能障害))の値よりも低値であることが多数を占め、健常と疾患の区別が可能であることがわかる。
さらに、本PET薬剤の特徴は疾患モデルマウスのタウ病変を生体脳で可視化できることにあります(図5)。この特徴を生かし、18F-PM-PBB3は基礎から臨床まで一気通貫の治療薬開発に利用可能となります。
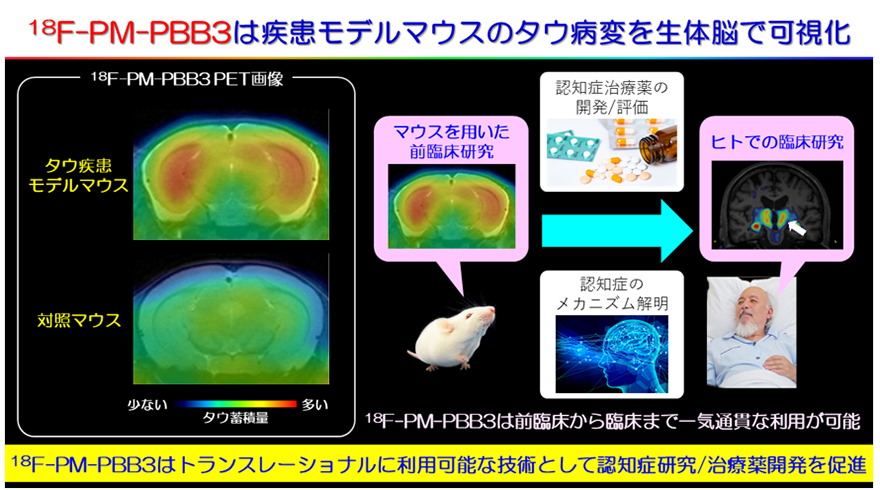 図5 18F-PM-PBB3はトランスレーショナルに利用可能な技術18F-PM-PBB3は基礎から臨床まで一気通貫な利用が可能、つまりマウスで治療薬候補を評価し、効果を検証したのちに人を対象とした臨床研究に発展させることができる。また、18F-PM-PBB3により人でみられた病態をマウスを用いてそのメカニズムを再検証することも可能になる。
図5 18F-PM-PBB3はトランスレーショナルに利用可能な技術18F-PM-PBB3は基礎から臨床まで一気通貫な利用が可能、つまりマウスで治療薬候補を評価し、効果を検証したのちに人を対象とした臨床研究に発展させることができる。また、18F-PM-PBB3により人でみられた病態をマウスを用いてそのメカニズムを再検証することも可能になる。
今後の展開
本研究で18F-PM-PBB3が認知症モデルマウスからヒトにおいてタウ蓄積を高感度に可視化できること、ならびにアルツハイマー病や前頭側頭葉変性症のような多様なタウ蓄積を認める疾患に対して有用であることが示されました。
現在、APRINOIA社との共同で米国、台湾、日本において18F-PM-PBB3の診断薬としての承認を得るための第1相および第2相臨床試験が進められています。タウ病変に対する抗体を含む治療薬候補が世界各地で開発されているため、今後、ますます18F-PM-PBB3の需要は高まるものと考えられます。18F-PM-PBB3はタウの病態解明や、その蓄積を抑える治療薬の開発・治療効果判定まで一気通貫で利用可能な技術として、さらにより幅広く認知症やその関連する病態を評価する診断技術として、認知症医療の発展に大きく寄与する可能性があります。
このプレスリリースは『Neuron』のオンライン版に掲載される「Tagai K, et al. High-contrast in-vivo imaging of tau pathologies in Alzheimer’s and non-Alzheimer’s disease tauopathies」(邦題:アルツハイマー・非アルツハイマー型タウオパチーに伴うタウ病変の生体高感度イメージング)」に基づいて作成されています。
用語解説
- 1)前頭側頭葉変性症
- 大脳の前頭葉や側頭葉を中心に萎縮をきたす認知症・神経難病の総称で、様々な神経難病・認知症がこれに含まれます。人格変化や感情障害、言語障害、運動障害などの多彩な症状を呈します。
- 2)タウ
- 神経系細胞の骨格を形成する微小管に結合するタンパク質。細胞内の骨格形成と物質輸送に関与しています。アルツハイマー型認知症をはじめとする様々な精神神経疾患において、タウが異常にリン酸化して細胞内に蓄積することが知られています。
- 3)PET
- 陽電子断層撮影法(Positron Emission Tomography)の略称。身体の中の生体分子の動きを生きたままの状態で外から見ることができる技術の一種。特定の放射性同位元素を結合したPET薬剤を患者に投与し、PET薬剤より放射される陽電子に起因するガンマ線を検出することによって、体深部に存在する生体内物質の局在や量などを三次元的に測定できます。
- 4)4大認知症
- 認知症全体の約9割を、大きく分けて次の4種類に分類することができ、これらは「4大認知症」と呼ばれている。具体的にはアルツハイマー型認知症、前頭側頭型認知症(前頭側頭葉変性症のひとつ)、レビー小体型認知症、脳血管性認知症に分類される。
- 5)レビー小体型認知症
- 物忘れのみならず、幻視、体の動きがぎこちなくなるなどのパーキンソン症状を伴う認知症。
- 6)アミロイドβ(Aβ)
- 脳内で作られるタンパク質の一種で、アルツハイマー病患者の脳に多く沈着しており、アルツハイマー病の発症に大きく関わっていると考えられています。
- 7)11C-PBB3
- 量研が開発した、脳内に蓄積したタウに対して選択的に結合する薬剤。PBB3のPBBはPyridinyl-Butadienyl-Benzothiazoleの略称。蛍光物質であることから、生体蛍光画像を得るのにも利用できるが、PBB3を放射性同位元素で標識することにより、PET薬剤として使用できます。生体蛍光画像は細胞レベルの詳細な観察を可能にするが、脳の深部を観察することは困難である。PETは脳の深部観察を可能にし、ヒトにも応用可能です。
- 8)進行性核上性麻痺
- 眼球運動障害、左右対称性の運動障害、前頭葉機能障害を認め、転倒を繰り返すパーキンソン症状を呈し、前頭側頭葉変性症に含まれます。
- 9)感度・特異度
- 感度とは「病気の患者を正しく病気と判定する確率」のことであり、感度が高ければ高いほどその検査は病気を見逃しにくくなります。一方、特異度は「健常な人を正しく病気でないと判定する確率」。特異度が高ければ高いほどその検査が陽性であった時に誤診である可能性が低くなります。
- 10)シヌクレイン
- 脳内のシナプス機能の調節や可塑性に関与するタンパク質。凝集し蓄積したα-シヌクレインはパーキンソン病、レビー小体型認知症および多系統萎縮症といった、神経難病や認知症の主な原因の一つと考えられています。
- 11)大脳基底核変性症候群
- パーキンソン症状と大脳皮質症状(手が思うように使えない、動作がぎこちないなど)が同時にみられる認知症で、身体の左側または右側のどちらか一方に症状が強いのが特徴であり、前頭側頭葉変性症に含まれます。
- 12)進行性非流暢性失語
- 発語の量が減少し、助詞を間違える、言葉の思い出しに時間がかかるなどの言語障害を主体とする認知症であり、前頭側頭葉変性症に含まれます。
- 13)行動障害型前頭側頭型認知症
- 前頭側頭葉変性症の中でも特に行動の異常や人格の変化の目立つ認知症であり、しばしば精神疾患と誤診されます。ピック病もここに分類され、脳解剖病理診断はピック球があるということに基づいてなされる。
本件に関するお問い合わせ先
研究内容について
国立研究開発法人量子科学技術研究開発機構
量子医学・医療部門 放射線医学総合研究所
脳機能イメージング研究部 主幹研究員 高堂裕平
報道対応
国立研究開発法人量子科学技術研究開発機構
経営企画部 広報課 中禎弘
AMED事業について
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課