2020-11-25 岐阜大学,日本医療研究開発機構
岐阜大学連合創薬医療情報研究科赤尾幸博特任教授の研究グループは、多くのがん種で変異しているRAS遺伝子1)システムの機能を阻害するマイクロRNA2)核酸医薬3)の開発に世界で初めて成功しました。これまでに5報の国際科学論文にて報告し、その効果や作用機構について明らかにしました。今回、新しい治療法が期待されている小児希少がんである横紋筋肉腫に対する効果を確認しました。
今回の研究成果は、日本時間2020年11月10日(火)にCancers誌のオンライン版で発表されました。
発表のポイント
- ヒトのがんの約30%にRAS遺伝子の異常がみられる。
- RAS遺伝子、RASタンパク質に対する医薬は世界中で開発されているが有効な医薬は無い。
- RASタンパクは構造上ポケットが無いため阻害剤の創出は難しい。
- RASタンパクは局在から抗体医薬による阻害剤は難しい。
- RASによる増殖シグナルはネットワークを形成しており、RASのみを阻害してもRASシステムを抑えられない。従って、複数の遺伝子の機能を抑制するマイクロRNAが効果的である。
- 本研究グループが開発した合成マイクロRNA143は、RASシステムを構成する複数の重要な遺伝子の発現を抑え、RASシステムを不能にしてがん細胞にアポトーシスを誘導する。そのIC504)はこれまでに検証したがん細胞では1-5nMと非常に活性が高いことが分かった。
概要
RAS変異は最上位のドライバー癌遺伝子5)であり、これまでのがんゲノム解析からヒトのがんの約30%にRAS遺伝子の変異が観察されています。しかし、RAS蛋白に対する阻害剤の開発が世界規模で行われているものの難航しています。我々はRAS変異がんではRASのみを阻害しても効果が限定的であり、RASネットワークを多角的に破綻させる化学修飾マイクロRNA-143(以下、「miR-143#12」とする)が有望であることを示してきました。この合成miR-143#12はRASのみならず、RASネットワークを構成する重要なAKT、ERK、SOS1遺伝子を標的にし、きわめて低濃度で、そのネットワークを破綻させてアポトーシスを誘導します。また、モデルマウスにおいても少量の全身投与で顕著な抗腫瘍効果を発揮しました。本研究成果は今後、RAS変異がん治療のブレークスルーとなる可能性が期待されます。
研究成果
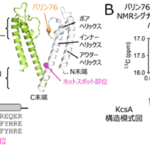
RASは10をこえる下流のシグナルを制御することで膨大なネットワークを形成しています(図1)。特にPI3K/AKTとMAPK/ERK6)シグナルは細胞増殖、細胞生存に関する遺伝子の転写を誘導する重要なシグナル伝達経路となっています。我々の解析ではK-RASのみ阻害しても増殖抑制は一過性であり、RASネットワークにより代償性シグナル7)が活性化され、即時にその阻害はキャンセルされることが分かっています。そのため、K-RAS単独を標的にしてもK-RAS変異がんを排除することは困難です。こうしたことから、我々はK-RAS及びK-RASネットワークを多角的に抑制するmicroRNA(miRNA)の開発を2006年から開始しました。その結果、K-RASシステムを破綻させる主要なmiRNAがmiR-143であることを明らかにしました。miR-143は染色体5q32-33に局在し、その転写産物はmiR-145と共発現し、多くのがんにおいてそれらの発現が低下しているがん抑制miRNAです。miR-143はK-RASのみならずその下流の増殖を誘導するシグナル系(effector signal)PI3K/AKTとMAPK/ERKシグナルのAKT及びERKを標的にし、相乗的にこれらのシグナルを抑制することが分かりました。
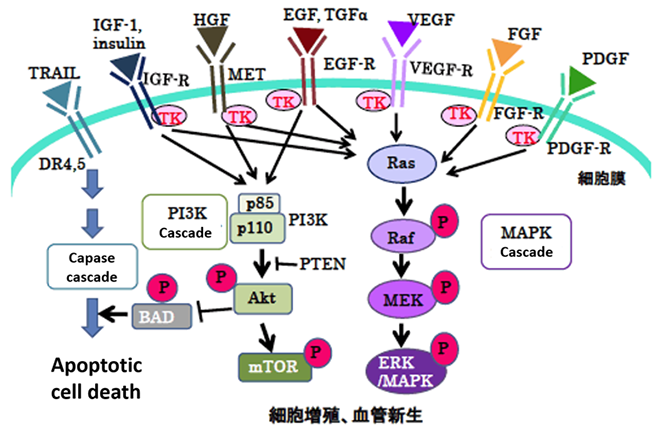
図1 RASシグナルネットワーク
近年、本研究グループは化学修飾を施したmiR-143#12の開発に成功しました(図2)。100をこえるmiR-143誘導体から最もヌクレアーゼ耐性で、しかも抗がん活性はヒト大腸癌細胞株DLD-1においてIC50:1.32nMであり、Ambion社のmiR-143の数十倍でした。miR-143#12はガイド鎖8)に様々な化学修飾をしており、多くのmiR-143誘導体の中で卓越した活性を有していました。強力なmiR-143#12を用いることでKRAS/ADPから活性型KRAS/ATPに変換するSOS1も標的にしていること、さらにK-RAS effector signalの標的遺伝子がK-RAS自身で在ること、つまりK-RAS正の制御回路の存在が明らかになりました(図3)。K-RAS変異大腸癌ではEGFRやAKT、MAPKに対する分子標的薬の効果は代償性のカスケードが働くため一過性であり期待出来ません。miR-143#12はこれまで明らかにできなかった詳細なmiR-143/K-RASカスケードを明らかにしました(図3)。これまで、様々なヒトがん細胞を皮下に移植したヌードマウスにmiR-143#12を全身投与し、その結果、全例において、低用量で顕著な腫瘍増殖抑制が見られました(膀胱癌、胃癌、腎癌、横紋筋肉腫)。投与されたマウス腫瘍サンプルにおける蛋白発現では、K-RAS及びK-RASエフェクターシグナル分子、AKT、ERKの発現が有意に低下していました。in vitro実験でのmiR-143#12の効果は動物実験でも実証されました。今回は小児希少がんである横紋筋肉腫においてのMIR143#12の効果について報告しました。
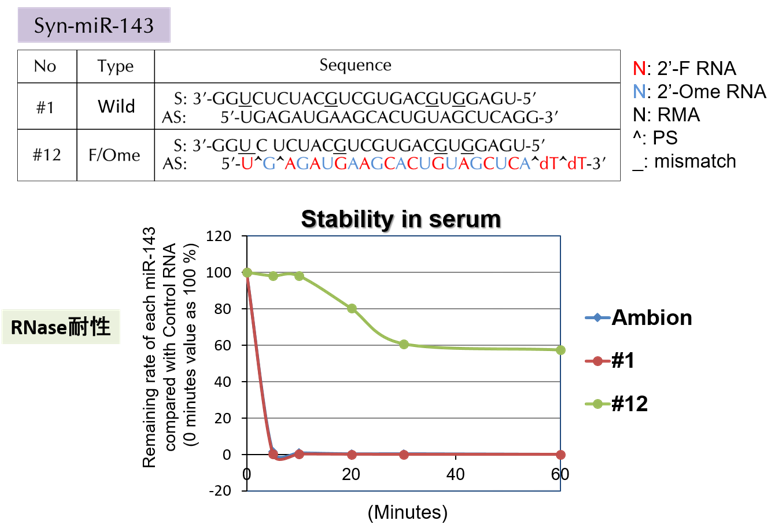
図2 化学修飾miR-143#12の構造とRNase耐性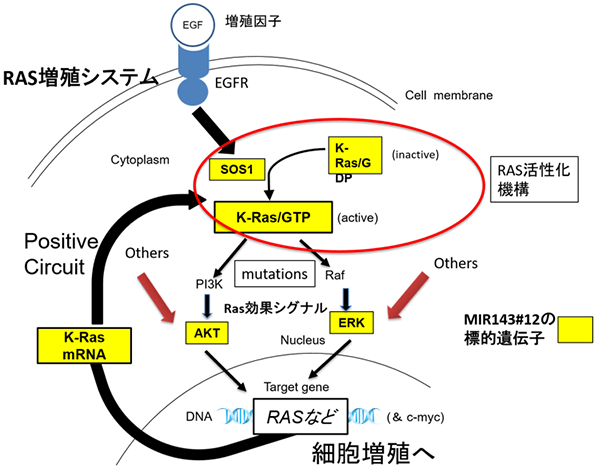
図3 MIR143#12の標的遺伝子とK-RAS正の制御回路
今後の展開
がん化に最も重要な役割を果たしているドライバー遺伝子であるRASの変異を有するがんの根治には、RAS単独を阻害しても不十分であり、本研究グループが開発した化学修飾miR-143#12による多角的なRASネットワークの抑制が最適であることが分かりました。今後、miR-143#12のin vitroの効果が反映される薬剤搬送システムの開発が望まれます。
論文情報
- 雑誌名
- Cancers
- タイトル
- Synthetic MIR143-3p suppresses cell growth in rhabdomyosarcoma cells by interrupting RAS pathways including PAX3-FOXO1
- 著者
- Sugito N, Heishima K, Ito Y, Akao Y.
- DOI番号
- 10.3390/cancers12113312
- 論文公開URL
- https://www.mdpi.com/2072-6694/12/11/3312/html
各種RAS変異がんに対する効果を報告したこれまでの国際科学論文(References)
- 大腸がん(Colon cancer)
- Impairment of K-Ras signaling networks and increased efficacy of epidermal growth factor receptor inhibitors by a novel synthetic miR-143. Akao Y, Kumazaki M, Shinohara H, Sugito N, Kuranaga Y, Tsujino T, Yoshikawa Y, Kitade Y. Cancer Sci. 2018 May;109(5):1455-1467. doi: 10.1111/cas.13559. Epub 2018 Apr 14.
- 膀胱がん(Bladder cancer)
- Anti-cancer Effects of a Chemically Modified miR-143 on Bladder Cancer by Either Systemic or Intravesical Treatment. Yoshikawa Y, Taniguchi K, Tsujino T, Heishima K, Inamoto T, Takai T, Minami K, Azuma H, Miyata K, Hayashi K, Kataoka K, Akao Y. Mol Ther Methods Clin Dev. 2019 Feb 20;13:290-302. doi: 10.1016/j.omtm.2019.02.005. eCollection 2019 Jun 14.
- 胃がん(Gastric cancer)
- Synthetic miR-143 Inhibits Growth of HER2-Positive Gastric Cancer Cells by Suppressing KRAS Networks Including DDX6 RNA Helicase. Tokumaru Y, Tajirika T, Sugito N, Kuranaga Y, Shinohara H, Tsujino T, Matsuhashi N, Futamura M,Akao Y, Yoshida K. Int J Mol Sci. 2019 Apr 5;20(7):1697. doi: 10.3390/ijms20071697.
- 腎がん(kidney cancer)
- Synthetic miR-143 Exhibited an Anti-Cancer Effect via the Downregulation of K-RAS Networks of Renal Cell Cancer Cells In Vitro and In Vivo. Takai T, Tsujino T, Yoshikawa Y, Inamoto T, Sugito N, Kuranaga Y, Heishima K, Soga T, Hayashi K, Miyata K, Kataoka K, Azuma H, Akao Y. Mol Ther. 2019 May 8;27(5):1017-1027. doi: 10.1016/j.ymthe.2019.03.004. Epub 2019 Mar 13.
用語解説
- 1)RAS遺伝子
- がんの中で最も頻度が高く異常を示すがんドライバー遺伝子、その異常は多岐にわたる。現在、RASの機能を抑える阻害剤はなく、世界中で開発が行われている
- 2)マイクロRNA
- 21-25merの2本鎖RNAで複数のメッセンジャーRNA(遺伝子)に結合してその翻訳を負に調節している
- 3)核酸医薬
- DNA、RNAを用いた医薬品
- 4)IC50
- 細胞の増殖を半分に抑える合成マイクロRNA143の濃度
- 5)ドライバー癌遺伝子
- がん細胞の増殖に関与する責任遺伝子
- 6)PI3K/AKTとMAPK/ERK
- RAS遺伝子によって活性化される2つの重要なシグナル名で、この2つのシグナルが細胞増殖に関わる遺伝子を誘導する
- 7)代償性シグナル
- 主経路が障害されたときに機能する代替シグナル系
- 8)ガイド鎖
- マイクロRNA2本鎖のうち、標的の遺伝子に結合するRNA鎖
研究者プロフィール
赤尾幸博(あかおゆきひろ)
岐阜大学大学院連合創薬医療情報研究科特任教授
- 略歴
- 昭和53年3月 大阪医科大学卒業
昭和53年4月 名古屋第一赤十字病院内科(骨髄移植)
昭和59年4月 名古屋大学医学部第一内科、分院内科(医学博士取得)
昭和63年9月 米国ウイスター研究所(Dr. Calro Croce)
平成2年9月 名古屋大学医学部分院内科
平成3年4月 愛知県がんセンター研究所(化学療法部)主任研究員
平成5年9月 大阪医科大学助教授
平成8年7月 岐阜県国際バイオ研究所部長
平成21年4月 岐阜大学大学院連合創薬医療情報研究科教授
平成30年4月 岐阜大学大学院連合創薬医療情報研究科特任教授
本件に関する問い合わせ先
研究に関すること
岐阜大学連合創薬医療情報研究科 特任教授 赤尾幸博
報道担当
岐阜大学管理部総務課広報係
AMED事業に関する問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
次世代がん医療創生研究事業(P-CREATE)