2021-06-04 信州大学,京都府立医科大学,株式会社イナリサーチ,日本医療研究開発機構
信州大学学術研究院医学系の中沢洋三教授、京都府立医科大学大学院医学研究科の柳生茂希講師(学内)、株式会社イナリサーチの下井昭仁上席執行役員らの研究グループは、国立研究開発法人日本医療研究開発機構(AMED)再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(遺伝子治療製造技術開発)の支援のもと、2019年10月に再生医療等製品の開発に特化したオープンラボを有する非臨床試験施設『信州大学遺伝子・細胞治療研究開発センター(CARS)イナリサーチラボ』を開設し、霊長類モデルを用いた非臨床安全性試験方法の開発に取り組んできました。このたび、遺伝子改変キメラ抗原受容体T細胞(CAR-T細胞)療法の安全性を評価するための霊長類モデルを開発し、その有用性を国際科学雑誌『Clinical & Translational Immunology』に学術論文として2021年6月4日に発表されました。
ポイント
- 遺伝子改変キメラ抗原受容体T細胞(CAR-T細胞)は、がん細胞のみが発現するたんぱく質を標的として抗腫瘍効果を発揮することから、がん免疫療法に用いられます。血液腫瘍、固形腫瘍に対して数多くのCAR-T細胞の開発が行われていますが、一部を除き実用化には至っていません。正常組織に対する毒性(Off tumor毒性注1)を評価する方法が定まっていないことが、実用化の遅れの要因の1つとなっています。
- 研究グループは、進化的にヒトとの相同性が極めて高いカニクイザルをモデルとして、CAR-T細胞のOff tumor毒性を評価する方法を開発しました。
- カニクイザルに免疫抑制剤をあらかじめ投与することで、数日から1週間程度は移植したヒト由来CAR-T細胞が拒絶されないモデルを開発しました。このモデルを用いて、ピギーバックトランスポゾン法注2で作製されたヒト末梢血単核球由来EPHB4受容体注3特異的CAR-T細胞(EPHB4-CAR-T細胞)の急性期におけるOff tumor毒性を評価し、CAR-T細胞投与後1週間までに生じやすい正常臓器に対するOff tumor毒性が観察されないことを確認しました。
- 本開発技術は、CAR-T細胞開発の障壁となるOff tumor毒性を事前に評価しうるモデルとなることから、本開発技術を用いた非臨床安全性試験基盤を構築することで、CAR-T細胞療法の実用化が推進することが期待されます。
研究の背景
CAR-T細胞とは、免疫細胞であるT細胞に対して遺伝子操作を加えることで、がん細胞を強力に殺傷する能力をもった人工T細胞のことを指します。CAR-T細胞は、がん細胞で強く発現しているたんぱく質を認識することで、がん細胞を殺傷します。がん治療は従来の抗がん剤や放射線治療とは異なる機序でがん細胞を殺傷することから、難治性あるいは治療抵抗性のがんに対してもその有効性が期待されています。すでに、一部の白血病や悪性リンパ腫など、血液腫瘍に対するCAR-T細胞は製品化され、わが国でも治療に使われています。
CAR-T細胞療法の副作用として、CAR-T細胞ががん細胞ではなく誤って正常組織を認識してしまうことによって生じる毒性(Off tumor毒性)が報告されています。CAR-T細胞によるOff tumor毒性は、CAR-T細胞が投与されたのち数時間~数日以内に発症し、万一心臓や肺、脳などの重要臓器にOff tumor毒性が生じた場合には致死的となることから、開発の時点でOff tumor毒性が生じる可能性については十分に評価を行う必要があります。
通常の医薬品開発では、げっ歯類(マウス、ラットなど)を用いた薬効評価や安全性試験が行われます。CAR-T細胞の薬効評価については、ヒト由来腫瘍をもつ担がん免疫不全マウスモデルを用いた薬効評価が広く行われています。
一方で、CAR-T細胞が標的とするたんぱく質の構造はヒトとげっ歯類では大きく異なることから、CAR-T細胞のOff tumor毒性評価にはげっ歯類を用いた安全性試験を行うことが出来ず、新規CAR-T細胞を開発する際の障壁となっていました(図1)。
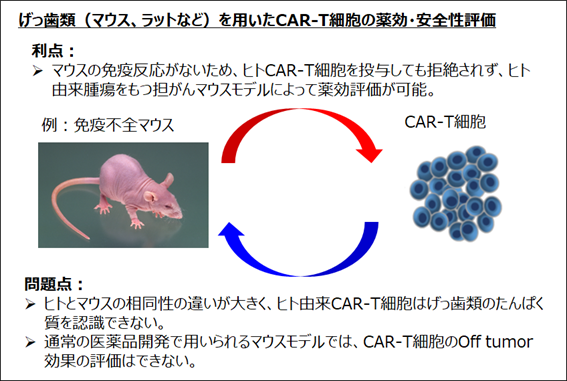
図1 げっ歯類(マウス、ラットなど)を用いたCAR-T細胞の薬効・安全性評価
ヒト細胞加工製品の非臨床安全性試験においては、免疫不全動物(マウスまたはラット)により安全性試験が実施困難な場合、代替として動物由来の同等製品を利用する、あるいは免疫抑制剤投与下での動物を利用する方法が可能と考えられますが、適切な動物種や試験法は定まっていませんでした。
この問題を解決するために、研究グループは、ヒトとの相同性が極めて高く、ほとんどのたんぱく質の構造が高度にヒトと共通しているカニクイザルからCAR-T細胞を作製し、投与することで、CAR-T細胞のOff tumor毒性を評価する方法(自家移植モデル)を報告していました(Morokawa H et al. Clin Transl Immunology, 9(11):e1207, 2020, doi.org/10.1002/cti2.1207)。この報告では、急性骨髄性白血病や若年骨髄単球性白血病細胞に高発現するGM-CSF受容体注4を認識、殺傷するCAR-T細胞(GMR-CAR-T細胞)を用いて、自家移植モデルによる安全性評価を行いました(図2)。
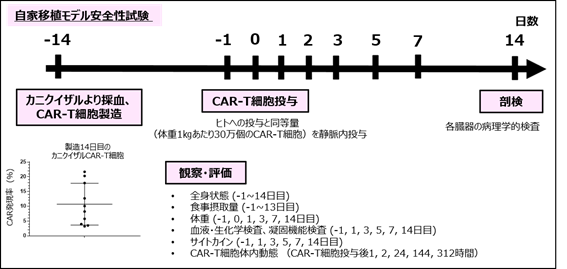
図2 自家移植モデルによる安全性試験の投与スケジュールと観察・評価項目
試験14日前にカニクイザルT細胞を用いてGMR-CAR-T細胞を作製し、同一のカニクイザル個体に自家移植し、14日間の観察を行いました。移植後のカニクイザル末梢血中ではGMR-CAR-T細胞の細胞数が一過性に上昇しましたが、その後細胞数は徐々に低下しました。投与後のカニクイザルの一般状態(全身状態)、食事摂取量には変化は見られず、発熱、体重減少、呼吸、循環不全など重篤な症状も認められませんでした。また、血液・生化学検査、凝固機能検査でも、観察期間中にCAR-T細胞の影響と思われる異常値は認められませんでした。さらに、GMR-CAR-T細胞投与後14日目に実施した病理学的検査でも、臓器障害を示唆する異常所見は認められませんでした。
この自家移植モデルは、カニクイザルのT細胞を用いて、治験製品の代替製品となるCAR-T細胞を作製し、安全性評価を行う試験です。そのため、実際の治験製品を用いた安全性評価にはなりません。一方で、実際の治験製品(ヒト由来CAR-T細胞)をカニクイザルに投与しますと、カニクイザルリンパ球を介した免疫反応によって速やかに拒絶されてしまいます。このため、カニクイザルにおいて、拒絶されずに実際の治験製品(ヒト由来CAR-T細胞)を用いた安全性評価を行うことが可能な方法の開発が求められていました。
本研究の概要
現在までに報告されているCAR-T細胞の重篤なOff tumor毒性はそのほとんどが投与後数時間~数日以内に発症しています。そこで研究グループは、カニクイザルに免疫抑制剤を先行投与して、数日間カニクイザルのリンパ球機能を抑制するモデルを作ることで、異種であるヒトCAR-T細胞が拒絶されないモデル(異種移植モデル)を作製しました(図3)。
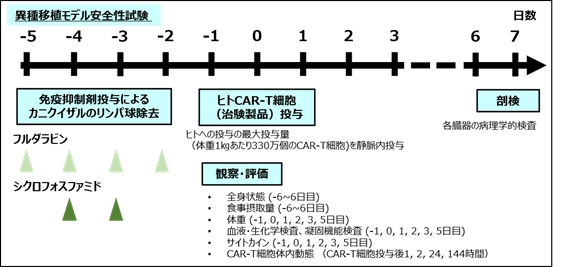
図3 異種移植モデルによるCAR-T細胞の安全性試験の投与スケジュールと観察・評価項目
ヒトCAR-T細胞臨床試験でも前処置として用いられている免疫抑制剤(フルダラビン、シクロフォスファミド)をカニクイザルに投与することで、カニクイザルリンパ球数を正常下限以下までに低下させることができ、リンパ球数抑制はCAR-T細胞投与後7日目まで持続しましたが、好中球数には影響を与えませんでした(図4)。また、適切な支持療法を行うことで、免疫抑制剤の投与による有害事象(感染症、嘔気、嘔吐、出血性膀胱炎など)はみられませんでした。
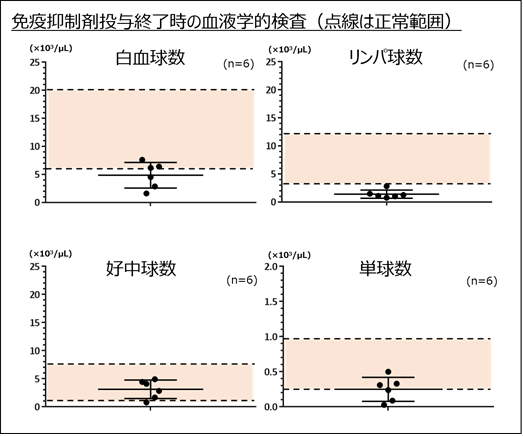
図4 免疫抑制剤投与終了時の血液細胞検査
このモデルを用いて、悪性骨軟部腫瘍や乳がんなど、多くのヒト固形がんに高発現し、その悪性度に関与しているEPHB4受容体を標的とするCAR-T細胞(EPHB4-CAR-T細胞)の安全性評価を行いました。
まず、ヒトEPHB4-CAR-T細胞は、カニクイザルEPHB4受容体を発現する細胞を認識し、殺傷することを明らかにしました。次に、免疫抑制状態にあるカニクイザルに対して、ヒトT細胞より製造したEPHB4-CAR-T細胞を投与しました。投与後24時間で血中にEPHB4-CAR-T細胞の細胞数が一過性に上昇しましたが、その後は徐々に低下しました。カニクイザルの一般状態(全身状態)、食事摂取量には変化は見られず、発熱、体重減少、呼吸、循環不全など重篤な症状は認められませんでした。また、血液・生化学検査、凝固機能検査でも、観察期間中にCAR-T細胞の影響と思われる異常値は認められませんでした。さらに、EPHB4-CAR-T細胞投与後7日目に実施した病理学的検査でも、臓器障害を示唆する異常所見は認められませんでした。EPHB4受容体は、発生段階のヒト正常組織に発現するほか、成熟した血管内皮など一部の正常組織にも弱く発現していることが知られていますが、本試験の観察期間中には明らかなEPHB4-CAR-T細胞に関連する異常所見は認められませんでした。
今後の期待
これまでCAR-T細胞の開発においては、適切な動物モデルを用いたOff tumor毒性の評価系がないことから、十分な安全性評価ができていませんでした。研究グループが開発したカニクイザルを用いた自家移植モデル、異種移植モデルは、ヒトとカニクイザルの高い相同性を利用して、予期せぬ重篤なOff tumor毒性の評価を可能にします(図5)。
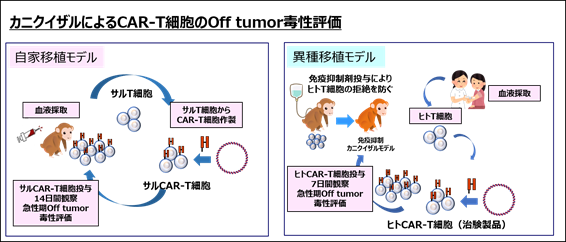
図5 カニクイザルによるCAR-T細胞のOff tumor毒性試験
一方で、これらのカニクイザルモデルにもそれぞれ有用性と課題があります(表1)。CAR-T細胞の安全性評価においては、これらの動物モデルの特性を十分理解したうえで適切な評価系を選択することで、有効性に加えて、安全性の高いCAR-T細胞の開発に繋がると期待されます。
表1 自家移植モデル、異種移植モデルの有用性と課題
| 有用性 | 課題 | |
|---|---|---|
| 自家移植モデル |
|
|
| 異種移植モデル |
|
|
また、本研究の実施施設である『CARSイナリサーチラボ』は、再生医療等製品の開発を行う研究グループに広く開放されていることから、今後『CARSイナリサーチラボ』の活用により、国産再生医療等製品の国内開発が推進されることが期待されます。
注釈
- 注1:Off tumor毒性
- CAR-T細胞が正常細胞に発現しているたんぱく質を認識し、傷害することで生じる毒性のこと。CAR-T細胞投与後比較的早期に(数時間~数日)毒性が見られ、重要臓器にOff tumor毒性が出現したことで致死的となった報告もある。
- 注2:ピギーバックトランスポゾン法
- ピギーバック転移酵素というたんぱくを用いた遺伝子改変法。ピギーバック転移酵素は、目的の遺伝子をヒトゲノムにランダムに組み込むことが可能であり、この方法を応用して、CAR遺伝子をT細胞ゲノムに組み込むことで、CAR-T細胞が作製される。
- 注3:EPHB4受容体
- EPHファミリーたんぱくの一種であり、ヒトでは発生段階の血管を中心に発現しているが、成熟組織での発現は抑制されていることが知られている。乳がん、卵巣がん、悪性骨軟部腫瘍など、多くの固形がんで高発現し、悪性化にかかわっている。
- 注4:GM-CSF受容体
- サイトカインの受容体の一種で、GMRα鎖とβ鎖の複合体より構成される。GM-CSF受容体は単球やマクロファージ、造血幹細胞や血管内皮などに発現しているが、若年性骨髄単球性白血病や、一部の急性骨髄性白血病に高発現することが知られている。また、ヒトGM-CSF受容体たんぱくとカニクイザルGM-CSF受容体たんぱくは95%以上の相同性を持つことが知られている。
論文情報
- タイトル
- Lymphodepleted non-human primate model for the assessment of acute on-target and off-tumor toxicity of human CAR-T cells.
- 著者
- Yagyu S, Mochizuki H, Yamashima K, Kubo H, Saito S, Tanaka M, Sakamoto K, Shimoi A, Nakazawa Y
- 雑誌名
- Clinical & Translational Immunology
- DOI
- 10.1002/cti2.1291
研究費
- 2018年度~2023年度 日本医療研究開発機構(AMED)再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(遺伝子治療製造技術開発) 「日本発の遺伝子改変T細胞の実用化を促進するための、霊長類モデルを用いた安全性評価系の基盤整備」(研究開発代表者:中沢 洋三)
- 2017年度~2019年度 日本医療研究開発機構(AMED)革新的がん医療実用化研究事業「研究開発課題名:CD116陽性骨髄系腫瘍を標的とした非ウイルス遺伝子改変キメラ抗原受容体T細胞の非臨床試験」(研究開発代表者:中沢 洋三)
- 2018年度~2020年度 日本医療研究開発機構(AMED)革新的がん医療実用化研究事業「EPHB4受容体陽性悪性軟部腫瘍を標的とした非ウイルス遺伝子改変キメラ抗原受容体T細胞療法の非臨床試験」(研究開発代表者:柳生 茂希)
お問い合わせ先
研究・報道に関すること
国立大学法人信州大学医学部 小児医学
中沢洋三
京都府公立大学法人京都府立医科大学大学院医学研究科 小児科学
柳生茂希
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 遺伝子治療研究開発課
再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(遺伝子治療製造技術開発)