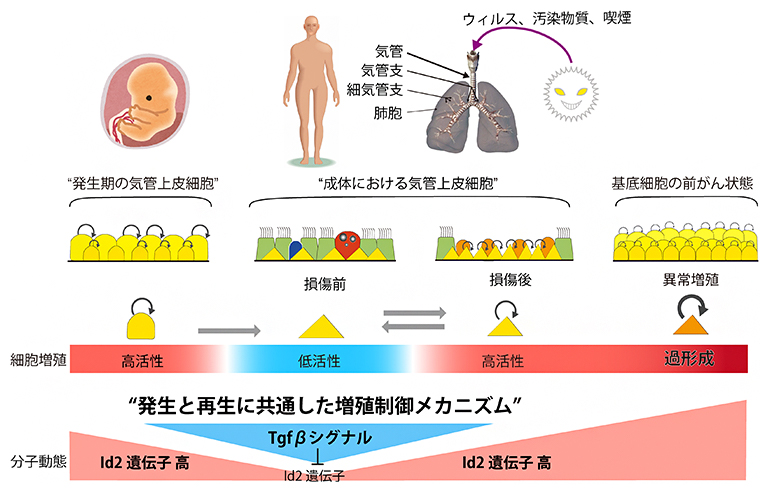
中枢神経系を標的にすることで運動機能が劇的に改善
2021-06-15 理化学研究所,タケダ-CiRA共同研究プログラム(T-CiRA)
理化学研究所(理研)開拓研究本部鈴木糖鎖代謝生化学研究室の藤縄玲子テクニカルスタッフ、鈴木匡主任研究員、武田薬品工業リサーチT-CiRAディスカバリーの朝比奈誠主任研究員らの共同研究チームは、Ngly1遺伝子を欠損させたNgly1-KOラットの脳室[1]内にヒトのNGLY1遺伝子を導入することで、運動機能が劇的に改善することを明らかにしました。
本研究成果は、遺伝性稀少疾患である「NGLY1欠損症」の治療法の開発につながるものと期待できます。
NGLY1欠損症は、患者数が世界で100人に満たない稀な病気で、発育不全、四肢の筋力低下、不随意運動など全身に重篤な症状を示します。病態発現の詳細なメカニズムは解明されておらず、有効な治療法も見つかっていません。
今回、共同研究チームはこれまでに開発してきたNgly1-KOラットを用いて、その脳室内にアデノ随伴ウイルス[2]セロタイプ9(AAV9)[3]を用いたヒトNGLY1遺伝子の導入を試みました。その結果、単回投与で、大脳、小脳、脊髄といった中枢神経系の器官でNGLY1遺伝子の発現が確認され、運動機能の劇的な改善が見られました。これは、Ngly1-KOラットの表現型が可逆的(治療により症状が回復する)でNGLY1欠損症の治療法の開発に有用なモデル動物であること、少なくともNGLY1欠損症で観察される運動機能の失調の一部は中枢神経系の異常によるもので、脳を含めた中枢神経系が治療の有力な標的器官であり得ることを示しています。
本研究は、科学雑誌『Molecular Brain』オンライン版(6月13日付)に掲載されました。
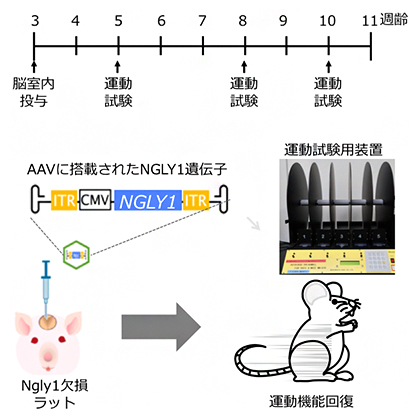
本研究の概要
背景
真核細胞の細胞質に広く存在するペプチド:N-グリカナーゼ(PNGase)[4]はタンパク質の品質管理に関わるN-結合型糖鎖脱離酵素[5]で、Ngly1遺伝子にコードされています。鈴木糖鎖代謝生化学研究室ではこれまで、PNGaseの生理機能の研究を進めてきました(図1)。
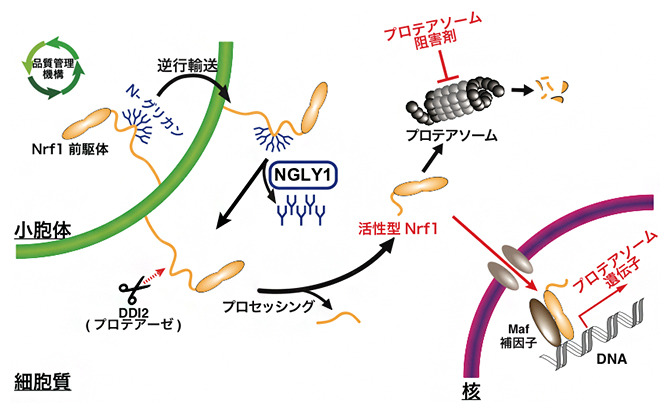
図1 細胞内における酵素NGLY1の生理機能
小胞体で合成された糖タンパク質のうち正しく折り畳み構造を取れないものは、プロテアソームと呼ばれる細胞質におけるタンパク質の分解を担う複合体によって分解される。その分解の際に、NGLY1は糖タンパク質から糖鎖を脱離、除去する。一方、NGLY1による糖鎖脱離によって、タンパク質が活性化する例も存在することが知られている。本図はNrf1と呼ばれる転写因子がプロテアソーム阻害剤の存在下で、NGLY1の糖鎖脱離によって活性化する例を示している。
2012年、ヒトにおいてNGLY1遺伝子の変異による遺伝性疾患の「NGLY1欠損症」が発見されました。NGLY1欠損症の患者数は世界中で100人以下であり、非常に稀な疾患です。その症状は発育不全、四肢の筋力低下、不随意運動、てんかん、脳波異常、新生児の肝機能障害、無涙症、背骨の彎曲(わんきょく)など全身性で多岐にわたります。
理化学研究所と武田薬品工業は、NGLY1欠損症の治療法の開発を目指し、2017年から共同研究(NGLY1 deficiency Project)を行い、これまでに患者の症状と類似した表現型を示す動物モデルを開発してきました注1, 2)。今回は、開発したNgly1遺伝子を欠損させたNgly1-KOラットに、ヒトのNGLY1遺伝子を導入することで、さまざまな表現型に改善が見られるかどうかを調べました。
注1)Asahina, M., et al. Hum Mol Genet (2020) 29(10); 1635-1647 (doi: 10.1093/hmg/ddaa059)
注2)Asahina, M., et al. Proc Jpn Acad Ser B Phys Biol Sci (2021) 97(2): 89-102 (doi: 10.2183/pjab.97.005)
研究手法と成果
NGLY1欠損症患者に見られる症状の多くは中枢神経系の異常によると考えられていることから、共同研究チームはヒトNGLY1遺伝子をNgly1-KOラットの脳室内に投与しました。遺伝子の運び屋(ベクター)としては、神経系の細胞に遺伝子導入の効率が高いとされるアデノ随伴ウイルスのセロタイプ9(AAV9)としました。また、これまでの解析からNgly1-KOラットで最も早くに観察される表現型は神経の炎症で、5週齢のラットにその表現型が観察される一方で、2週齢のラットでは観察されないことから、3週齢ラットを用いました。
AAV9を用いてヒトNGLY1遺伝子を3週齢Ngly1-KOラットの脳室内に投与したところ、大脳、小脳、脊髄といった中枢神経系の器官でNGLY1遺伝子の発現が確認されました。また、発現したタンパク質が酵素PNGase活性を持つかどうかを確認したところ、ラットの脳組織では活性が認められた一方、肝臓での活性は見られませんでした。
NGLY1タンパク質(PNGase)は、アミノ酸のAsn(アスパラギン)と糖のGlcNAc(Nアセチルグルコサミン)の間のアミド結合を切断することから、これまでに、NGLY1欠損症患者の血清および尿におけるバイオマーカー[6]として、Asn-GlcNAcが同定されており、Ngly1-KOラットの尿中および血清中でもAsn-GlcNAcが著しく上昇します。
NGLY1遺伝子導入によってNgly1-KOラットの脊髄中のAsn-GlcNAcレベルは減少しましたが、血清や肝臓では減少しませんでした。これはAsn-GlcNAcレベルの減少は、NGLY1遺伝子の発現された部位に限局されることを示しています。
次に、NGLY1遺伝子を投与したNgly1-KOラットに対して、協調運動と運動学習を測定するロータロッドテスト[7]および歩行の異常を検出する足跡分析[8]を行ったところ、運動機能に著しい改善が見られました(図2)。また、神経炎症の減弱は確認されましたが、組織学的に観察される神経変性には回復は見られませんでした。
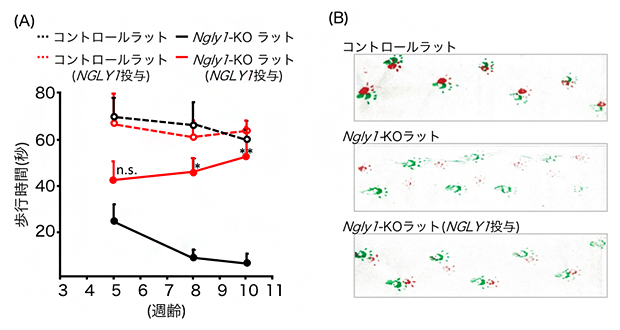
図2 ヒトNGLY1遺伝子導入ラットの運動機能の解析
遺伝子導入後、2~8週間の間に運動機能を測定した。
(A)ロータロッドテストでは、回転する車軸の上にラットを乗せて徐々に速度を上げ、ラットが落下するまでの時間を測定する。ヒトNGLY1遺伝子を導入したNgly1-KOラット(赤線)では、週齢とともに(導入した遺伝子の発現とともに)歩行時間が大幅に改善された。
(B)10週齢での足跡解析。前足の足跡を赤、後ろ足の足跡を緑で示している。Ngly1-KOラットの足跡(中段)は乱れているが、NGLY1を導入したNgly1-KOラットでは前足と後ろ足の足跡がほぼ重なり、歩行の改善が見られた。
本研究から、Ngly1-KOラットの表現型は可逆的(治療により症状が回復する)であることが初めて示され、T-CiRAチームがこれまでに開発してきたモデル動物はNGLY1欠損症の前臨床研究に有用であることが示されました。また、少なくともNGLY1欠損症で観察される運動機能の失調の一部は中枢神経系の異常によるもので、脳を含めた中枢神経系が治療の有力な標的器官であり得ることが明らかになりました。
今後の期待
これまでに鈴木糖鎖代謝生化学研究室は、患者団体であるGrace Science FoundationとNgly1研究に関する情報を共有してきましたが注3)、本研究はGrace Science Foundationが主体となる遺伝子治療による臨床試験の推進に大いに貢献すると期待できます。今後もさらにGrace Science Foundationとの連携を深め、NGLY1欠損症の病態解明や治療法開発のための研究を加速していくことを目指しています。
注3)2016年7月14日お知らせ「NGLY1欠損症の解明に向け理研とGrace Science Foundationが連携」
補足説明
1.脳室
大脳を構成する四つの空間のこと。脳室内部は髄液で満たされ循環している。
2.アデノ随伴ウイルス(AAV)
国内外の遺伝子治療研究にも用いられる、病原性を持たないウイルス。目的のタンパク質を発現させるための遺伝子の運び屋として機能する。AAV はadeno-associated virusの略。
3.セロタイプ
細胞表面の抗原をもとに分類した細胞やバクテリア、ウイルスの型で、ここではアデノ随伴ウイルスの表面構造タンパク質の種類によって分類されるAAVの種類を指す。セロタイプの違いによって各組織への導入効率の違いがあることが知られている。
4.ペプチド:N-グリカナーゼ(PNGase)
N型の糖鎖を糖タンパク質の根元から切り取る活性のある酵素。遺伝子名はNgly1であり、PNGaseとNgly1は同じタンパク質である。
5.N-結合型糖鎖脱離酵素
N-結合型糖鎖は、タンパク質のアスパラギン側鎖のアミド窒素に結合している糖鎖。細胞内では、タンパク質のフォールディング(ポリペプチドの折り畳みによる高次構造の構築)や細胞内での輸送を制御することが分かっている。N-結合型糖鎖脱離酵素は、N-結合型糖鎖をタンパク質の根元から切り離す酵素。
6.バイオマーカー
生体の状態変化などに使用する指標。特に疾患の有無や進行度、および薬剤などによる治療方法の効果を予測できる生体物質。
7.ロータロッドテスト
げっ歯類における協調運動と運動学習を測定するテストで、回転する水平の棒の上にマウスやラットなどの動物を乗せて徐々に棒の回転速度を上げ、動物が落下するまでの時間を測定する。
8.足跡分析
歩行の異常を検出する目的で、前脚と後脚に違う色のインクをつけ、その足跡を解析することで歩行の異常を確認する。
共同研究チーム
理化学研究所 開拓研究本部 鈴木糖鎖代謝生化学研究室
テクニカルスタッフ 藤縄 玲子(ふじなわ れいこ)
研究員 平山 弘人(ひらやま ひろと)
主任研究員 鈴木 匡(すずき ただし)
武田薬品工業 T-CiRAディスカバリー
主任研究員 朝比奈 誠(あさひな まこと)
主席研究員 兎澤 隆一(とざわ りゅういち)
ヘッド 梶井 靖(かじい やすし)
研究支援
本研究は、京都大学iPS細胞研究所(CiRA)と武田薬品工業の共同研究プログラム「Takeda-CiRA Joint Program for iPS Cell Applications(T-CiRA)(ディレクター:山中 伸弥 京都大学iPS細胞研究所所長・教授)」の「NGLY1 Deficiency Project (iPS細胞を利用した遺伝性の稀少疾患に対する治療薬の開発研究)(PI:鈴木匡)」による支援を受けて行われました。
原論文情報
Makoto Asahina, Reiko Fujinawa, Hiroto Hirayama, Ryuichi Tozawa, Yasushi Kajii and Tadashi Suzuki, “Reversibility of motor dysfunction in the rat model of NGLY1 deficiency”, Molecular Brain, 10.1186/s13041-021-00806-6
発表者
理化学研究所
開拓研究本部 鈴木糖鎖代謝生化学研究室
テクニカルスタッフ 藤縄 玲子(ふじなわ れいこ)
主任研究員 鈴木 匡(すずき ただし)
武田薬品工業 T-CiRAディスカバリー
主任研究員 朝比奈 誠(あさひな まこと)
報道担当
理化学研究所 広報室 報道担当
武田薬品工業 リサーチT-CiRAディスカバリー