発生と再生に共通する気道組織幹細胞の増殖制御メカニズム
2021-06-15 理化学研究所
理化学研究所(理研)生命機能科学研究センター呼吸器形成研究チームの清川寛文研究員、森本充チームリーダー、生体モデル開発チームの阿部高也研究員らの研究チームは、マウス胎児の気管[1]上皮[2]の発生過程における細胞増殖と、生後の気管上皮の再生過程における細胞増殖が、共通の分子機構で制御されていることを発見しました。
本研究成果は、気道[1]上皮の組織幹細胞(基底細胞[3])が組織の損傷に応答して増殖するメカニズムの基本原理の理解に加え、基底細胞の過剰な増殖によって生じる肺扁平上皮がん[4]の病態理解につながるものと期待できます。
鼻・口と肺を結ぶ気道の上皮細胞[2]は、呼吸のたびに空気中に含まれるさまざまな有害物質により傷つけられます。気道上皮の基底細胞は、損傷に応じて増殖し、正常な細胞を補うことで組織の再生に寄与する一方、過剰な増殖は細胞のがん化につながるため、基底細胞の増殖は厳密に制御される必要があります。
今回、研究チームは、胎児期マウスの気管上皮細胞で発現する遺伝子を1細胞レベルで解析し、未分化な気管上皮細胞の増殖を活性化する因子としてId2遺伝子[5]を見いだしました。Id2遺伝子の発現は発生のある段階で減弱し、それが上皮細胞の増殖低下と基底細胞の分化につながっており、成体マウスの気道上皮細胞の再生時にはId2遺伝子が再活性化し、基底細胞の増殖を促していました。これらのId2遺伝子の発現制御にはいずれも、間充織細胞[6]から分泌されるTgfβ[7]が関与していました。さらに、Id2遺伝子の過剰な発現は、前がん状態である基底細胞の過形成と関連していることも分かりました。
本研究は、科学雑誌『Developmental Cell』(7月12日号)の掲載に先立ち、オンライン版(6月14日付:日本時間6月15日)に掲載されます。
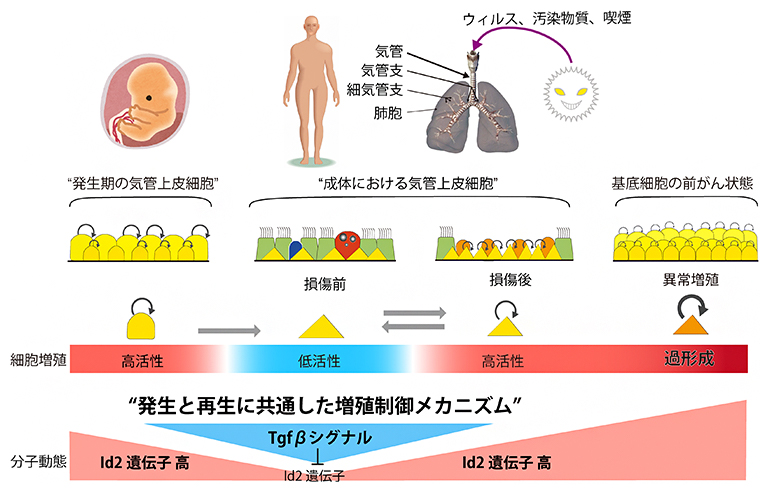
マウス気管上皮細胞の発生と再生に共通する分子メカニズム
背景
生命の維持に必須な酸素は、鼻や口から体内に取り込まれ、気道を通ってガス交換が行われる肺胞[1]に到達します(図1左)。呼吸をすると、酸素とともにウイルスなどを含む有害物質までも無意識に吸い込んでしまうため、外気に曝される気道の上皮細胞は、呼吸のたびに傷つけられています。しかし、気道上皮を構成する細胞の一つである基底細胞が損傷に応じて増殖し、正常な細胞を補うことで組織の再生を担っています。このように、基底細胞は気道上皮の組織幹細胞として重要な役割を果たしますが、一方で、基底細胞の過剰な増殖は難治性疾患である肺扁平上皮がんの原因となり得ることが知られています。そのため、基底細胞の増殖メカニズムを理解することは、上皮再生といった重要な生命現象だけでなく、がんなど細胞の病的状態の深い理解につながる必須の課題といえます。
基底細胞の組織幹細胞としての性質は、胎児期に確立すると考えられてきましたが、未分化な気道上皮前駆細胞から基底細胞が生まれる過程の詳細はこれまで不明でした。胎児期の上皮前駆細胞は、活発に増殖することで臓器の形成と成長に寄与しますが、上皮前駆細胞の増殖はある段階で低下し、基底細胞として分化し、組織幹細胞としての個性を獲得します(図1右)。
しかしこれまで、組織幹細胞の細胞増殖がさまざまなライフステージを通じてどのように制御されているのか、そのメカニズムは明らかにされていませんでした。研究チームは、この過程をマウス胎児の気管上皮前駆細胞を1細胞レベルという高い解像度で解析することで、細胞増殖が低下し組織幹細胞が生まれる瞬間に関与するメカニズムに迫りました。
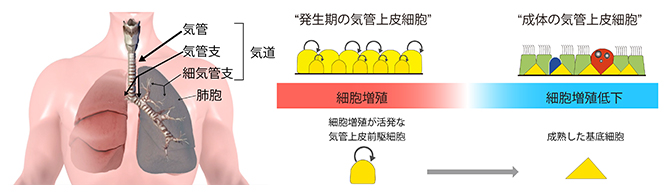
図1 ヒト呼吸器と胎児の気管上皮における基底細胞の出現過程の模式図
左)ヒト成人の呼吸器。鼻や口から取り込まれた空気は1本の気管から左右に分岐した気管支を通って、肺に入る。気管支はさらに細気管支に分岐し、肺胞に達する。
右)胎児と成体の気道上皮の模式図。発生初期の胎児では、未分化な上皮前駆細胞が盛んに増殖し、気道の形成と成長に寄与する。その後、上皮前駆細胞の細胞増殖は低下し、分泌細胞や組織幹細胞である基底細胞としての個性を獲得(分化)する。
研究手法と成果
研究チームは、細胞増殖が緻密に制御されている胎児期の気管上皮前駆細胞に着目し、解析を行いました。その結果、マウスの気管上皮の発生過程では、細胞増殖が受精後(胎生)14.5日で急激に低下することを発見しました(図2a)。
マウス胎児期に見られる細胞増殖の急激な低下がどのようなメカニズムで制御するかを調べるため、胎生12.5~18.5日の上皮細胞を採取し、シングルセルシークエンス[8]と呼ばれる1細胞レベルでの網羅的な遺伝子発現解析を行いました。その結果、細胞増殖の盛んな胎生14.5日までは発現が高く、その後細胞増殖の低下と一致して発現が低下するId2という遺伝子を突き止めました(図2b)。
Id2遺伝子が気道上皮細胞の増殖を促進し、基底細胞への分化を阻害する因子であるか否かを証明するため、Id2遺伝子を欠損した遺伝子改変マウスの胎児を解析しました。すると、Id2遺伝子欠損マウスでは、気管上皮の細胞増殖が早期に低下するとともに、基底細胞への分化が早まることが分かりました(図2c)。これらの結果から、Id2遺伝子が気管上皮細胞の増殖と基底細胞への分化の中心的な制御因子であることが示されました。
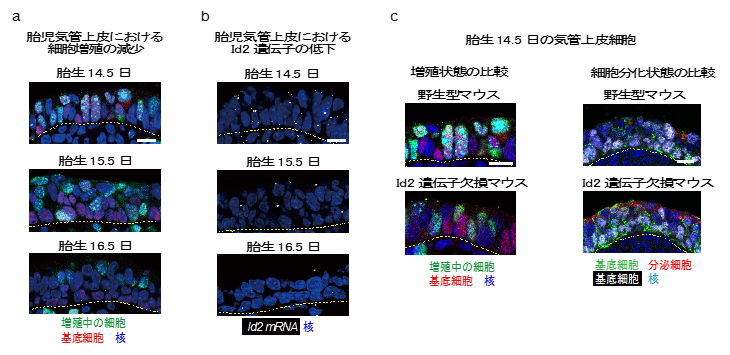
図2 マウス気管上皮細胞における細胞増殖とId2遺伝子の関係
a)マウス胎児気管上皮の細胞増殖の様子。波線で示した基底膜より上部の細胞層が上皮組織、下部が間充織。全ての細胞の核を青色で染色している。胎生14.5日以降に、増殖中の細胞(緑)の割合が減少していた。
b)気道上皮におけるId2遺伝子の発現変化。白のドットは転写されたId2遺伝子のmRNA分子を示す。胎生14.5日以降にId2遺伝子の発現が低下していた。
c)Id2遺伝子欠損マウスは、野生型マウスと比べて気道上皮細胞の増殖(緑)が胎生14.5日で既に大きく低下していた(左)。また、基底細胞の出現を2種類のマーカー遺伝子で検出(緑と白)したところ、Id2遺伝子欠損マウスでは基底細胞の分化が早まっていることが確認された(右)。
※スケールバーはいずれも5マイクロメートル(μm、1μmは1,000分の1mm)。
次に、Id2遺伝子の発現が低下する仕組みを解明するため、Id2遺伝子の抑制因子として知られる分泌タンパク質Tgfβに着目しました。気管発生過程でのTgfβの発現を調べたところ、上皮細胞を裏打ちする間充織細胞で胎生14.5日に強く発現していました(図3a)。間充織細胞から分泌されたTgfβが上皮細胞に作用し、Id2遺伝子の発現を抑制している可能性を検証するため、上皮細胞特異的にTgfβ受容体が作られなくなる遺伝子欠損マウス(Tgfβ受容体欠損上皮マウス)を作製しました。このマウスでは、胎生14.5日の上皮細胞でのId2遺伝子発現低下が起こらず、細胞増殖の亢進および基底細胞への分化阻害が認められました(図3b)。これらの結果から、間充織細胞から分泌されるTgfβが上皮細胞のId2遺伝子発現を調節し、胎生期における上皮の細胞増殖と分化を制御していることが示されました。
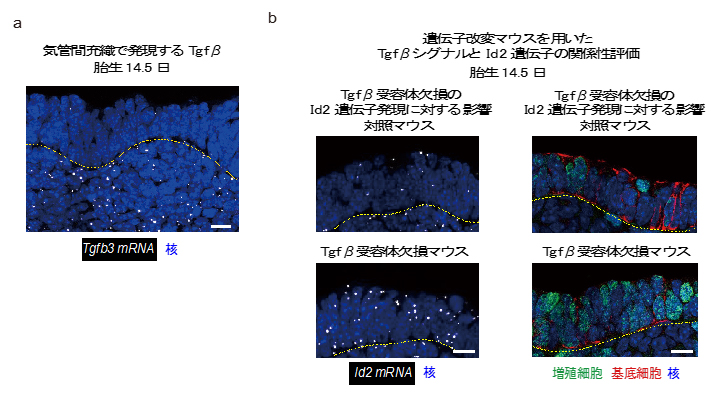
図3 マウス気管間充織細胞から分泌されるTgfβと上皮細胞のId2遺伝子の関係
a)胎生14.5日マウス胎児気道におけるTgfβの発現を、Tgfb3遺伝子から転写されるmRNA分子(白のドット)の検出により調べた。基底膜(波線)より下部の間充織細胞で、Tgfβが強く発現していることが示された。
b)上皮細胞特異的にTgfβ受容体が作られなくなる遺伝子欠損マウス(Tgfβ受容体欠損上皮マウス)では、上皮細胞でのId2遺伝子の発現は低下せず(左)、細胞増殖の亢進および基底細胞への分化阻害(右)が認められた。
※スケールバーはいずれも5μm。
さらに、マウス成体の成熟した組織幹細胞においても、Id2遺伝子の発現が基底細胞の増殖制御に寄与しているかを調べました。Id2遺伝子を過剰に発現する遺伝子改変マウス(Id2過剰発現マウス)を作製し、成体の気道上皮から分離した基底細胞の増殖能を三次元培養[9]を用いて評価したところ、野生型マウス由来の基底細胞と比べ高い増殖能が認められました(図4a)。これは、Id2遺伝子が成熟した基底細胞においても増殖を促進することを示しています。
個体レベルでも同様の現象が生じているかを調べるため、成体マウスを用いて気道傷害・再生の実験を行いました。組織再生とId2遺伝子発現の関係性について解析した結果、Id2遺伝子発現の増加は細胞増殖に先行していることが分かりました。また、Id2過剰発現マウスで同様に傷害・再生実験を行うと、傷害を受けてから細胞増殖に至るまでの時間が早まり、かつ基底細胞の過形成(過剰増殖状態)が認められました(図4b)。
最後に、これらの気道の再生過程においても、胎児期の気道上皮の細胞増殖と分化を制御するTgfβ-Id2の関係性が維持されているのかを検証しました。その結果、組織障害に応じて間充織細胞のTgfβの発現は低下し、Id2遺伝子発現の再上昇が生じていることが分かりました(図4c)。
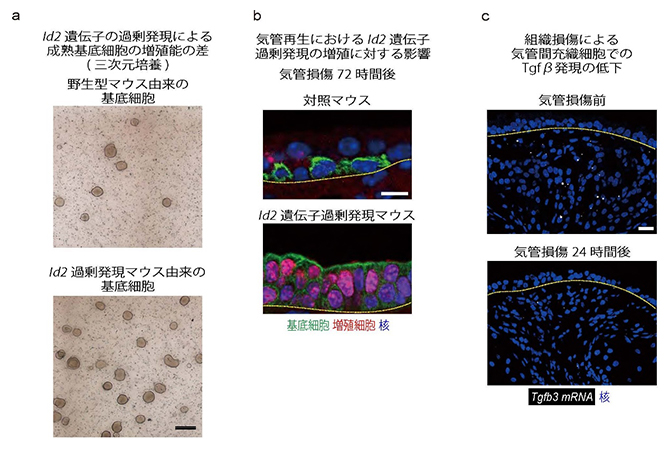
図4 成熟基底細胞でもTgfβ-Id2の関係性と増殖能の制御
a)成体の気道上皮から分離した基底細胞の三次元培養。増殖能が高いほど多くのコロニーを形成し、Id2過剰発現マウスの細胞は野生型細胞よりも高い増殖能を持つことが示された。スケールバーは300μm。
b)成体マウスの気道に実験的に損傷を与えて再生過程を観察した。Id2過剰発現マウスでは、基底細胞の過形成が観察された。スケールバーは5μm。
c)気道損傷前後のTgfβの発現変化。間充織細胞でのTgfb3 mRNA(白ドット)が気道損傷後に減少していることが示された。スケールバーは10μm。
さらに、Tgfβ受容体欠損上皮マウスに対して気道傷害・再生実験を行うと、Id2過剰発現マウスと同様の基底細胞過形成を起こしました。これらの結果は、組織再生時に見られる基底細胞のId2遺伝子発現の再上昇と、それに続く細胞増殖が、間充織細胞から分泌されるTgfβの低下により引き起こされることを示しています。また、過剰なId2遺伝子の発現は前がん状態である基底細胞の過形成につながるため、Id2遺伝子の厳格な発現制御が組織再生において必須であることが明らかになりました。
呼吸器の組織幹細胞の増殖制御メカニズムについて、胎児期から成体までのライフステージを跨いで調べた研究はこれまでありませんでした。今回の研究では、1細胞レベルの遺伝子発現解析と遺伝子改変マウスを用いることで、Tgfβ-Id2という制御機構が気管上皮の発生と再生に共通した組織幹細胞の増殖制御メカニズムであることを発見しました。
今後の期待
組織再生は生命体の健常な機能を維持するために必須な機構であり、組織幹細胞は組織再生において中心的な役割を果たす一方、さまざまな疾患の発症にも関わります。特に基底細胞は、本研究で示した気道以外でも、急性肺障害の際に肺胞領域において異常な増殖を示し、正常な組織の再生を妨げることが分かっています。また、呼吸器は新型コロナウイルス感染症(COVID-19)による損傷を受けやすい臓器ですが、気道上皮と肺胞領域の障害が関連することが最近報告されました注1)。そのため、今回の研究で見いだした増殖制御メカニズムの解明は、呼吸器が病的な状態に陥ることなく正常な組織再生を促進する治療法の開発につながるものと期待できます。
また、将来的にはこの知見を基底細胞の過剰増殖の抑制に応用し、難治性疾患である肺扁平上皮がんの克服を目指します。
注1)Chua RL, et.al., COVID-19 severity correlates with airway epithelium-immune cell interactions identified by single-cell analysis. Nat Biotechnol. 2020 Aug;38(8):970-979. doi: 10.1038/s41587-020-0602-4. Epub 2020 Jun 26. PMID: 32591762.
補足説明
1.気管、気道、肺胞
気道は呼吸器系を構成する器官の一つ。口・鼻からつながる気管、気管が左右に分岐した気管支、気管支がさらに分岐した細気管支から成り、酸素と二酸化炭素の交換の場である肺胞に達する。管状構造の気道と袋状構造の肺胞は、発生的には全て同じ起源である。本研究では、実験上の扱いやすさから最も太い気管を対象とした。
2.上皮、上皮細胞
上皮は、さまざまな器官の表面を覆い、隙間なく敷き詰められた細胞が作るシート状の構造。表皮のように二次元的に広がるものから、管を作るものまで多様である。外界から体内の構造を保護するバリア機能のほか、栄養分の吸収や生理活性物質の分泌など、外界との物質の交換に働く。上皮細胞は結合組織に裏打ちされ、基底膜上にほぼ隙間なく並ぶ。
3.基底細胞
気道上皮を構成する細胞の一種。成熟した上皮では基底膜に沿って存在し、組織幹細胞としての機能を持つ。
4.肺扁平上皮がん
肺がんの一種。扁平上皮がんとは、管腔臓器の内腔側の上皮から発生するがんを指し、肺では基底細胞を発生母地として気管支に発生することが多い。
5.Id2遺伝子
Idタンパク質は、皮膚や神経、筋肉の分化などを制御する塩基性ヘリックス・ループ・ヘリックス型の転写因子と結合し、その機能を抑制する。Idタンパク質をコードする遺伝子はId1、Id2、Id3、Id4の四つが見つかっており、気道上皮発生過程では、Id4以外が発現しており、特にId2が増殖細胞で強く発現していた。IdはInhibitor of differentiationの略。
6.間充織細胞
間充織は間葉とも呼ばれ、一般には疎性結合組織を指す。細胞同士が密着する上皮細胞と異なり、間充織細胞は大量の線維性細胞外マトリックスの中にまばらに存在する。
7.Tgfβ
細胞外に分泌され、組織発生・細胞分化・胚発生などにおいて重要な役割を果たす増殖因子。Tgfはtransforming growth factorの略。
8.シングルセルシークエンス
1細胞中に含まれるRNAを、ハイスループットDNAシーケンサーを用いて配列決定し、網羅的かつ定量的にその量や種類を決定する方法。
9.三次元培養
細胞や組織を、生体内の状況を模して立体的環境の中で培養する方法。
研究チーム
理化学研究所 生命機能科学研究センター
呼吸器形成研究チーム
チームリーダー 森本 充(もりもと みつる)
研究員 清川 寛文(きよかわ ひろふみ)
テクニカルスタッフ 山岡 玲(やまおか あきら)
テクニカルスタッフ 松岡 智沙(まつおか ちさ)
生体モデル開発チーム
研究員 阿部 高也(あべ たかや)
テクニカルスタッフ 德原 智子(とくはら ともこ)
研究支援
本研究は理化学研究所運営費交付金(生命機能科学研究)で実施し、一部は、日本学術振興会(JSPS)科学研究費補助金基盤研究(B)「1細胞解像度で知る気道の発生とヒト気道オルガノイド開発(研究代表者:森本充)」、同若手研究「発生期の増殖・分化制御因子(Id遺伝子)を利用した肺癌治療への新規アプローチ(研究代表者:清川寛文)」、理化学研究所基礎科学特別研究員制度「癌幹細胞と胎児期上皮幹細胞に共通する分子コンセプト提唱への挑戦(研究代表者:清川寛文)」、RIKEN BDR-大塚製薬ファンド”架け橋”による支援を受けて行われました。
原論文情報
Hirofumi Kiyokawa, Akira Yamaoka, Chisa Matsuoka, Tomoko Tokuhara, Takaya Abe, Mitsuru Morimoto, “Airway basal stem cells reutilize the embryonic proliferation regulator, Tgfβ-Id2 axis, for tissue regeneration”, Developmental Cell, 10.1016/j.devcel.2021.05.016
発表者
理化学研究所
生命機能科学研究センター 呼吸器形成研究チーム
研究員 清川 寛文(きよかわ ひろふみ)
チームリーダー 森本 充(もりもと みつる)
生体モデル開発チーム
研究員 阿部 高也(あべ たかや)
報道担当
理化学研究所 広報室 報道担当