左向きの水流に応答したRNA結合タンパク質と分解酵素の働き
2021-07-30 理化学研究所,スイス連邦工科大学,京都大学iPS細胞研究所
理化学研究所(理研)生命機能科学研究センター個体パターニング研究チームの濱田博司チームリーダー、峰岸かつら研究員(研究当時、現客員研究員)、スイス連邦工科大学ローザンヌ校のダニエル B. コンスタム教授、京都大学iPS細胞研究所(CiRA)の齊藤博英教授、小松リチャード馨大学院生(研究当時)らの国際共同研究グループは、動物の体の左右非対称性を決定する仕組みにおいて、初期胚が生み出す体液の流れに応答して、体の左側だけでメッセンジャーRNA(mRNA)[1]が分解されるメカニズムを解明しました。
内臓の形や配置など、私たちの体内構造に見られる左右非対称性は、胚発生の初期に現れる「ノード[2]」と呼ばれる凹んだ組織で決定されます。ノード中心部の細胞群には、時計回りに回転する繊毛[3]が存在し、ノード内に左向きの水流を作り出す結果、ノード周縁部の左右両側で発現していたDand5遺伝子[4]のmRNA(Dand5 mRNA)が左側特異的に分解されます。これにより、水流という機械的刺激が左右非対称な遺伝子発現へと変換されます。しかし、どのような機構で水流依存的にDand5 mRNAが分解されるかは不明でした。
今回、国際共同研究グループは、トランスジェニックマウス[5]胚を用いて、Dand5 mRNAの分解を可視化する実験系を確立しました。解析の結果、Dand5 mRNAの3’非翻訳領域(3′-UTR)[1]内に進化的に保存されたGACに富む配列モチーフが存在し、RNA結合タンパク質Bicc1がこれを特異的に認識してmRNA分解酵素Ccr4-Not複合体を呼び込み、Dand5 mRNAが分解されることが明らかになりました。
本研究は、科学雑誌『Nature Communications』(2021年7月1日付)に掲載されました。
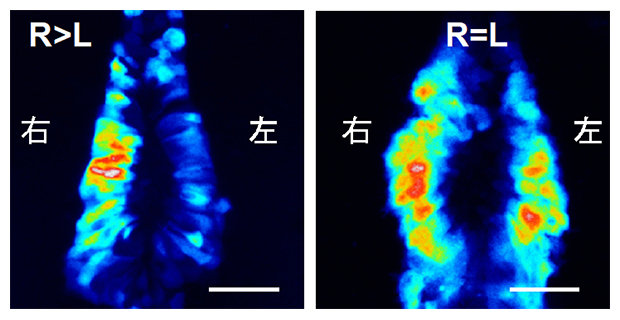
Dand5 mRNAの左側特異的な分解(左)は、3′-UTRに欠損が生じると観察されなくなる
背景
ヒトやマウスなどの哺乳類は、外観は左右対称のように見えますが、心臓や肺、肝臓など、ほとんどの臓器の形や配置は左右非対称です。この左右非対称性は、発生の段階で初期胚(マウスの場合、受精後7.5日)の腹側に一時的に形成される「ノード」と呼ばれる凹んだ組織において決まります。
ノードの細胞には、動く繊毛と動かない繊毛の2種類が存在しています。動く繊毛はノード中心部の細胞群に存在し、時計回りに回転して周りの体液を動かすことで、ノード内に左向きの水流を作り出します。一方、動かない繊毛はノードの脇に位置する細胞群(クラウン細胞)に存在し、水流を感知するとカルシウムチャネル[6]を開いて繊毛内にカルシウムイオン(カルシウム)を流入させます(図1)。
クラウン細胞は左右対称に分布していますが、左向きの水流はノード左側のクラウン細胞の繊毛で感知されます。この結果、ノード周縁部の左右両側で発現していたDand5と呼ばれる遺伝子のメッセンジャーRNA(Dand5 mRNA)が、ノードの左側で特異的に分解されます。この左側特異的なmRNAの分解により、水流という機械的刺激が左右非対称な遺伝子発現へと変換される仕組みと考えられています。しかし、どのような機構で水流依存的にDand5 mRNAが分解されるかは不明のままでした。
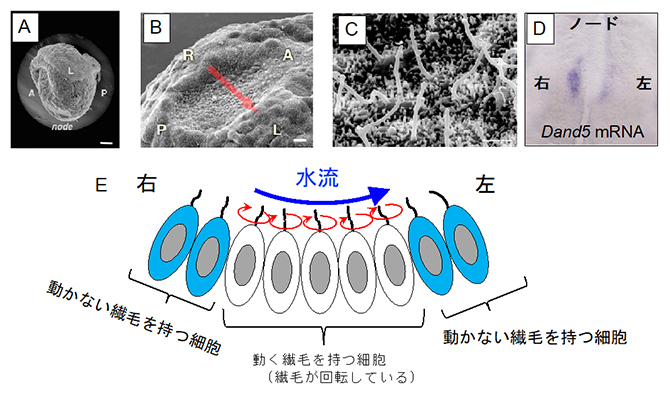
図1 マウス初期胚におけるノードの構造と水流の発生の仕組み
(A)マウス受精後8日目胚を左側面からみた電子顕微鏡写真※。
スケールバーは100マイクロメートル(μm、1μmは1,000分の1mm)。
(B)ノードを腹側から捉えた電子顕微鏡写真※。スケールバーは10μm。
(C)ノードにおける繊毛の電子顕微鏡写真※。スケールバーは1μm。
(D)ノードにおける左右非対称なDand5 mRNAのパターン。
(E)ノードには、動く繊毛と動かない繊毛の2種類が存在する。ノード中央の細胞の繊毛が斜めに回転運動をすることで、周りの体液を左方向へ動かし、水流を発生させる。この流れは、ノード周縁部のクラウン細胞の動かない繊毛により感知される。
※出典)Shiratori, H.; Hamada, H. The left-right axis in the mouse: From origin to morphology. Development 133, 2095-2104 (2006).
mRNAには、タンパク質をコードする配列のほかに、mRNAの翻訳効率や安定性に影響する非翻訳領域(UTR)という配列が5’末端側や3’末端側に存在します。過去の報告から、左右非対称なDand5 mRNAの局在にはDand5の3’末端側非翻訳領域(3′-UTR)が必要であることが知られていました。国際共同研究グループは、Dand5 mRNAの3′-UTRが左右非対称なmRNAの分解を誘導していると考え、ノードでのDand5 mRNAの分解の有無を可視化する実験系を確立して解析しました。
研究手法と成果
国際共同研究グループはまず、マウス初期胚でのDand5 mRNA分解を蛍光顕微鏡で観察するため、蛍光タンパク質の一種destabilized Venus (dsVenus)[7]の遺伝子配列とDand5 3′-UTRの遺伝子配列が融合した組換え遺伝子を構築しました。これにより、蛍光タンパク質の発現を通じて、Dand5 mRNAの分解の有無を可視化できます。この組換え遺伝子を導入したトランスジェニックマウス胚を作製し、野生型マウスや、左右性に表現型が現れるいくつかの変異体で、クラウン細胞における左右非対称なDand5 mRNAの分解パターンがどのように変化するかを検証しました。
このトランスジェニックマウス胚は、Dand5 mRNAの3′-UTR依存的な分解が起きた場合にのみ、蛍光タンパク質の発現が減少するという設計になっています。野生型トランスジェニックマウスの初期胚では、発生段階の初期では蛍光が左右対称に観察されましたが、発生が進み内在性のDand5 mRNAの左右非対称性が始まる時期になると、左側の蛍光が著しく減少しました(図2A)。これにより、Dand5 mRNAの3′-UTRがノードの左側のmRNAの分解を誘導するに十分であることが示されました。
次に、このmRNAの分解がノードにおける水流によって制御されているかどうかを調べるために、繊毛の機能異常のためノードでの水流が生じないiv/iv変異体[8]トランスジェニックマウス胚での蛍光パターンを観察しました。すると、蛍光は全ての胚で左右対称に観察されました。これらの結果から、マウスの初期胚では、ノードにおける水流刺激がDand5 mRNAの3′-UTR依存的にmRNAの分解を誘導することが明らかになりました。(図2B)。
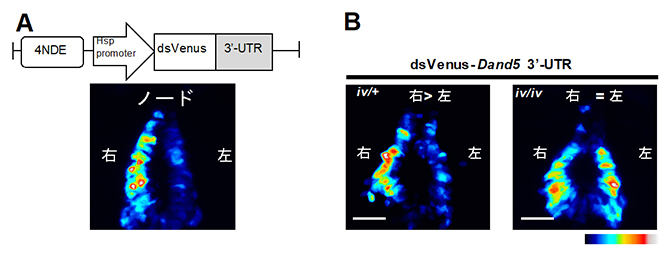
図2 蛍光タンパク質の配列とDand5 mRNA の3′-UTRを融合したmRNAを発現するトランスジェニックマウス胚
(A)トランスジェニックマウス胚の作製に用いた組換え遺伝子の模式図。クラウン細胞での発現に必要な配列(4NDE)と転写開始に必要な配列(Hsp promoter)の下流に、蛍光タンパク質ds Venusのコード領域と、Dand5の3’非翻訳領域(3′-UTR)を融合させた。dsVenusは、蛍光タンパク質Venusの不安定な変異体(destabilized Venus)であり、mRNAが分解されると、速やかに蛍光も減衰する。
(B)水流を生じないiv/iv変異体でのdsVenusの蛍光パターン。iv変異は潜性であるため、ヘテロ変異体(iv/+)でのパターンは野生型と変わらないが(左)、ホモ変異体(iv/iv)では左右対称になった(右)。スケールバーは50μm。
次に、水流刺激を細胞内に伝える役割を担うとされるカルシウムチャネルが、3′-UTR依存的なmRNAの分解に関与しているかを調べました。水流による刺激はノードの動かない繊毛で感知され、その繊毛に発現しているカルシウムチャネルが水流刺激依存的にカルシウムの細胞内への流入をもたらし、このカルシウムの流入が細胞内にシグナルを伝えていると考えられています。そこで、カルシウムチャネルが機能しない変異体でトランスジェニックマウス胚を作製したところ、ノードの左右において左右対称な蛍光が観察されました。これにより、Dand5 mRNAの3′-UTRはカルシウムチャネルを介して水流に反応していることが示されました。
上記の結果から、Dand5 mRNAの3′-UTRが水流依存的なmRNAの分解に十分であることが分かりました。3′-UTRは約1,200塩基もある長大な配列ですが、この中のどの配列が重要かをさらに詳しく調べるため、まず、さまざまな哺乳類のDand5遺伝子間で3′-UTRに相当するDNA配列を比較しました。その結果、5’末端から200塩基の領域が進化的によく保存されていることが分かりました。この配列が左右非対称な遺伝子発現に必要かどうかを調べるために、3′-UTRからこの領域を削除した配列を用いたトランスジェニックマウス胚を作製しました。このマウスの初期胚では、左右対称な蛍光パターンが得られたことから、Dand5 3′-UTRの5’末端から200塩基の領域が水流依存的なDand5 mRNAの分解に重要であることが示唆されました。
次に、Dand5遺伝子からこの200塩基の領域のみを欠損させた部分的な遺伝子欠損マウスを作製し、その左右非対称性への影響を検証しました。野生型の胚では発生過程において、Nodal[9]と呼ばれる遺伝子が左側の側板中胚葉[10]に特異的に発現します。ところが200塩基欠損マウス胚では、この発現が左右両方で消失していました(図3)。このことから、この200塩基がDand5 mRNAの水流依存的な左側での分解を通じて、下流の左右非対称な遺伝子発現をもたらしていることが確認できました。
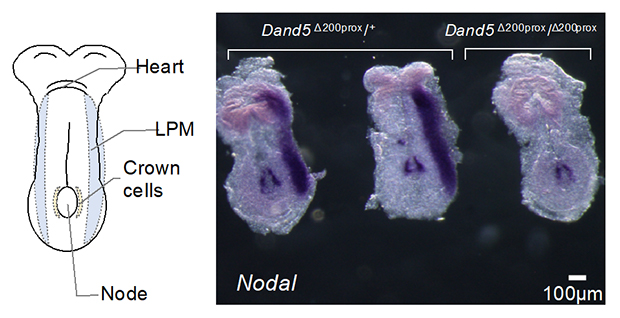
図3 Dand5 mRNA 3′-UTRの5’末端200塩基に依存するNodal遺伝子の左側特異的な発現
Nodal mRNAは、ノードでは左右対照に発現するが、側板中胚葉(LPM)では左側のみに発現する。Dand5 3′-UTR の5’末端200塩基の領域を欠損させたDand5Δ200prox/ Δ200proxマウス胚では、左側LPMのNodal mRNAの発現は消失した。
さらに、Dand5 mRNAの3′-UTRを介して、どのようにしてmRNAが分解されるのかを検証しました。マウス胚のノードで特異的に発現するRNA結合タンパク質Bicc1[11]に着目し、Bicc1 遺伝子の変異胚でmRNAの分解に影響が見られるかを調べました。Bicc1遺伝子変異体の胚では、ノード内の水流自体に異常が見られることが以前から知られていたため、人工的に左向きの流れを胚に与えた状態で観察したところ、左向きの水流があるにもかかわらず、ノードの左右において対称な蛍光が観察されました。これにより、水流応答性のDand5 mRNAの分解にはBicc1遺伝子の機能が必要とされることが示されました。また生化学的な手法により、Bicc1タンパク質がDand5 3′-UTRの200塩基領域に直接結合することも確認できました。
Bicc1タンパク質がDand5 mRNAの3′-UTRの200塩基領域にどのように結合しているかを詳細に調べるため、Bicc1が認識して結合する配列を、次のような実験で探索しました。まず20塩基のさまざまな配列を持つRNA断片を合成し、その中からBicc1タンパク質と結合するRNAだけを選択し、それらの特徴を解析しました。その結果、Bicc1タンパク質に結合したRNAにはGACを含むモチーフが高頻度で含まれていることが明らかになりました。これらの配列はDand5 mRNAの3′-UTRにおける200塩基の領域にも有意に高い割合で存在しており、特に、UGAC、CGAC、GACA、GACGというGACを共通に持つ配列が多く含まれていました(図4)。さらなる解析と生化学実験により、Dand5の200塩基領域の中でもGACGUGACというGACモチーフが二つ連なる配列がBicc1タンパク質に対する強い結合能を持つことが分かりました。
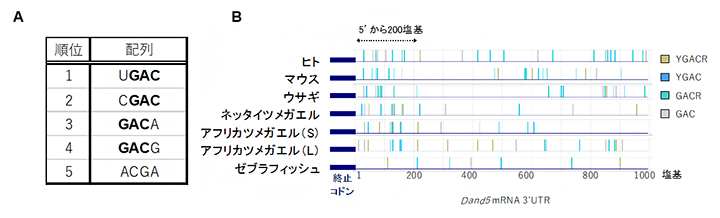
図4 Bicc1の結合配列とDand5 mRNAの3′-UTRの配列比較
(A)ランダムなRNAライブラリから見出された、Bicc1に結合したRNAの配列的特徴。GACを含むモチーフが上位に来た。
(B)さまざまな脊椎動物のDand5 mRNAの3′-UTR全域に渡って、GACモチーフを検索した図。5’末端から200塩基の領域にBicc1結合モチーフが高頻度に存在していた。RNAモチーフ配列のYはUまたはCを、RはAまたはGを意味する。なおアフリカツメガエルは2種の異種交配で成立したと考えられており、それぞれの祖先ゲノムに由来する遺伝子をLとSで区別する。
真核生物に共通したmRNA分解酵素として、複数のタンパク質で構成されるCcr4-Not複合体[12]が知られています。ショウジョウバエでは、Bicc1に相当するタンパク質がCcr4-Not複合体をmRNAにリクルートすることで、mRNAの分解を制御しています。このことから、マウス胚においてもBicc1タンパク質がCcr4-Not複合体を介してmRNAの分解を制御しているのではないかと考えられました。
そこでマウス胚のノードにおいてBicc1タンパク質と、Ccr4-Not複合体の構成要素であるCnot3[12]タンパク質の免疫蛍光染色を行ったところ、これらがクラウン細胞で共局在していることが分かりました。また、ヒト培養細胞を用いた実験からも、Bicc1はCcr4-Not複合体をmRNAへリクルートしていることが示唆されました。さらに、Cnot3がノードの細胞におけるDand5 mRNAの分解に寄与しているかどうかを調べるために、Cnot3遺伝子を欠損させたマウスでトランスジェニックマウス胚を作製したところ、ノードにおける左右非対称な蛍光が抑制されていました。これらの結果は、Ccr4-Not複合体が、水流依存的なDand5 mRNAの分解に関与していることを示唆しています。
今後の期待
マウスの初期胚において最初期に見られる左右非対称性は、ノードにおけるDand5 mRNAの左右非対称な分布です。この左右非対称な分布は、Dand5 mRNAが左右両側で転写された後に、ノードのクラウン細胞の左側特異的に分解されることによって生じると考えられています。本研究では、このmRNAの分解にDand5 3′-UTRの領域の200塩基が重要であることを明らかにしました。さらに、この200塩基に存在するGACモチーフにRNA結合タンパク質Bicc1が結合することを突き止め、Bicc1タンパク質がmRNA分解酵素Ccr4-Not複合体をリクルートすることでmRNAが分解されることが強く示唆されました(図5)。
また、Dand5 mRNAの左側特異的な分解には、ノードの動かない繊毛が持つカルシウムチャネルが必要でした。このことから、水流という機械的刺激がカルシウムチャネルに感知され、カルシウムの細胞内流入によりmRNAの分解が誘導されると考えられます。しかし、Dand5 mRNAの分解の制御における細胞内でのカルシウムの役割についてはまだ解明できておらず、引き続き研究が必要だと考えています。
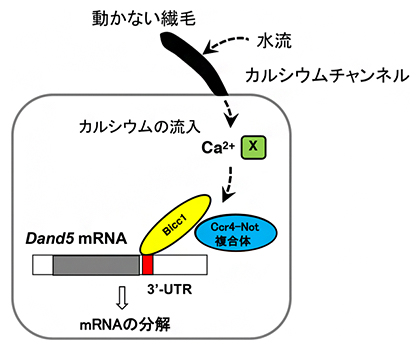
図5 ノード左側のクラウン細胞でDand5 mRNAが分解される仕組み
クラウン細胞にある動かない繊毛に水流が当たると、カルシウムチャネルによりカルシウムが細胞内に流入する。この結果、Dand5 mRNAの3’UTR 200塩基に結合するBicc1タンパク質を介してCcr4-Not複合体が呼び込まれ、mRNAが分解する。カルシウムがこの過程を制御する機構(X)はまだ不明である。
補足説明
1.メッセンジャーRNA(mRNA)、3’非翻訳領域(3′-UTR)
メッセンジャーRNA(mRNA)は、タンパク質の配列情報を持つRNA。真核生物では、DNAから転写された直後のRNAに含まれるタンパク質情報を持たない配列(イントロン)を除去して、成熟したmRNAが作られる。ただし、最終的なmRNAはタンパク質の配列情報だけで構成されるわけではなく、5’末端側には翻訳のために必要な配列、3’末端側にはmRNAの安定に関わる配列などがあり、これらをそれぞれ5’非翻訳領域(5′-UTR)、3’非翻訳領域(3′-UTR)と呼ぶ。UTRはUntranslated regionの略。
2.ノード
哺乳類において左右対称性が破られる胚の部位。胚の腹側に一過的に現れ、くぼみのような外見を持つ。
3.繊毛
細胞から突出する微小管を含む構造(オルガネラ)。繊毛には動くもの(動繊毛)と動かないもの(不動繊毛)があり、前者には、気道上皮・脳室上衣の繊毛や精子の鞭毛がある。後者は体の中のほとんどの細胞に見られ、細胞外からの種々のシグナルを感知する役割を持つ。
4.Dand5遺伝子
ノードで発現する分泌タンパク質Dand5をコードする遺伝子。ノード流に反応して最も初期に左右非対称な発現を示す。Dand5はDAN Domain BMP Antagonist Family Member 5の略。
5.トランスジェニックマウス
広義では何らかの遺伝子改変を持つマウスであるが、通常は狭義で用いられ、人工的な操作により外来性の遺伝子がゲノム中に挿入されたマウスを意味する。
6.カルシウムチャネル
生体膜を隔てたイオンの濃度差を調節する分子のうち、カルシウムイオンを濃度勾配に従って受動的に透過させるもの。ノードの動かない繊毛には、Pkd2と呼ばれるカルシウムチャネルが発現している。
7.destabilized Venus(dsVenus)
Venusは、オワンクラゲ由来の緑色蛍光タンパク質(GFP:Green Fluorescent Protein)をもとにして作られた蛍光タンパク質の一種。従来のGFPよりも3~100倍の明るさを持ち、またタンパク質が作られてから蛍光を発するまでの時間も短いため、遺伝子の活性化を反映する「レポーター」としてよく用いられる。dsVenusは、Venusを改変してタンパク質の安定性を低下させたもので、細胞に蓄積されないため、mRNAからのタンパク質合成が止まると蛍光シグナルが観察されなくなる。
8.iv/iv変異体
内臓の配置が左右正常な個体と左右逆になった個体が1:1の割合で生まれるマウスの変異体。モータータンパク質ダイニンの欠失により、動繊毛の回転運動が起こらなくなり、ノード流が失われたことが原因とされる。
9.Nodal
Nodalは、細胞間シグナル伝達に関わるタンパク質の一つであるTGF-βファミリーに属し、細胞から分泌され、特定の受容体を介して他の細胞に情報を伝える働きをするタンパク質。マウスでは、左右の対称性が破れる際、Nodal遺伝子はまずノードで発現し、その後、ノードでつくられた左右非対称な情報により左側の側板中胚葉でのみ発現する。
10.側板中胚葉
胚の周辺部に左右両側性に見られる中胚葉。やがて、さまざまな腹腔内臓器の間質を形成する。
11.Bicc1
mRNAの転写後調節に関わるRNA結合タンパク質の一種。ショウジョウバエの発生変異体Bicaudal Cの原因遺伝子として同定され、その後線虫や哺乳類でも見つかった。KHドメインと呼ばれるRNA結合部位を持つ。
12.Ccr4-Not複合体、Cnot3
Ccr4-Not複合体は、mRNAの3′-UTRの下流にあるポリA鎖からmRNAを分解する活性を持つタンパク質複合体。Cnot3はマウスCcr4-Not複合体を構成するサブユニットの一つで、ショウジョウバエのNot3に相当する。ショウジョウバエでは、Bicaudal Cタンパク質とNot3が結合し、Ccr4-Not複合体をmRNAにリクルートすることが分かっている。Ccr4-Notはcarbon catabolite repressor 4 – negative on TATAの略。
国際共同研究グループ
理化学研究所 生命機能科学研究センター
個体パターニング研究チーム
チームリーダー 濱田 博司(はまだ ひろし)
研究員(研究当時) 峰岸 かつら(みねぎし かつら)
(現 客員研究員、国立精神・神経医療研究センター 神経研究所 リサーチフェロー)
研究員 加藤 孝信(かとう たかのぶ)
テクニカルスタッフⅠ 井川 弥生(いかわ やよい)
テクニカルスタッフⅠ 西村 博美(にしむら ひろみ)
テクニカルスタッフⅠ 梶川 絵理子(かじかわ えりこ)
テクニカルスタッフⅠ サイ ショウレイ(Cai XiaoRui)
生体モデル開発チーム
チームリーダー 清成 寛(きよなり ひろし)
テクニカルスタッフⅡ 坂東 可菜(ばんど うかな)
京都大学 iPS細胞研究所(CiRA) 未来生命科学開拓部門
教授 齊藤 博英(さいとう ひろひで)
博士課程学生(研究当時) 小松 リチャード 馨(こまつ リチャード かおる)
(現xFOREST Therapeutics 代表取締役CTO)
博士課程学生 小野 紘貴(おの ひろき)
修士課程学生 宮下 映見(みやした えみ)
スイス連邦工科大学(EPFL)
教授 ダニエル B. コンスタム(Daniel B. Constam)
研究員 ベンジャミン・ローテ(Benjamin Rothe)
徳島大学 先端酵素学研究所
准教授 高岡 勝吉(たかおか かつよし)
沖縄科学技術大学院大学 細胞シグナルユニット
教授 山本 雅(やまもと ただし)
研究支援
本研究は理化学研究所運営費交付金(生命機能科学研究)で実施し、一部は、科学技術振興機構(JST)戦略的創造研究推進事業CREST「生命動態の理解と制御のための基盤技術の創出(領域代表者:山本雅)、日本学術振興会(JSPS)科学研究費補助金基盤研究(A)「形態の非対称性の起源(研究代表者:濱田博司)」、同若手研究「水流に応答して左右非対称にmRNAが減衰する機構の解明(研究代表者:峰岸かつら)」、理研BDR -大塚製薬連携センター(COCC)公募プログラム「かけ橋(研究代表 峰岸かつら)」、加藤記念バイオサイエンス振興財団「加藤記念研究助成 (研究代表 峰岸かつら)」、科学研究費補助金基盤研究(S)「RNPナノシステムを活用した細胞プログラミング技術の創出(研究代表者:齊藤博英)」による支援を受けて行われました。
原論文情報
Katsura Minegishi#, Benjamin Rothé#, Kaoru R. Komatsu#, Hiroki Ono, Yayoi Ikawa, Hiromi Nishimura, Takanobu A. Katoh, Eriko Kajikawa, Xiaorei Sai, Emi Miyashita, Katsuyoshi Takaoka, Kana Bando, Hiroshi Kiyonari, Tadashi Yamamoto, Hirohide Saito*, Daniel B. Constam*, and Hiroshi Hamada*, “Fluid flow-induced left-right asymmetric decay of Dand5 mRNA in the mouse embryo requires a Bicc1-Ccr4 RNA degradation complex”, Nature Communications, 10.1038/s41467-021-24295-2
# 共同筆頭著者、* 責任著者
発表者
理化学研究所
生命機能科学研究センター 個体パターニング研究チーム
チームリーダー 濱田 博司(はまだ ひろし)
研究員(研究当時) 峰岸 かつら(みねぎし かつら)
(現 客員研究員、国立精神・神経医療研究センター 神経研究所 リサーチフェロー)
スイス連邦工科大学ローザンヌ校(EPFL)
教授 ダニエル B. コンスタム(Daniel B. Constam)
京都大学 iPS細胞研究所(CiRA) 未来生命科学開拓部門
教授 齊藤 博英(さいとう ひろひで)
大学院生(研究当時) 小松 リチャード 馨(こまつ リチャード かおる)
報道担当
理化学研究所 広報室 報道担当
京都大学 iPS細胞研究所(CiRA) 国際広報室
大内田 美沙紀(おおうちだ みさき)