2021-09-28 理化学研究所
理化学研究所(理研)計算科学研究センター粒子系生物物理研究チームの杉田 有治チームリーダー(開拓研究本部杉田理論分子科学研究室主任研究員)、小林千草技師、ジョン・ジェウン研究員(開拓研究本部杉田理論分子科学研究室専任技師)らの共同研究チームは、細胞内のカルシウムイオン輸送をつかさどるカルシウムイオンポンプによって、カルシウムイオンが小胞体[1]へ放出される過程を計算機シミュ―レーションを用いて計算し、カルシウムイオン輸送の分子機構を明らかにしました。
本研究で示した機構は、アデノシン三リン酸(ATP)[2]をエネルギー源として生体膜を介して輸送を行うタンパク質の多くに共通すると考えられます。生体内ではさまざまなイオンポンプが働いており、その機能不全が重篤な疾患の原因になります。イオン輸送の分子機構を詳細に理解することは創薬・医学の発展に貢献するものと期待できます。
今回、共同研究チームは、スーパーコンピュータ「Oakforest-PACS」[3]と「京」[4]を用いて、カルシウムイオンポンプ内に存在するカルシウムイオンが小胞体へ放出される過程について、分子動力学(MD)計算[5]を行いました。さらに、この過程におけるタンパク質の構造変化と周りの影響を計算し、膜分子やタンパク質内の過渡的な相互作用がこの過程の中間状態を安定化していることを発見しました。
現在、共同研究チームでは「富岳」の高い演算性能を利用してさまざまなイオンポンプのイオン輸送機構の解明を目指した研究を行っており、関連する疾患の解明や創薬に貢献していきます。
本研究は、科学雑誌『Proceeding of the National Academy of Sciences of the United States of America(PNAS)』オンライン版に近日中に掲載されます。
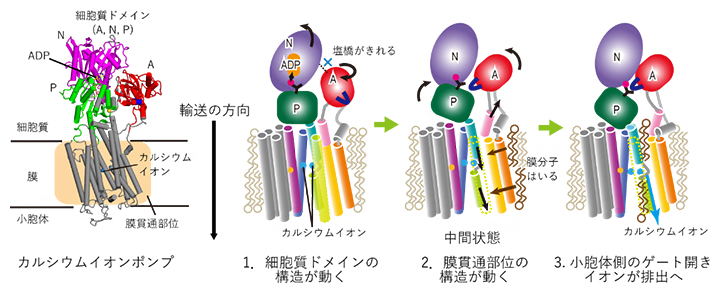
カルシウムイオンポンプにおけるイオン排出の分子機構
背景
ATPase(ATPアーゼ)は、アデノシン三リン酸(ATP)のリン酸結合を加水分解する酵素の総称であり、加水分解により得られる自由エネルギーを他の仕事に変換します。ATPaseはいくつかのグループに分けられるが、そのうち、P型ATPaseは生体膜内に存在し、加水分解のエネルギーを用いて膜内外へのイオンなどの輸送をつかさどるタンパク質です。P型ATPaseはあらゆる生物に存在しており、運動、代謝、伝達などの生命活動に重要な役割を果たしています。これらのタンパク質は、膜内外の大きな濃度差に逆らってさまざまなイオンを輸送していることが知られています。
代表的なP型ATPaseの一つであるカルシウムイオンポンプ(SERCA)は、筋細胞の小胞体膜に存在し、1万倍の濃度差に逆らってカルシウムイオンを小胞体内へ輸送します。この輸送により、細胞質内のカルシウムイオン濃度が調整され、筋肉が弛緩します。SERCAは、三つの細胞質側ドメイン[6](A、N、P)とヘリックス[7]からなる膜貫通部位に分けることができます(図1A)。アデノシン二リン酸(ADP)[2]やATPは細胞質ドメインのN、Pドメインの境界に、カルシウムイオンは膜貫通部位[8]の中央にそれぞれ結合します。2000年に最初のX線結晶構造解析[9]が行われて以来、さまざまな化学条件下における結晶構造が解明され、それらの構造には大きな違いがあることが分かりました。これらの実験研究から、カルシウムイオン輸送は複数のステップで起こること、SERCAの構造変化が重要な役割を果たすことが提唱されていました。
しかし、これらの過程でどのようにして構造変化が起きるのかを測定することは、実験的に困難だったため、詳細な分子機構は明らかにされていませんでした。特に、SERCAに結合していたADPが解離し、カルシウムイオンが小胞体内へ排出されるステップ(E1P状態からE2P状態)では、生化学実験より中間状態の存在が示されていましたが、その分子構造は解かれていませんでした(図1B)。
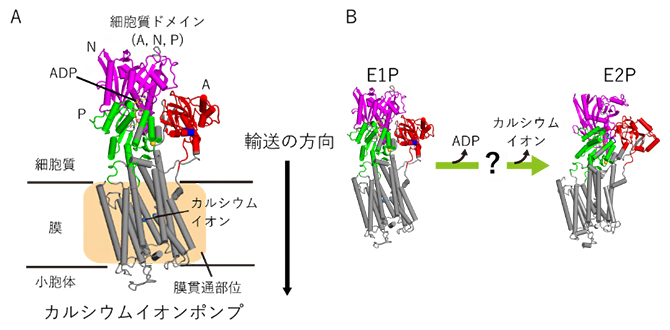
図1 カルシウムイオンポンプ(SERCA)の構造とE1P状態からE2P状態への変化
(A)カルシウムイオンポンプ(SERCA)は小胞体膜に存在する膜タンパク質であり、三つの細胞質ドメイン(A、N、P)とヘリックスからなる膜貫通部位に分けられる。カルシウムイオンを細胞質側から小胞体内へと輸送する。
(B)E1P状態からE2P状態への過程では、SERCA内に結合していたADPとカルシウムイオンが解離し、カルシウムイオンが小胞体内へ排出される。この過程には大きな構造変化が見られ、さらに生化学実験によって準安定な中間状態の存在が示唆されているが、詳細な分子構造は現時点で明らかにされていない。
研究手法と成果
共同研究チームは、SERCAに結合したカルシウムイオンが小胞体内へ排出されるE1P状態からE2P状態へのステップに着目し、それぞれの状態における分子動力学(MD)計算を行いました。さらに、二つの状態間をつなぐ経路を計算し、構造とエネルギーを解析しました。
これらの計算は、共同研究チームが開発している分子動力学計算ソフトウェアGENESISを用いました。GENESISは独自の高速・並列化手法を有しており、「京」や「富岳」などのスーパーコンピュータの性能を生かした大規模並列計算を可能にします。さらに、ストリング法をGENESISに導入しました。ストリング法は、イメージと呼ばれる初期経路に沿って異なる構造を持つシミュレーションシステムのレプリカを用意し、それぞれのレプリカに対して同時にMD計算を行うことで、二つの状態を結ぶ経路を探索する方法です(図2)。このような手法・ソフトウェアの開発と「京」の優れた演算能力を用いることにより、単体のMD計算では不可能な比較的大きな膜タンパク質のE1P状態とE2P状態間の経路の解析が可能となりました。
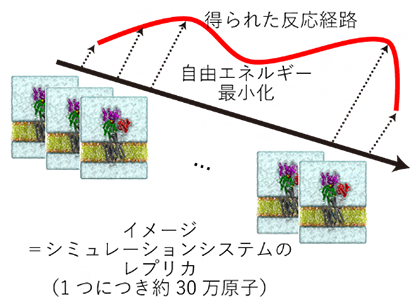
図2 本研究で用いたストリング法の概略
ストリング法はE1P状態とE2P状態をつなぐ経路を求める手法の一つ。計算方法としては、二つの状態をつなぐ異なる構造からなるレプリカ(イメージ)を用意し、同時に自由エネルギーを最小化することで経路全体を最適化する。本研究では最大64イメージを利用した。多くの計算機による並列計算が必要であるため、スーパーコンピュータなしでは実現しなかった研究である。
計算の結果、このステップの経路に沿ったSERCAの分子構造が明らかになり、五つのサブステップ(図で示しているのは三つのサブステップ)に分けられることが分かりました(図3)。最初のサブステップでは、ADPが解離することで細胞質ドメインのA-N間の塩橋[10]と呼ばれるイオン相互作用が切れ、構造変化が起きます。その後、Aドメインが回転し、Pドメインが傾くことによって、細胞質ドメインと膜貫通部位の間のループ[11]が引き上げられます。そのループの動きが、膜貫通部位のヘリックスの組み換えという形となって伝わり、最終的には膜貫通部位にあるカルシウムイオン結合部位の小胞体側のゲートを開放させることが明らかになりました。
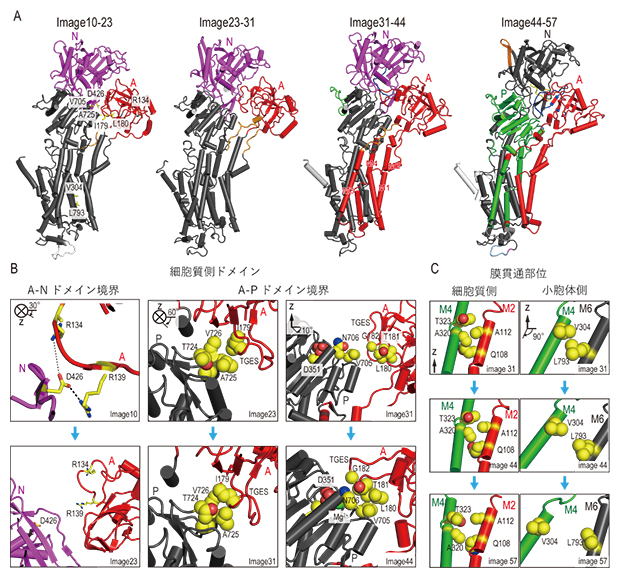
図3 SERCAのイオン排出過程での構造変化
(A)SERCAの経路上の代表的なイメージ(image10、23、31、44、57)間の構造変化を色で示した。同じ色の部分内では、ドメインとしてまとまった状態で配置が変化している。
(B)細胞質側ドメイン間の境界部分におけるイメージごとの相互作用を見たもの。左は、最初期においてA-Nドメイン間の塩橋(イオン相互作用)が切断されている。中央と右では、AドメインとPドメインの残基の間で疎水性相互作用が過渡的に形成される。
(C)左は、膜貫通部位の細胞質側においてM2、M4ヘリックスの間が開いている。右は、膜貫通部位の小胞体側においてカルシウムイオン結合部位の小胞体側ゲートであるM4、M6ヘリックスの間が開いている。
さらに、ステップの細胞質ドメインおよび膜貫通部位での原子間の相互作用を詳しく見ることで、これらの中間状態において細胞質ドメイン境界では疎水性相互作用[12]が、膜貫通部位では膜分子との相互作用が過渡的に形成され、それぞれの中間状態を安定化させていることも示しました(図4)。
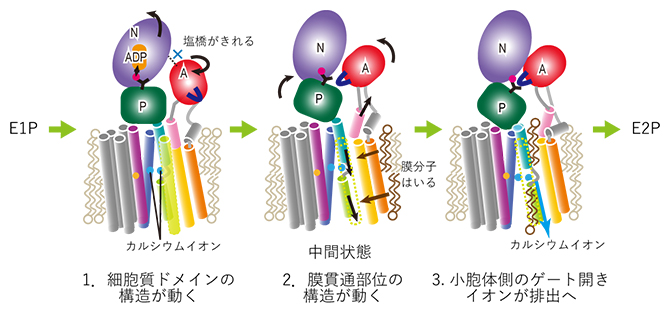
図4 カルシウムイオンポンプにおけるイオン排出の分子機構
今回の研究で明らかにした、SERCAのE1P-E2P状態間の小胞体排出における分子機構。最初のサブステップでA-Nドメイン間の相互作用が切れ、それによりA-Nドメインが回転し始める。2番目のサブステップでは、AドメインがPドメインと過渡的な疎水性相互作用を作ることにより、Pドメインが傾き、近くにある膜貫通部位の構造を変化させる。膜貫通部位へ膜分子が入り込み、中間状態を安定化させる。最後には、小胞体側のゲートが開き、カルシウムイオンが小胞体側へ排出される。
今後の期待
P型ATPaseは、ATPをエネルギー源とした膜内外の物質輸送に重要な役割を果たしています。これらのタンパク質では、輸送する物質が異なっていてもタンパク質の構造は共通しています。そのため、本研究で明らかになったSERCAの輸送に関わる分子機構は、ナトリウムカリウムポンプやプロトンポンプなどさまざまなP型ATPaseにも適用できる可能性があります。これらのポンプは生体内で重要な役割を担っており、それらの機能不全が原因の疾患も見つかっていることから、重要な創薬ターゲットの一つと考えられています。イオン輸送の分子機構を理解することは生命科学における基礎研究ですが、その本質的な理解はさまざまな創薬・医学の発展に貢献するものと期待できます。そのためには、「京」から「富岳」、さらには将来利用可能になるさらに高い演算能力を持つ計算機を用いて、先端的な計算科学研究を継続していく必要があります。
補足説明
1.小胞体
真核生物の細胞器官の一つで、生体膜に囲まれている。タンパク質合成などに関わるが、細胞にとってカルシウムの貯蔵庫の役割も持つ。
2.アデノシン三リン酸(ATP)、アデノシン二リン酸(ADP)
生物全般に存在するリン酸化合物の一つで三つのリン酸が結合していることから、三リン酸と呼ばれている。加水分解により一つのリン酸が解離するとアデノシン二リン酸となる。この加水分解で得られたエネルギーはさまざまな生体機能に利用されることから、エネルギー通貨のように呼ばれる。
3.スーパーコンピュータ「Oakforest-PACS」
東京大学情報基盤センターと筑波大学計算科学研究センターが共同運営する、最先端共同HPC基盤施設(JCAHPC: Joint Center for Advanced High Performance Computing)の持つスーパーコンピュータ。Intel Xeon Phiプロセッサによるメニーコア型マシンを8,028台搭載した国内最大級の超並列計算システムである。
4.スーパーコンピュータ「京」
文部科学省の「革新的ハイパフォーマンス・コンピューティング・インフラ(HPCI)の構築」計画の一環として理化学研究所と富士通社が共同開発したスーパーコンピュータ。約10ペタフロップスの処理能力を持つ。2012年に共用利用を開始し、2019年に運用を終了した。
5.分子動力学(MD)計算
計算機シミュレーション法の一つで、粒子(原子)間に働く相互作用力から運動方程式を解くことで微小時間後の原子の座標を求める方法。分子運動を求めるには、多量の繰り返し計算が必要であるため、原子数が多数になると計算リソースが多く必要となる。
6.ドメイン
タンパク質の中でコンパクトな立体構造を持ち、他の部分とは独立の構造、機能を持つ部分を指す。タンパク質の多くは複数のドメインによって成り立ち、ユニットとなっている。
7.ヘリックス
タンパク質の二次構造の一つで、らせん状の構造を持つ。
8.膜貫通部位
タンパク質の中で生体膜内に存在し、膜を貫通している部分。
9.X線結晶構造解析
X線を結晶に照射することで得られる回折データから原子・分子構造を解析する実験方法。タンパク質を結晶化し、解析することでタンパク質の立体構造情報を取得できる。
10.塩橋
タンパク質内で、正の電荷を持つ残基と負の電荷を持つ残基との間に働くイオン性相互作用のこと。
11.ループ
タンパク質内で決まった二次構造を持たない部分。柔軟であり、さまざまな構造を取り得る。異なる二次構造の間やドメインの間に存在する。
12.疎水性相互作用
非極性な(分子内で電荷の偏りがない)分子が、水などの極性溶媒内で溶媒との相互作用を避け、非極性分子同士で会合する作用。
共同研究チーム
理化学研究所
計算科学研究センター 粒子系生物物理研究チーム
チームリーダー 杉田 有治(すぎた ゆうじ)
(開拓研究本部 杉田理論分子科学研究室 主任研究員、生命機能科学研究センター 分子機能シミュレーション研究チーム チームリーダー)
技師 小林 千草(こばやし ちぐさ)
(運用技術部門 ソフトウェア開発技術ユニット 技師)
研究員 ジョン・ジェウン(Jung Jaewoon)
(開拓研究本部 杉田理論分子科学研究室 専任技師)
埼玉大学 大学院理工学研究科
准教授 松永 康佑(まつなが やすひろ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究、RIKEN Pioneering Project「Dynamic Structural Biology」、「 Biology of Intracellular Environments」)で実施し、文部科学省ポスト「京」重点課題(1)「生体分子システムの機能制御による革新的創薬基盤の構築」、同「富岳」成果創出加速プログラム「全原子・粗視化分子動力学による細胞内分子動態の解明(課題代表者:杉田有治)」、「プレシジョンメディスンを加速する創薬ビッグデータ統合システムの推進(課題代表者:奥野恭史)」、日本学術振興会(JSPS)科学研究費補助金基盤研究(S)「マルチスケール分子動力学シミュレーションによる細胞内分子動態の解明(研究代表者:杉田有治)」による支援を受けて行われました。
また、分子動力学シミュレーションは、理研「京」、HOKUSAI GreatWave/BigWaterfall、最先端共同HPC基盤施設(JCAHPC)「Oakforest-PACS」(課題番号hp170254, hp180201, hp180274, hp190097, hp190181, hp200129, hp200135)の計算資源の提供を受け、実施しました。
原論文情報
Chigusa Kobayashi, Yasuhiro Matsunaga, Jaewoon Jung, Yuji Sugita, “Structural and energetic analysis of metastable intermediate states in the E1P-E2P transition of Ca2+-ATPase”, Proceeding of the National Academy of Sciences of the United States of America, 10.1073/pnas.2105507118
発表者
理化学研究所
計算科学研究センター 粒子系生物物理研究チーム
チームリーダー 杉田 有治(すぎた ゆうじ)
(開拓研究本部 杉田理論分子科学研究室 主任研究員)
技師 小林 千草(こばやし ちぐさ)
研究員 ジョン・ジェウン(Jung Jaewoon)
(開拓研究本部 杉田理論分子科学研究室 専任技師)
報道担当
理化学研究所 広報室 報道担当