2021-10-28 国立がん研究センター,慶應義塾大学医学部,宮崎大学,京都大学,日本医療研究開発機構
発表のポイント
- 難治性血液がんである成人T細胞白血病リンパ腫(ATL)に対して、150例の臨床検体を用いた大規模な全ゲノム解析を実施し、従来の解析では発見できなかった様々なゲノム異常を網羅的に明らかにしました。
- 全ゲノム解析で判明した遺伝子異常に基づいて臨床像や予後の異なる病態を見出し、全ゲノム解析によるATLの新たな分類を提唱しました。
- ATLのゲノム異常の全体像が明らかになり、本研究の成果が新たな診断法や治療薬の開発基盤となることが期待されます。本研究は、がん研究における全ゲノム解析の重要性を改めて明らかとしました。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)研究所 分子腫瘍学分野 木暮泰寛研究員、古屋淳史主任研究員、慶應義塾大学医学部内科学教室(血液) 片岡圭亮教授(国立がん研究センター分子腫瘍学分野 分野長を兼任)らの研究グループは、宮崎大学医学部内科学講座血液・糖尿病・内分泌内科学分野 下田和哉教授、京都大学大学院医学研究科腫瘍生物学講座 小川誠司教授らと共同で、最新の全ゲノム解析技術を用いて、難治性血液がんのひとつである成人T細胞白血病リンパ腫(ATL)のゲノム異常の全体像を解明しました。
本研究結果は2021年10月25日(米国東部標準時)に米科学誌「Blood」に掲載されました。
ATLは、ヒトT細胞白血病ウイルス1型(HTLV-1)のウイルス感染を原因とする血液がんです。疫学的に、日本人に多いことが知られていますが、その頻度は10万人あたり年間約0.8人と低く、希少がんに該当します。また、有効な治療手段が限られた難治性がんでもあり、その解明と克服に向けた研究開発が進められるべき重要な疾患のひとつです。本研究は、ATLに関する初めての全ゲノム解析研究(注1)で、ATLの遺伝子異常に基づく病態をより詳細に明らかにしたものです。
今回の研究の主な成果は以下の点です。
- 150例のATLにおける大規模な全ゲノム解析を実施しました。タンパクコード領域および非コード領域における変異(注2)・構造異常(注3)・コピー数異常(注4)を横断的に解析し、56個のドライバー遺伝子(注5)を同定しました。
- ATLの新規ドライバー遺伝子としてCIC遺伝子を見出しました。CIC遺伝子では33%の患者で機能喪失型(注6)の異常を認め、CIC遺伝子の長いアイソフォーム(注7)に特異的な異常(CIC-L異常)が特徴的でした。さらに、マウスモデルの解析により、Cic-Lの異常がATL発症の仕組みと関連していることを示しました。
- また、ATL新規ドライバー遺伝子としてREL遺伝子を見出しました。ATLにおいてREL遺伝子の後半が欠損する構造異常が13%の患者で生じていました。さらに、REL遺伝子の構造異常はびまん性大細胞型B細胞性リンパ腫(注8)でもATLと同様に高頻度に認められることを明らかにしました。この異常によりREL遺伝子の発現量が高くなり、他のタンパクと協調してNF-κB経路を活性化させることにより、腫瘍化を促進することを見出しました。
- ATLにおけるタンパク非コード領域の変異の意義について検討しました。特に、スプライス部位(注9)の変異は免疫関連遺伝子を中心に繰り返し生じていました。これらの変異は実際にスプライシング(注9)の異常の原因となり、ATLのドライバー(注5)と考えられました。
- 全ゲノム解析で明らかになった遺伝子異常の情報を用いて、ATL患者が二群に分類できることを明らかにしました(分子分類・注10)。この二群は臨床所見が異なり、臨床病型と独立して予後を規定することを見出しました。
今回、全ゲノム解析によってATLの発病に関わる新たな機序が解明されました。このことは、がん研究において全ゲノム解析の手法が有用であることを示しています。また、本研究で得られた知見は難治性血液がんであるATLの新たな診断法や治療薬の開発につながる基盤となることが期待されます。
本研究は、独立行政法人 日本学術振興会 科学研究費助成事業、新学術領域研究(システム癌新次元)、国立研究開発法人 日本医療研究開発機構 革新的がん医療実用化研究事業、創薬基盤推進研究事業、国立研究開発法人 科学技術振興機構 ムーンショット型研究開発事業、公益財団法人 第一三共生命科学研究振興財団 PIセットアップ研究助成、公益財団法人 武田科学振興財団 武田報彰医学研究助成、一般社団法人 日本血液学会研究助成、Albert Einstein Cancer Center Pilot grant、National Institutes of Health/National Cancer Institute Cancer Center Support Grantの支援を受けて行われました。
背景
近年の技術革新によって、がんの遺伝子異常を調べるシーケンス解析がより低コストで実施できるようになり、大規模ながん患者集団における遺伝子異常の全体像を明らかにする取り組みがなされてきました。特に国際がんゲノムコンソーシアム(International Cancer Genome Consortium, ICGC)やThe Cancer Genome Atlas(TCGA)といった大規模ながんゲノムコンソーシアムにより、様々ながんにおける大規模な全ゲノム解析が実施され、がんの発生・進展の基盤となるドライバー異常の全体像が明らかにされつつあります。また、同定されたゲノム異常に基づいたがん治療の最適化の可能性も注目されています。しかしながら、このような取り組みは、希少がんに対しては十分に行われておらず、新規ドライバー異常の発見やゲノム異常に基づいた治療戦略の改善は未だ十分ではありません。
成人T細胞白血病リンパ腫(Adult T-cell leukemia/lymphoma, ATL)は造血器腫瘍(血液がん)の一種で、ヒトT細胞白血病ウイルス1型(HTLV-1)というウイルスに感染することが原因となります。この疾患は稀な疾患ですが、世界中でも日本における発症率が非常に高く、また造血幹細胞移植以外に治癒に至る治療法がない、予後不良の疾患です。現在でも本邦では年間約1,000名がATLを発症しています。
我々はこれまでに、HTLV-1感染者からATLが発症する際に様々な遺伝子異常が重要な役割を果たしていることを、全エキソン解析(注11)を主体とした網羅的解析を用いて明らかにしてきました。しかし、構造異常やゲノム上に存在する様々な機能を有するタンパク非コード領域(エンハンサー・サイレンサー・プロモーター、非翻訳領域、スプライス部位、ノンコーディングRNAなどの要素を含む)における異常などの、ATLのゲノム全体における遺伝子異常の解明はこれまで十分にはなされていませんでした(図1)。
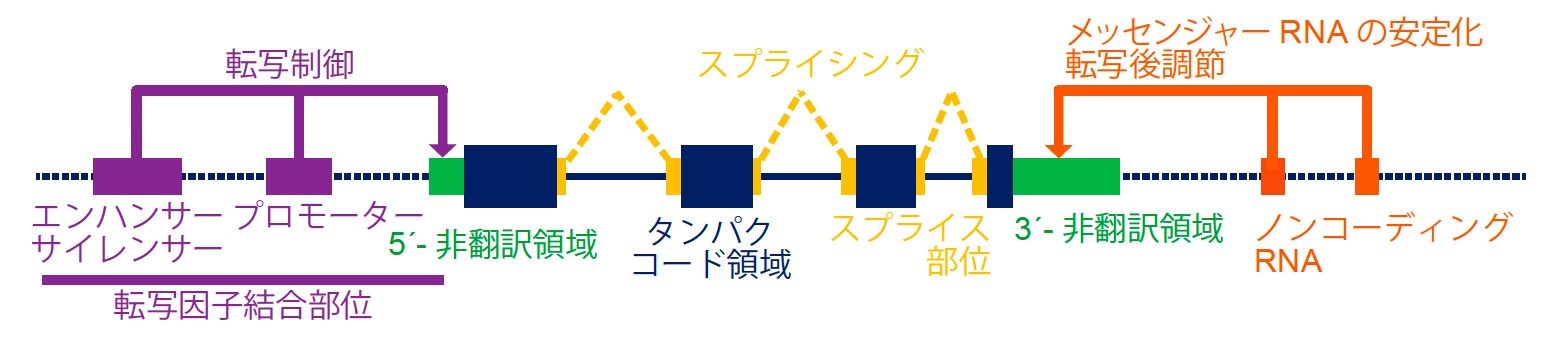
図1 ゲノム上にはタンパクコード領域の他に、様々な機能を有するタンパク非コード領域が存在している
研究方法・成果
全ゲノム解析の実施
今回、主に国内外の8施設・グループ(宮崎大学、鹿児島大学、熊本大学、長崎大学、京都大学、国立がん研究センター、Albert Einstein College of Medicine、University of Miami Miller School of Medicine)から合計150例のATLの検体および正常コントロール検体を収集し、全ゲノム解析を行いました。そのうち66例においてはRNAシーケンス解析も併用しました。この大規模なデータ解析は、東京大学医科学研究所附属ヒトゲノム解析センターのスーパーコンピュータSHIROKANEを用い、研究グループの白石友一・宮野悟が中心となって開発したGenomon2をはじめ、様々な解析ソフトウェアを組み合わせて実施されました。
腫瘍と正常検体のシーケンス深度(注12)の中央値はそれぞれ95.5×と33.7×でした。本研究は腫瘍検体におけるシーケンス深度がこれまでの研究より深く、異常の検出力が高いことが特徴です。全ゲノムデータを変異・構造異常・コピー数異常の観点から解析すると、全体で17,421個のタンパクコード領域の変異を含む2,110,948個の変異(100万塩基対あたり平均4.5個)が同定されました。また、10,145個の構造異常(サンプルあたり5から336個)と3,970箇所のコピー数異常(サンプルあたり0から165個)が検出されました。
CIC-ATXN1パスウェイ異常の発見
まず変異に着目した解析を行ったところ、ATLでは10個の新規遺伝子を含む合計47個の遺伝子が有意に変異していることが分かりました。特に、CIC遺伝子に頻繁な異常が認められました。CIC遺伝子は転写抑制因子であり、長短の2種類のアイソフォーム(それぞれCIC-LとCIC-S)が知られています。ATLにおいて、ほとんどすべて(95%)の変異は、CIC-Lに特異的な翻訳領域であるエキソン(Exon 2)で生じていました(図2左)。CIC-Lは最近発見されたアイソフォームであったため、これまでの研究で用いられた全エキソン解析の対象に含まれておらず、ほとんど研究されていませんでした。ATLで認められたCIC遺伝子の変異の半数以上は機能喪失型変異でした。CIC遺伝子の変異は、低悪性度神経膠腫や数種類の腺がんでも報告されていましたが、ATLにおける変異の種類と分布は他のがんとは明確に異なっていました。ATLにおいてはCIC遺伝子を破壊する構造異常も観察され、変異と合わせると、49例(33%)にCIC遺伝子の異常が同定され、そのほとんど(78%)が両アレル性であることから、CIC-Lのがん抑制遺伝子としての作用が強く示唆されました。
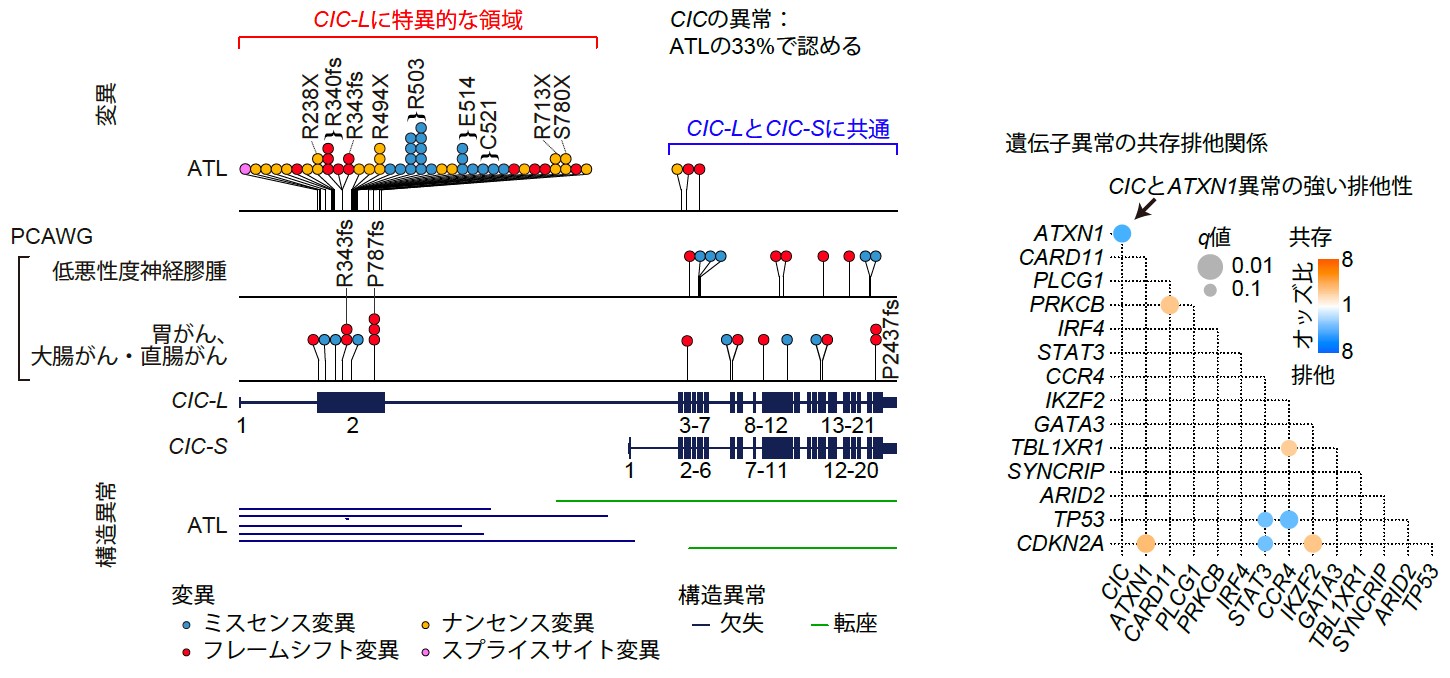
図2 ATLおよび他の固形がんにおけるCIC遺伝子異常の分布(左)と、ATLにおけるドライバー遺伝子異常の共存排他関係(右)
さらに興味深いことに、ドライバー異常の共存・排他関係を評価したところ、CIC遺伝子とATXN1遺伝子の異常の間に顕著な相互排他性が見いだされました(図2右)。実際、CICタンパクはATXN1タンパクと転写抑制複合体(CIC-ATXN1複合体)を形成することが知られており、相互排他性はこの関係を反映していると考えられました。ATLにおいては53%の症例でCIC遺伝子とATXN1遺伝子のどちらかの異常が認められることを踏まえると、CIC-ATXN1複合体がATLの発症に重要な役割を果たしていると考えられました。
我々はさらに、CIC-Lの機能不全による病態への影響を明らかにするために、Cicのアイソフォーム特異的なコンディショナルノックアウト(cKO)マウス(注13)を作製し、Cd4-Creトランスジェニックマウスと交配させて解析しました(図3)。その結果、T細胞の活性化や制御性T細胞(注14)の指標であるFoxp3が陽性のT細胞数がCic-L cKOマウスでは2倍近く増加しましたが、Cic-S cKOマウスでは変化を認めませんでした。このことから、CIC-Lの欠損がこれらの細胞の増加を誘導することが示され、CIC-LがT細胞の分化・増殖を制御する上で選択的に作用していることが分かりました。
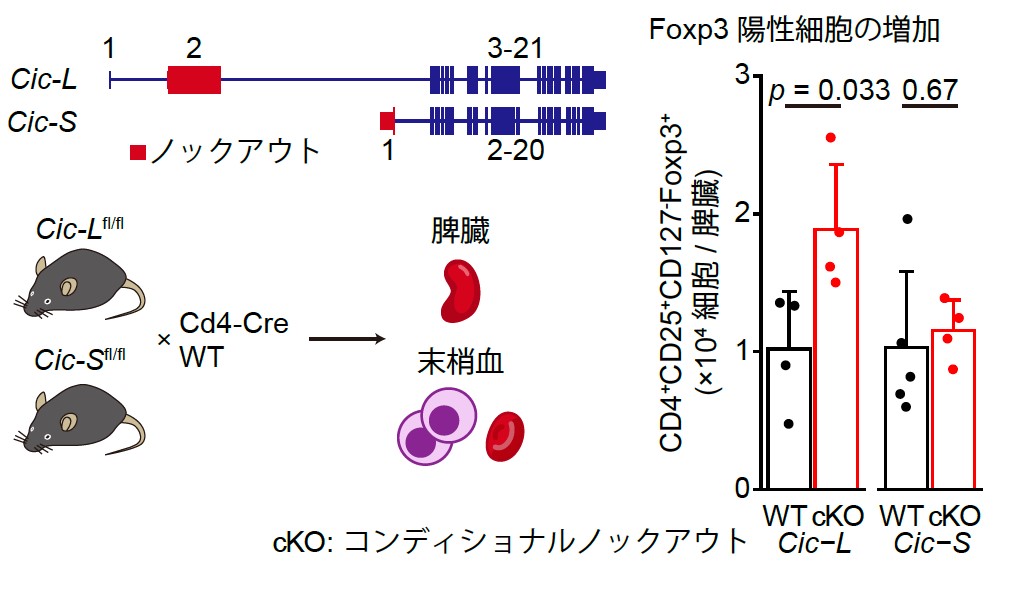
図3 Cic-L特異的ノックアウトによるFoxp3陽性細胞の増加。
REL遺伝子異常の発見
次に、我々は構造異常に着目しました。これまでのATLの報告によると、がん遺伝子(注15)のCARD11遺伝子やCD274 (PD-L1)遺伝子などでは構造異常の切断点が非翻訳領域である特定のイントロンに集中して生じていることが判明していました。すなわち、がん遺伝子の変異がホットスポット(注16)を形成しているのと同様に、がん遺伝子では遺伝子内の特定の領域に構造異常が集中していることが想定されました。このような機能獲得型(注17)の構造異常を同定するために、我々は各イントロンにおける構造異常の切断点の集積を統計学的に評価しました。この手法により、REL遺伝子のイントロン7ではCARD11遺伝子についで全遺伝子中2番目に有意な切断点の集積が生じていることが分かりました(図4左上)。REL遺伝子は、T細胞やB細胞の機能に深く関与する転写因子Rel/NF-κBファミリーの一員であるc-Relタンパクをコードしています。ATLでは、19例(13%)もの症例でREL遺伝子の構造異常が生じていました。
また、B細胞性リンパ腫の一種であるびまん性大細胞型B細胞性リンパ腫(DLBCL)ではRELのコピー数増幅が頻繁に観察されることから、公共データベースに登録された481例のDLBCLのRNAシーケンスデータを用いてATLと同様のREL遺伝子の構造異常を検索しました。驚くべきことに、ATLで発見されたものと同様の構造異常がDLBCLでも認められました。特に、DLBCLのcell-of-origin分類(注18)におけるGCB型では16例(12%)、分類不能型では6例(6%)もの頻度で生じていました(図4左下)。これらの構造異常ではATL・DLBCLの両方において、主に遺伝子の後半が欠失し、切断型の異常c-Relタンパクを生じると考えられました(図4中下)。REL遺伝子の構造異常はコピー数によらずREL遺伝子の発現上昇と関連しており(図4右上)、また切断型c-Relタンパクは実際に臨床検体において生成されていることを示しました。さらに、我々は切断型c-Relタンパクの生物学的機能について検討し、切断型c-RelタンパクはRel/NF-κBファミリーの他のメンバーであるRelAタンパクとの相乗効果によってNF-κBシグナルを活性化することを示しました(図4右下)。
以上より、ATLやDLBCLにおいて反復するREL遺伝子の構造異常は、REL遺伝子のmRNA発現を上昇させるだけでなく、機能獲得した切断型c-Relタンパクを生成し、ATLおよびDLBCLの発がんドライバーとして機能していることが分かりました。
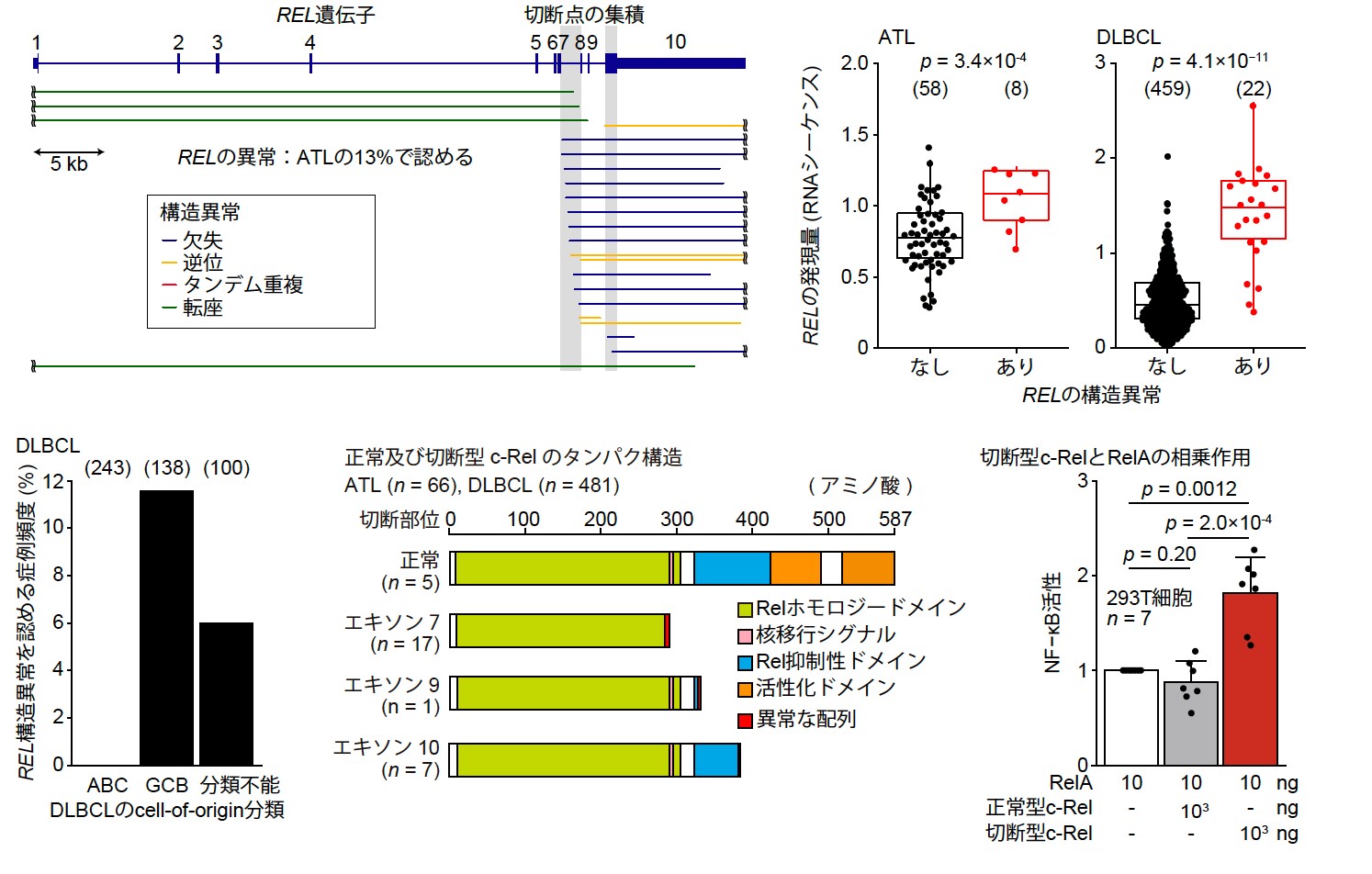
図4 ATL(左上)およびDLBCL(左下)において同定されたREL遺伝子を標的とする構造異常。遺伝子の後半を失ったc-Relタンパクを生じ(中下)、REL遺伝子の発現上昇(右上)やNF-κB経路の亢進(右下)と関連していた
タンパク非コード領域におけるゲノム異常
次に、我々はタンパク非コード領域の変異に着目しました。ATLにおけるタンパク非コード領域を複数のアルゴリズムを用いて調べたところ、有意な領域が11箇所同定されました(図5)。これらのうち、6個の遺伝子ではスプライス部位と関連していました。スプライス部位の変異はFAS遺伝子やHLA-A遺伝子、HLA-B遺伝子といった免疫関連分子で頻繁に生じており、実際にスプライシングの異常を引き起こしていました。これらのスプライス部位の異常はATLの発症に関連していると考えられます。
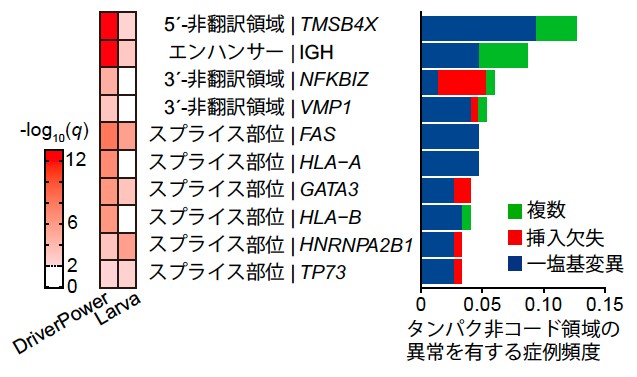
図5 ATLで繰り返し認められたタンパク非コード領域における変異
ATLにおける遺伝子異常の全体像と臨床所見の関連
以上の解析で着目してきたタンパクコード領域・非コード領域の変異、構造異常、コピー数異常をすべてまとめると、ATLでは56個のドライバー遺伝子が同定されました(図6上)。このうち、32個の遺伝子が10%以上の症例で異常を生じていました。ドライバー異常数の中央値は1例につき9個で、少なくとも1個のドライバー異常が150例中149例で見つかりました(99%以上)。全ゲノム解析で明らかになった遺伝子異常の頻度は、我々の以前のデータ(全エキソン解析が中心)と比較して、はるかに高頻度でした。
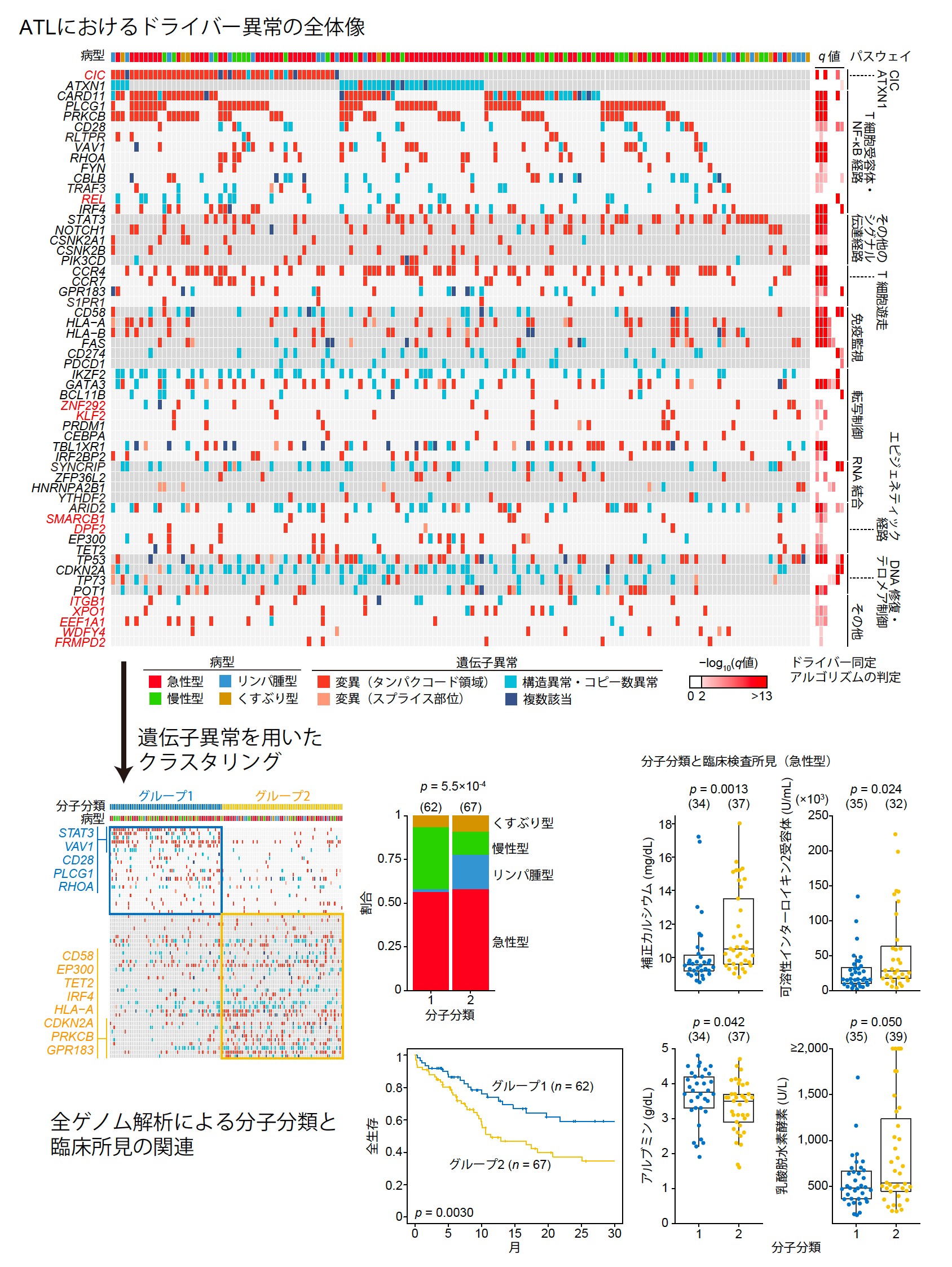
図6 全ゲノム解析に基づくATLのドライバー異常の全体像(上)と、全ゲノム解析に基づくATLの分子分類および臨床所見の関連(下)
最後に、全ゲノム解析により同定された56個のドライバー異常によって患者を分類することを試みました(分子分類・図6下)。2つのグループが同定され、グループ1では変異、構造異常、ドライバー異常がより少なく、T細胞受容体シグナル経路の近位構成遺伝子(PLCG1, VAV1, CD28, RHOA)とSTAT3遺伝子の異常が特徴的でした。一方グループ2では、T細胞受容体/NF-κBシグナル経路の遠位構成遺伝子(PRKCB, IRF4)、免疫関連分子(HLA-A, HLA-B, CD58)、エピジェネティック制御因子(EP300, TET2)の異常が特徴的でした。病型を比較すると、ほとんどのリンパ腫症例はグループ2に分類されていました。さらに、グループ2はグループ1に比べて予後不良であり、これは臨床病型と独立な予後因子でした。さらに、急性型ATLにおいて、グループ2はカルシウム、可溶性インターロイキン2受容体、乳酸脱水素酵素、アルブミンといった臨床検査値とも関連していることが示されました。これらの結果は、ATLの分子分類が生物学的および臨床的に重要であることを示しています。
展望
ATLは日本人に多く、有効な治療手段が限られていることから、日本がその解明と克服に中心的な役割を担うべき重要な疾患です。本研究は、ATLに関する初めての大規模な全ゲノム解析研究であり、これまで知られていたATLの遺伝学的基盤をより詳細に明らかにしたものです。特に、今回の解析によりCIC-LやRELといった遺伝子の異常が高頻度に生じていることを発見しました。さらには、ATL患者において、全ゲノム解析で得られた遺伝子異常のパターンが臨床所見や予後と関連することも示しました。
全ゲノム解析ではタンパクコード領域のみならず非コード領域を含めたがんゲノム全体にわたって多数の発見を同時に得ることができ、全ゲノム解析が今後のがん研究において不可欠であることを示しています。また、本研究により蓄積された全ゲノムシーケンスデータは、今後ATLの診断および治療戦略を改善するための基盤となることが期待されています。我々は今後もゲノム解析の技術革新を図り、さらなる発がんメカニズムの全容解明を目指します。さらにはその技術を臨床現場に応用していけるよう取り組んでまいります。
発表論文
雑誌名
Blood
タイトル
Whole-genome landscape of adult T-cell leukemia/lymphoma.
著者
木暮 泰寛、亀田 拓郎、古屋 淳史、吉満 誠、野坂 生郷、安永 純一朗、今泉 芳孝、渡邊 瑞希、斎藤 優樹、伊藤 勇太、Marni B. McClure、田畑 真梨子、新垣 清登、吉藤 康太、千葉 健一、岡田 愛、垣内 伸之、南谷 泰仁、上運天 綾子、田平 優貴、秋月 渓一、関根 雅明、幣 光太郎、日高 智徳、久冨木 庸子、北中 明、日高 道弘、中野 伸亮、宇都宮 與、R. Alejandro Sica、Ana Acuna-Villaorduna、Murali Janakirum、Urvi Shah、Juan Carlos Ramos、柴田 龍弘、竹内 賢吾、高折 晃史、宮崎 泰司、松岡 雅雄、石塚 賢治、白石 友一、宮野 悟、小川 誠司、B. Hilda Ye、下田 和哉、片岡 圭亮
掲載日
2021年10月25日
研究費
独立行政法人 日本学術振興会 科学研究費助成事業 基盤A
「悪性リンパ腫における遺伝子異常を基盤とした発症機構・分子病態の統合的解明」(JP21H04809)
独立行政法人 日本学術振興会 科学研究費助成事業 基盤S
「悪性リンパ腫における遺伝子異常を基盤とした発症機構・分子病態の統合的解明」(JP21H05051)
独立行政法人 日本学術振興会 科学研究費助成事業 新学術領域研究(システム癌新次元)
「成人T細胞白血病リンパ腫におけるノンコーディングゲノム異常の解明」(JP18H04907)
国立研究開発法人 日本医療研究開発機構 革新的がん医療実用化研究事業
「遺伝子異常の全貌とクローン構造の理解に基づくATL個別化診療の確立」(JP21ck0106538)
「成人T細胞白血病・リンパ腫(ATL)最適化医療の確立とハイリスクキャリアの同定」(JP19ck0106254)
国立研究開発法人 日本医療研究開発機構 創薬基盤推進研究事業
「成人T細胞白血病リンパ腫に対するレナリドミド作用機序の解明を目指した研究」(JP19ak0101064)
国立研究開発法人 科学技術振興機構 ムーンショット型研究開発事業
「生体内ネットワークの理解による難治性がん克服に向けた挑戦」(JPMJMS2022)
公益財団法人 第一三共生命科学研究振興財団 PIセットアップ研究助成
「成人T細胞白血病リンパ腫における全ゲノム解析による新規遺伝子異常の探索」
公益財団法人 武田科学振興財団 武田報彰医学研究助成
「先端ゲノム技術を用いたリンパ腫発症の分子病態基盤の統合的解明」
一般社団法人 日本血液学会研究助成
「成人T細胞白血病リンパ腫における新規ドライバー異常の生物学的・臨床的意義の解明」
Albert Einstein Cancer Center Pilot grant
National Institutes of Health/National Cancer Institute Cancer Center Support Grant (P30 CA008748)
用語解説
注1 ゲノム
ある生物の持つ全ての遺伝情報、あるいはそれを保持するDNA の塩基配列の全体のこと。ヒトのゲノムは約30億塩基対からなる。ゲノムはタンパクコード領域とそれ以外のタンパク非コード領域に大別されるが、それらを区別することなく全遺伝情報を解析する手法が全ゲノム解析である。大量並列シーケンサー(次世代シーケンサー)技術の進歩とスーパーコンピュータの利用により、大量の塩基配列を短時間かつ低コストで解析することが可能となった。
注2 変異
ゲノムDNAに生じる異常の一種で、1から十数塩基対程度の短い挿入・欠失や一塩基置換からなる。
注3 構造異常
ゲノムDNAに生じる異常のうち、長さが数十塩基対以上(典型的には数千から百万塩基対以上)のものや、染色体をまたいだ異常を指す。短い挿入・欠失や一塩基置換とは区別される。欠失、タンデム重複、逆位、転座に分類される。
注4 コピー数異常
正常では2コピー(父由来・母由来)あるゲノムDNAが、1コピー以下(欠失)、あるいは3コピー以上(増幅)となっている現象。
注5 ドライバー遺伝子・ドライバー
異常をきたすことで、がんの発生・進行などの直接的な原因となる遺伝子のこと。がん遺伝子とがん抑制遺伝子からなる。ドライバー遺伝子に生じ、がんの発生や進行に関与する異常をドライバー(ドライバー異常)と呼ぶ。
注6 機能喪失(型)
遺伝子の機能を減じたり消失させたりすること。対義語は機能獲得。
注7 アイソフォーム
単一の遺伝子から類似した複数のタンパクを生じることがあり、それら一連のタンパクをアイソフォームと呼ぶ。
注8 びまん性大細胞型B細胞性リンパ腫
Bリンパ球由来の悪性リンパ腫の一種。悪性リンパ腫の中で最も患者数が多い病型であり、全リンパ腫のおよそ30から40%を占める。
注9 スプライス部位・スプライシング
DNAから転写されたRNAのうち、タンパク合成に不要な部分(イントロン)を除き、必要な部分(エキソン)を連結する反応のことをスプライシングと呼ぶ。スプライシングが生じる部位は決まっており、スプライス部位と呼ばれる。
注10 分子分類
遺伝子異常の有無や遺伝子発現の違いといった情報によって腫瘍の亜型を分類すること。
注11 全エキソン解析
タンパクコード領域(エキソン領域。全ゲノム領域の約1から1.5%)に対象を絞ったゲノム解析のこと。タンパクに翻訳されるため機能的に重要であり、大部分のがんはエキソン領域の変異と関連しているといわれている。全ゲノム解析に比べてコストパフォーマンスに優れている一方、解析から除外されたタンパク非コード領域で生じた異常を同定することは困難である。
注12 シーケンス深度
ゲノム内の各塩基を平均で何回読み取ったかを示す値で、数値が高いほど変異の検出力が向上する。例えば、全ゲノムを90×でシーケンスしたとはゲノム内の各塩基を平均90回読んだことを意味する。
注13 コンディショナルノックアウトマウス
マウスにおいて特定の臓器を形成する細胞でのみターゲット遺伝子の破壊を起こすことができる技術であり、条件特異的遺伝子破壊とも呼ばれる。今回はCD4陽性T細胞に特異的にCic-LまたはCic-S遺伝子を破壊する目的で用いた。
注14 制御性T細胞
Foxp3の発現により特徴づけられるTリンパ球の一種である。制御性T細胞あるいは活性化T細胞はATLの発生母体であるともいわれている。
注15 がん遺伝子
遺伝子の変異などによって異常に活性化した結果、がん化を引き起こす作用を有する遺伝子のことをいう。対義語はがん抑制遺伝子。
注16 ホットスポット
遺伝子変異などが集中した特定の箇所のこと。主にがん遺伝子において高頻度に認められ、機能獲得を示唆する。
注17 機能獲得(型)
遺伝子の機能を増強したり新たな機能を与えたりすること。対義語は機能喪失。
注18 DLBCLのcell-of-origin分類
DLBCLの遺伝子発現パターンに基づいた分子分類。Activated B-cell-like (ABC)型、germinal center B-cell-like (GCB)型、分類不能型からなる。
問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立がん研究センター
研究所 分子腫瘍学分野
木暮 泰寛
慶應義塾大学医学部
内科学教室(血液)
片岡 圭亮
機関窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
慶應義塾大学
信濃町キャンパス総務課
宮崎大学
企画総務部総務広報課広報係
京都大学
総務部広報課 国際広報室
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課 革新的がん医療実用化研究事業事務局